Смещение равновесия в реакции гидролиза
Все рассмотренные выше реакции гидролиза являются обратимыми. Смещение химического равновесия в них происходит согласно принципу Ле Шателье. Так, добавление кислоты в раствор соли меди препятствует протеканию гидролиза, а добавление щёлочи усиливает гидролиз.
Существуют соли, из которых нельзя приготовить раствор – они полностью разлагаются водой на образующие их кислоту и основание. В этом случае говорят, что идёт полный гидролиз: Cr2S3 + 6H2O → 2Cr(OH)3↓ + 3H2S↑.
Полному гидролизу подвергаются соли, образованные слабым нерастворимым или нестойким основанием и слабой, неустойчивой или летучей кислотой. Продукт гидролиза в таких реакциях выпадает в осадок или выделяется из раствора в виде газа, и принимать участие в обратной реакции не может. Полный гидролиз необратим.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЙ ЗАДАЧ ТРЕНИРОВОЧНОГО МОДУЛЯ
1. Расчет количества продукта реакции гидролиза
Условие задачи: Сколько граммов мыла можно получить в результате гидролиза 150 г стеаратпальмитатолеат глицерина, если выход продукта составляет 85%? Ответ запишите в виде целого числа.
Шаг первый: Запишем уравнение реакции гидролиза стеаратпальмитатолеат глицерина.
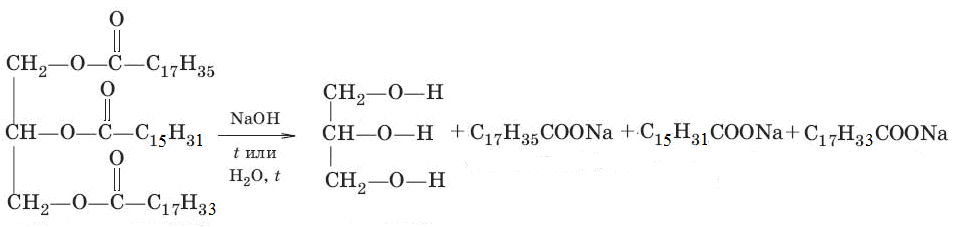
Шаг второй: Найдем молярную массу жира.
М = 12·(17+15+17+6) +1·(35+31+33+5) + 16·6 = 860 (г/моль).
Шаг третий: Найдем молярные массы натриевых солей стеариновой, пальмитиновой и олеиновой кислот (мыла):
М (стеарат натрия) = 12·17 + 35 + 12 + 16·2 + 23 = 306 (г/моль);
|
|
|
М (пальмитат натрия) = 12·15 + 31 + 12 + 16·2 + 23 = 278 (г/моль);
М (олеат натрия) = 12·17 + 33 + 12 + 16·2 + 23 = 304 (г/моль).
Шаг четвёртый: найдем массу каждой соли ри 100%-ном выходе продукта. Для этого составим пропорцию:
Из 860 г жира образуется 306 г стеарата натрия;
из 150 г жира образуется х1 г стеарата натрия.
х1 = (150·306) : 860 = 53 (г ).
Из 860 г жира образуется 278 г пальмитата натрия;
из 150 г жира образуется х2 г пальмитата натрия.
х2 = (150·278) : 860 = 48 (г).
Из 860 г жира образуется 304 г олеата натрия;
из 150 г жира образуется х3 г олеата натрия.
х2 = (150·304) : 860 = 53 (г).
Шаг пятый: найдем общую массу мыла при 100%-ном выходе продукта реакции. Для этого сложим найденные массы стеарата, пальмитата и олеата натрия: 53 + 48 + 53 = 154 (г).
Шаг шестой: найдем массу мыла при 85%-ном выходе продукта реакции.
Для этого найденную массу мыла умножим на выход продукта и разделим на 100: т = 154·85 : 100 = 131 (г).
Ответ: 131
1. Расчёт рН раствора гидролизованной соли
Условие задачи: Чему равен водородный показатель (рН) раствора сульфата цинка, если в 200 мл раствора находится 10-5 моль ионов водорода?
Ответ запишите с точностью до десятых долей.
Шаг первый: найдём концентрацию ионов водорода в 1 л раствора.
Для этого известное количество ионов водорода разделим на 200 мл и умножим на 1000 мл (1 л = 1000 мл):
|
|
|
(10-5 : 200)·1000 = 5·10-5 моль/л.
Шаг второй: найдем рН этого раствора
Для этого вычислим отрицательный логарифм концентрации ионов водорода: рН = -lg[H+] = - lg(5·10-5) = 4,3.
Ответ: 4,3.
Сообщить об ошибке в уроке
Дата добавления: 2020-12-12; просмотров: 235; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
