Гидролиз неорганических солей
ЗАДАНИЕ К УРОКУ № 11
Дата 14.11.2020 Группа ис-106
Дисциплина/МДК/УП: Химия
Темы уроков: Гидролиз органических и неорганических соединений
План занятия:
1. Изучите материал за 11 класс урок 7 на сайте РЭШ https://resh.edu.ru/subject/lesson/5912/start/92791/
2. Тема содержит и органику и неорганику.
3. Задание (по желанию) отправить голосовое сообщение о гидролизе только в неорганике, до 2 минут сообщение. Высылать в личку в ВК. Самое главное из темы «Гидролиз неорганических соединений». Срок до 17.00 сегодня
Желаю удачи
Конспект урока
Химия, 11 класс
Урок № 7. Гидролиз органических и неорганических соединений
Перечень вопросов, рассматриваемых в теме:
· Понятие гидролиза;
· вещества, подвергаемые гидролизу;
· смещение равновесия в реакциях гидролиза;
· реакция среды при гидролизе солей.
Урок посвящён изучению реакций гидролиза органических и неорганических соединений: условиям протекания реакций гидролиза, уравнениям реакций гидролиза, равновесию в реакции гидролиза.
Глоссарий
Гидролиз – реакция ионного обмена между молекулами органических или неорганических соединений и водой, в результате которой исходное соединение разрушается и происходит изменение реакции среды.
Жиры – сложные эфиры многоатомных спиртов, в которых гидроксильные радикалы замещены на кислотные остатки кислородсодержащих кислот.
Константа диссоциации – константа равновесия процесса диссоциации электролита на ионы, равна отношению произведения концентраций образовавшихся ионов к концентрации не распавшихся на ионы молекул, причем все концентрации возведены в степени, равные стехиометрическим коэффициентам.
|
|
|
рН среды – водородный показатель, равен отрицательному десятичному логарифму концентрации ионов водорода рН = - lg[H+]
Полный гидролиз – необратимый процесс разложения водой вещества до образовавших его соединений.
Сильные электролиты – соединения, степень диссоциации которых в воде более 30%.
Слабые электролиты – соединения, степень диссоциации которых в воде не превышает 3%.
Сложный эфир – продукт замещения иона водорода в карбоновой кислоте на углеводородный радикал.
Степень диссоциации – количественная характеристика электролита, равная отношению числа молекул, распавшихся на ионы, к общему числу молекул в растворе, выраженная в процентах.
Углеводы – органические соединения, в состав которых входит несколько гидроксильных групп и карбонильная группа.
Электролит – вещество, раствор или расплав которого проводит электрический ток.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
|
|
|
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тесто по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
· Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Гидролиз органических соединений
Гидролизом называют реакцию ионного обмена между веществом и водой, в результате которой происходит разложение вещества и изменяется реакция среды. Примером может служить известная вам реакция гидролиза сложных эфиров.
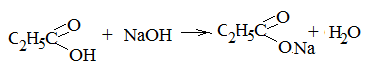
Реакция гидролиза обратима. Чтобы сместить равновесие в сторону прямой реакции, необходимо, чтобы один из продуктов реакции расходовался в какой-то другой реакции. Например, если проводить гидролиз в присутствии щёлочи, кислота превратится в соль, которая в обратной реакции участвовать не может.
|
|
|
Реакция щелочного гидролиза жиров используется при производстве мыла.
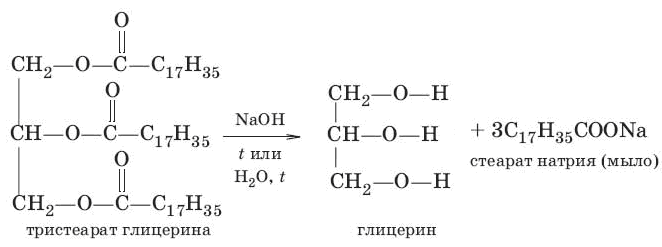
В результате кислотного гидролиза полисахаридов из крахмала и целлюлозы можно получить глюкозу: (С6Н10О5)п + пН2О → пС6Н12О6
При нагревании белков в кислой или щелочной среде происходит гидролиз. Макромолекулы белков сначала распадаются на отдельные полипептиды, которые, в свою очередь, распадаются на крупные, а затем и на мелкие пептиды. В конечном результате продуктом гидролиза белков являются аминокислоты. В живых организмах гидролиз белков происходит под действием ферментов. Благодаря этой реакции организм получает строительный материал для синтеза новых белков.
Гидролиз неорганических солей
В реакцию гидролиза вступают растворимые в воде соли, образованные хотя бы одним слабым электролитом. Одним из продуктов реакции будет малодиссоциирующее соединение, при этом изменится рН среды.
Соль – это продукт взаимодействия основания и кислоты. Все соли можно разделить в зависимости от силы образующих их электролитов на 4 группы:
1. Соль образована сильным основанием и слабой кислотой: Na2CO3, K2S.
2. Соль образована слабым основанием и сильной кислотой: CuSO4, NiCl2.
|
|
|
3. Соль образована слабым основанием и слабой кислотой: Fe(CH3COO)3, (NH4)2CO3.
4. Соль образована сильным основанием и сильной кислотой: NaCl, KNO3.
Рассмотрим гидролиз карбоната натрия. В растворе соль полностью распадается на ионы: Na2CO3 ↔ 2Na+ + CO32-.
Na+ - от сильного основания NaOH (α = 87%);
CO32- - от слабой кислоты Н2СО3 (α = 0,06%).
Молекулы воды представляют собой диполи, состоящие из положительно заряженного иона водорода и отрицательно заряженной гидроксильной группы. Гидроксид натрия – сильный электролит, поэтому ион натрия взаимодействовать с молекулами воды не будет. Угольная кислота – слабый электролит, поэтому карбонат-ионы будут взаимодействовать с полярными молекулами воды с образованием слабого электролита – гидрокарбонат-иона. Среда при этом становится щелочной.
CO32- + Н+-ОН- ↔ НСО3- + ОН- ; Na2CO3 + H2O ↔ NaHCO3 + NaOH.
Рассмотрим гидролиз хлорида железа (III). В растворе соль полностью диссоциирует на ионы: FeCl3 ↔ Fe3+ + 3Cl-.
Fe3+ - от слабого основания Fe(ОН)3 (α = 0,0007%);
Cl- - от сильной кислоты НCl (α = 100%).
Ион хлора с молекулами воды не взаимодействует, так как соляная кислота – сильный электролит. Ионы железа будут взаимодействовать с молекулами воды, так как гидроксид железа (III) – слабый электролит. В результате образуется слабый гидроксокатион железа (III) и кислая среда.
Fe3+ + Н+-ОН- ↔ FeОН2+ + Н+; FeCl3 + H2O ↔ FeОНCl2 + HCl.
Если соль образована слабым основанием и слабой кислотой, то гидролизу подвергаются как катион, так и анион. Реакция среды при этом будет близка к нейтральной. Например, ацетат меди в воде диссоциирует на ион меди и ацетат-ионы. Cu(CH3COO)2 ↔ Cu2+ + 2CH3COO-
Cu2+ - от слабого основания Cu(ОН)2 (α = 0,0006%);
СН3СОО- - от слабой кислоты СН3СООН (α = 0,42%).
Оба типа ионов взаимодействуют с молекулами воды, при этом образуется слабый электролит гидроксокатион меди и слабая уксусная кислота.
Cu2+ + Н+-ОН- ↔ CuОН+ + Н+; CH3COO- + Н+-ОН- ↔ СН3СООН + ОН-;
Cu(CH3COO)2 + H2O ↔ CuОН(СН3ОО) + СН3СООН.
Если соль образована сильным основанием и сильной кислотой, то такая соль в реакцию гидролиза не вступает, так как в ней не может образоваться слабый электролит. Реакция среды остаётся нейтральной.
Дата добавления: 2020-12-12; просмотров: 179; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
