II .Общие для органических кислот
Тема «Карбоновые кислоты»
Задание : В тетради записать краткий конспект урока !!!
Карбоновые кислоты — класс органических соединений, молекулы которого содержат карбоксильную группу - COOH. Она называется карбоксильной, потому что состоит из карбонильной - С=О и гидроксильной групп - ОН
Общая формула : R – (СООН) m , m – число карбоксильных групп:
2. Классификация карбоновых кислот:
1. В зависимости от числа карбоксильных групп в молекуле:
- Одноосновные – НСООН - метановая
- Двухосновные – НООС-СООН - щавелевая
- Многоосновные – лимонная.
2. В зависимости от природы радикала:
- Предельные – Н3С-СООН – этановая
- Непредельные – Н2С=СН-СООН - акриловая
- Ароматические – С6Н5-СООН - бензойная.
Предельные одноосновные кислоты
На нашем уроке более подробно мы рассмотрим одноосновные карбоновые кислоты. Состав и общая формула: CnH 2 n +1 COOH
Гомологический ряд предельных одноосновных кислот
| № | Формула кислоты | Название кислоты | Тривиальное название кислоты | Название соли |
| 1 | HCOOH | Метановая | Муравьиная | Формиат |
| 2 | CH3 COOH | Этановая | Уксусная | Ацетат |
| 3 | C2 H5 COOH | Пропановая | Пропионовая | Пропионат |
| 4 | C3 H7COOH | Бутановая | Масляная | Бутират |
| 5 | C4 H9COOH | Пентановая | Валериановая | Валериат |
| 6 | C5 H11 COOH | Гексановая | Капроновая | Капронат |
Изомерия
|
|
|
Для карбоновых кислот, как и для альдегидов характерна изомерия углеродного скелета (начиная с С4) и межклассовая – сложные эфиры (с С2).
1.Изомерия углеродной цепи.
СН3-СН2-СН2-СООН СН3- СН-СООН
СН3
масляная кислота 2-метилприпионовая кислота
2.Межклассовая изомерия - со сложными эфирами :
Например: С4 Н8 О2
СН3 — СН2 — СО — О — СНз СН3 — СО — О — CH2 — СН 3
метиловый эфир пропановой кислоты этиловый эфир этановой кислоты
СН3-СН2-СН2 – СООН
бутановая кислота
Физические свойства карбоновых кислот
С1- С3 -жидкости с характерным резким запахом, хорошо растворимые в воде
С4 – С9- вязкие маслянистые жидкости с неприятным запахом, плохо растворимые
в воде
С10 - …. - твердые вещества, не имеющие запаха, не растворимые в воде.
Среди кислот в отличие от альдегидов нет газообразных веществ. Значения температур кипения карбоновых кислот аномально высокие. Причина этого – наличие водородных связей. Образованием водородных связей можно объяснить растворимость карбоновых кислот в воде.
|
|
|
Общие способы получения
а)В промышленности
1.Окисление альдегидов: 2RCHO + O2 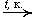 2RCOOH
2RCOOH
Лабораторные окислители: Ag2O, Cu(OH)2, KMnO4, K2Cr2O7 и др.
2.Окисление спиртов: RCH2OH + O2 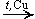 RCOOH + H2O
RCOOH + H2O
3.Окисление углеводородов:
- каталитическое окисление бутана: 2C4H10 + 5O2 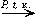 4CH3COOH + 2H2O
4CH3COOH + 2H2O
- каталитическое окисление метана: 2 CH 4 + 3 O 2 → 2 H – COOH + 2 H 2 O
4.Гидролиз сложных эфиров: СН3-СОО-С2Н5 + Н-ОН→ СН3СООН + С2Н5ОН
Б) лабораторный способ
- из солей карбоновых кислот: CH3COONaкр. + H2SO4 конц. 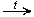 CH3COOH
CH3COOH 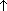 + NaHSO4
+ NaHSO4
- специфический способ получения муравьиной кислоты - получают нагреванием оксида углерода (II) с порошкообразным гидроксидом натрия под давлением и обработкой полученного формиата натрия сильной кислотой: NaOH + CO → HCOONa ; HCOONa + H2SO4 →HCOOH + Na2SO4
Химические свойства
Карбоксильная группа содержит высокополяризованную карбонильную группу. Атом углерода карбонильной группы, имеющий частичный положительный заряд, оттягивает на себя электроны связи С – О. Неподеленная пара электронов атома кислорода гидроксильной группы взаимодействует с электронами  – связи карбонильной группы. Это приводит к большему оттягиванию электронов от атома водорода гидроксильной группы увеличению полярности связи О – Н по сравнению со спиртами, а также уменьшению положительного заряда на атоме углерода карбонильной группы кислот по сравнению с альдегидами. В отличие от спиртов, ,кислоты диссоциируют с образованием ионов водорода Н+. В отличие от альдегидов для них не характерны реакции присоединения по двойной связи.
– связи карбонильной группы. Это приводит к большему оттягиванию электронов от атома водорода гидроксильной группы увеличению полярности связи О – Н по сравнению со спиртами, а также уменьшению положительного заряда на атоме углерода карбонильной группы кислот по сравнению с альдегидами. В отличие от спиртов, ,кислоты диссоциируют с образованием ионов водорода Н+. В отличие от альдегидов для них не характерны реакции присоединения по двойной связи.
|
|
|
Для предельных монокарбоновых кислот характерна высокая реакционная способность. Кислотные свойства обусловлены подвижностью атома водорода карбоксильной группы и являются общими с неорганическими кислотами. Рассмотрим основные общие свойства на примере уксусной кислоты.
I .Общие для всех кислот:
1.Диссоциация: Н3С-СООН → Н3С-СОО- + Н+
Универсальная индикаторная бумага приобретает розовый цвет, а не красный как мы предполагаем, значит, уксусная кислота – слабая кислота, так же как и ее гомологи. В гомологическом ряду их сила уменьшается с ростом числа атомов углерода в молекуле:
2. Взаимодействие с активными металлами: 2 СН3СООН +Zn = (СН3СОО)2Zn +H2
ацетат цинка
|
|
|
3. Взаимодействие с основными оксидами: 2СН3СООН + СаО = (СН3СОО)2Са +Н2О
ацетат кальция
4. Взаимодействие со щелочами: СН3СООН +NaOH = СН3СООNa +Н2О
ацетат натрия
5. Взаимодействие с солями более слабых кислот: 2 СН3СООН +Na2CO3 = 2 СН3СООNa + H2O +CO2
II .Общие для органических кислот
1. Реакции этерификации: СН3СООН + С2Н5-ОН → СН3СООС2Н5 + Н2О
2.Реагируют с аммиаком: CH 3 COOH + N Н3 → CH 3 COON Н4
Дата добавления: 2020-12-12; просмотров: 80; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
