Реагирует с основными оксидами
Материалы урока
Кислородные соединения азота
Оксиды.
Азот образует пять оксидов со степенями окисления +1, +2, +3, +4, +5.
Оксиды N2О и NО не солеобразующие, а остальные оксиды — кислотные: N2O3 соответствует азотистая кислота НNО2, а N2О5 — азотная кислота НNO3. Оксид азота (IV) NО2, при растворении в воде образует одновременно две кислоты — HNO2 и НNO3.
Если же он растворяется в воде в присутствии избытка кислорода, получается только азотная кислота
4NО2 + О2 + 2Н2О = 4НNO3
Оксид азота(IV) NO2 — бурый, очень ядовитый газ. Он легко получается при окислении кислородом воздуха бесцветного несолеобразующего оксида азота(П):
2NO + О2 = 2NO2
Азотная кислота
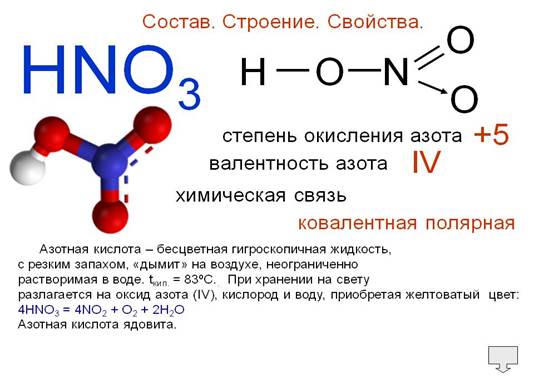
 |
Азотная кислота высокой концентрации выделяет на воздухе газы, которые в закрытой бутылке обнаруживаются в виде коричневых паров (оксиды азота). Эти газы очень ядовиты, так что нужно остерегаться их вдыхания.
Азотная кислота окисляет многие органические вещества. Бумага и ткани разрушаются вследствие окисления образующих эти материалы веществ. Концентрированная азотная кислота вызывает сильные ожоги при длительном контакте и пожелтение кожи на несколько дней при кратком контакте. Пожелтение кожи свидетельствует о разрушении белка и выделении серы (качественная реакция на концентрированную азотную кислоту – жёлтое окрашивание из-за выделения элементной серы при действии кислоты на белок – ксантопротеиновая реакция). То есть – это ожог кожи. Чтобы предотвратить ожог, следует работать с концентрированной азотной кислотой в резиновых перчатках.
|
|
|
Получение
Лабораторный способ
KNO3 + H2SO4(конц) → KHSO4 + HNO3 (при нагревании)
Промышленный способ
Осуществляется в три этапа:
a) Окисление аммиака на платиновом катализаторе до NO
4NH3 + 5O2 → 4NO + 6H2O (Условия: катализатор – Pt, t = 500˚С)
б) Окисление кислородом воздуха NO до NO2
2NO + O2 → 2NO2
в) Поглощение NO2 водой в присутствии избытка кислорода
4NO2 + О2 + 2H2O ↔ 4HNO3
или
3NO2 + H2O ↔ 2HNO3+NO (без избытка кислорода)

Применение
· в производстве минеральных удобрений;
· в военной промышленности;
· в фотографии — подкисление некоторых тонирующих растворов;
· в станковой графике — для травления печатных форм (офортных досок, цинкографических типографских форм и магниевых клише).
· в производстве взрывчатых и отравляющих веществ
Химические свойства азотной кислоты
Для азотной кислоты характерны свойства: общие с другими кислотами и специфические:
ХИМИЧЕСКИЕ СВОЙСТВА ОБЩИЕ С ДРУГИМИ КИСЛОТАМИ
Очень сильная кислота. Индикаторы в её растворе изменяют цвет на красный.
|
|
|
Диссоциирует в водном растворе практически нацело:
HNO3 → H+ + NO3-
Реагирует с основными оксидами
K2O + 2HNO3 → 2KNO3 + H2O
K2O + 2H+ + 2NO3- → 2K+ + 2NO3- + H2O
K2O + 2H+ → 2K+ + H2O
Реагирует с основаниями
HNO3 + NaOH → NaNO3 + H2O
H+ + NO3- + Na+ + OH- → Na+ + NO3- + H2O
H+ + OH- → H2O
Дата добавления: 2021-03-18; просмотров: 32; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
