Гепато-ренальный синдром (ГРС).
Под ГРС понимают функциональную олигурическую прогрессирующую, но в то же время обратимую патологию почек, возникающую при тяжелых заболеваниях печени с печеночной недостаточностью, когда исключены другие причины, способствующие повреждению почек. Функциональный характер почечной недостаточности у больных с асцитом на фоне цирроза печени был подтвержден полным восстановлением функции почек после их трансплантации и после пересадки печени.
К развитию ГРС у больных циррозом печени может привести проводимая агрессивная терапия диуретиками, удаление большого объема асцитической жидкости, чрезмерное ограничение жидкости, т. к. у них крайне чувствителен водный баланс. В связи с этим для профилактики ГРС следует проводить разумную диуретическую терапию, избегать приема нефротоксических препаратов, особенно при циррозе печени.
Патогенез ГРС — это сложный многоэтапный процесс, приводящий в конечном итоге к формированию почечной недостаточности. Один из этапов — значительная ренальная вазоконстрикция, которая приводит к снижению почечной перфузии и клубочковой фильтрации, азотемии и повышению уровня сывороточного креатинина (основному симптому ГРС).
Развитие ГРС у больного циррозом печени с желтухой, асцитом, устойчивым к мочегонным препаратам, печеночной энцефалопатией часто бывает спровоцировано приемом нестероидных противовоспалительных препаратов, парацентезом, желудочно-кишечным кровотечением, инфекцией, хирургическим вмешательством. В 1996 г. Международным обществом по асциту были впервые разработаны диагностические критерии ГРС, которые включали большие и малые критерии. В 2005 г. были предложены новые диагностические критерии ГРС при циррозе печени: цирроз печени с асцитом, уровень сывороточного креатинина более 133 мкмоль/л, отсутствие нормализации содержания сывороточного креатинина после двухдневной, как минимум, отмены диуретиков и введения альбумина, отсутствие шока, данных об использовании нефротоксических веществ, а также отсутствие каких-либо паренхиматозных заболеваний почек.
|
|
|
ГРС следует отличать от «псевдогепаторенального» синдрома, возникающего при заболеваниях, при которых одновременно поражаются печень и почки.
В настоящее время в зависимости от тяжести клинических проявлений и прогноза выделяют два типа ГРС:
1-й тип — острый быстропрогрессирующий (летальность в течение 2-х недель достигает 80%);
2-й тип — наблюдается постепенное, в течение нескольких месяцев, снижение функции почек. Основной клинический синдром — рефрактерный асцит (прогноз несколько лучше, чем у пациентов с ГРС 1-го типа).
|
|
|
Возможности лечения ГРС ограничены в связи с потерей функции двух жизненноважных органов — печени и почек. Основой терапии является улучшение функции печени, т. к. значительное восстановление пораженной печени всегда приводит к обратному развитию ГРС. Терапевтическая тактика при ГРС 1-го и 2-го типов может существенно отличаться в виду различий в патогенезе, тяжести клинических проявлений и прогнозе. Трансплантация печени является терапией выбора для всех пациентов с тяжелым циррозом печени, в том числе и для тех, у которых развился ГРС.
Диагностика.
Диагностика включает тщательное изучение анамнеза с целью выяснения причины, которая привела к ОПН, а также: общий анализ крови и мочи, биохимическое исследование крови (креатинин, мочевина, электролиты, коагулограмма и др.), ультразвуковое исследование почек (рис. 5). План дальнейшей диагностики будет зависеть от причины, вызвавшей ОПН. Биопсия почки при ренальной ОПН показана только в сложных диагностических случаях (например, анурия более 4 недель, плохо контролируемая артериальная гипертензия, ОПН в сочетании с нефротическим синдромом и др.).

Рис. 5. Ультразвуковое исследование почек при ОПН. а) 1, 2 — почки больного, перенесшего большую кровопотерю во время операции на сердце; контуры границ почек выделяются слабо (стрелки), четкость архитектоники паренхимы смазана, почки имеют вид анатомического продольного среза на уровне чашечно-лоханочной системы; б) 1, 2 — почки (поперечный срез) больного с острым токсическим отравлением: увеличены в размере, отечны, расширены пирамидки (стрелки), стерта граница между паренхимой и чашечно-лоханочной системой.
|
|
|
Для оценки тяжести состояния больного с ОПН основное значение имеют показатели азотистого обмена, прежде всего креатинина, уровень которого в крови не зависит от особенностей питания больного и поэтому более точно отражает степень нарушения функции почек. Задержка креатинина обычно опережает повышение содержания мочевины, хотя динамика уровня последней также важна для оценки прогноза при ОПН (особенно при вовлечении в процесс печени).
Оценка скорости клубочковой фильтрации с использованием формул Cockroft-Gault или MDRD (см. ниже) при ОПН не используется. Наиболее важным при оценке динамики ОПН является мониторинг ежедневных изменений креатинемии и диуреза.
Лечение.
Пациенты с ОПН нуждаются в госпитализации в специализированный нефрологический стационар с возможностью проведения экстренного гемодиализа, перитонеального диализа, гемофильтрации.
|
|
|
Больного необходимо ежедневно взвешивать и определять диурез. Диета включает ограничение потребления белка при сохранении калорийности рациона с целью предотвращения распада собственных белков организма. Также необходимо ограничение поваренной соли. Питьевой режим зависит от фазы заболевания.
Лечение ОПН включает в себя консервативное (этиологическое, патогенетическое, симптоматическое), хирургическое (урологическое, сосудистое), а также активную заместительную почечную терапию (диализные методы). В первую очередь необходимо лечить болезнь, являющуюся основной причиной ОПН:
· коррекция гемодинамических нарушений (гиповолемия, шок), которая может привести к обратному развитию преренальной ОПН;
· удаление нефротоксических веществ;
· устранение обструкции мочевыводящих путей при постренальной ОПН. До устранения обструкции антибактериальную терапию проводить нельзя из-за возможного развития эндотоксического шока! Обструкцию нижних мочевых путей выявляют (и, как правило, устраняют) при катетеризации мочевого пузыря.
Также показана симптоматическая терапия в зависимости от наличия осложнений (электролитные нарушения, инфекции, кровотечения, анемия, артериальная гипертензия и др.). При проведении инфузионной терапии необходимо учитывать внепочечные потери (включая испарение ~500 мл/сут.). После восстановления диуреза возникает опасность потери воды и электролитов. Гипонатриемия — это признак избыточного введения гипотонической жидкости, а гипернатриемия может быть следствием высокого диуреза при недостаточном введении жидкости. Магнийсодержащие препараты больному противопоказаны. Из-за сниженного выведения фосфата почками, даже при ограничении поступления фосфора с пищей, возможна гиперфосфатемия. Для связывания фосфата в кишечнике может понадобиться назначение алюминийсодержащих антацидов (на короткое время). Препараты эритропоэтина с целью коррекции анемии при ОПН не применяются (при необходимости возможно переливание эритроцитарной массы).
Необходимость проведения гемодиализа оценивается ежедневно.
Показания к гемодиализу:
- клинические:
· гипергидратация (отек легких, артериальная гипертензия, застойная сердечная недостаточность);
· появление симптомов уремии (тремор, энцефалопатия, тошнота, рвота);
· уремический перикардит;
· уремический геморрагический диатез;
- биохимические:
· стойкая рефрактерная гиперкалиемия (свыше 6,5 ммоль/л);
· декомпенсированный метаболический ацидоз.
Более подробная информация о диализных методах лечения представлена ниже (лечение хронической почечной недостаточности).
Прогноз.
Прогноз при своевременном и правильном применении адекватных методов лечения благоприятный, особенно при пре- и постренальной ОПН. При ренальной ОПН полное выздоровление происходит в 35-40% случаев, смертность составляет 30-40%. Прогностическими показателями при ОПН являются: длительность анурии (менее 7 суток — прогноз благоприятный у 100% больных, более 14 суток — прогноз благоприятный у 50% больных); возраст пациента; развитие осложнений, а также причина, приведшая к ОПН.
Развитие ОПН при акушерско-гинекологических осложнениях приводит к летальному исходу в 20% случаев, а после травм и хирургических вмешательств еще выше. Это зависит в том числе от присоединения инфекции (сепсис), возраста больных и других факторов.
Приблизительно 5% пациентов в дальнейшем нуждаются в лечении диализными методами.
Профилактика.
Профилактика ОПН сводится к предотвращению причин, вызывающих ее. Большинство больных с ОПН выздоравливают и возвращаются к нормальной жизни, т. к. ОПН обратима: почки в отличие от большинства органов способны восстанавливать полностью утраченные функции. Однако у части больных снижение клубочковой фильтрации и концентрационной способности почек остается, а у некоторых почечная недостаточность принимает хроническое течение, важную роль при этом играет присоединившийся пиелонефрит. Вместе с тем, ОПН — это крайне тяжелое осложнение множества заболеваний, нередко предвещающих смерть. В запущенных случаях смерть при ОПН чаще всего наступает от уремической комы, нарушений гемодинамики и сепсиса.
Профилактика ОПН особенно важна у пациентов, которые принадлежат к группе риска (новорожденные, больные старше 60 лет, с метаболическим синдромом, с анасаркой, с имеющейся патологией почек и др.). У них необходимо не допускать резкого снижения артериального давления и объема циркулирующей крови, избегать использования рентген-контрастных препаратов, нефротоксических медикаментов и др.
В последнее время количество больных хронической почечной недостаточностью (ХПН) ежегодно увеличивается на 10–12%. Заболеваемость ХПН в европейской популяции составляет 600 на 1 млн. взрослого населения. Ранее самой частой причиной ХПН был гломерулонефрит, сейчас в большинстве стран на первый план выходит сахарный диабет (71 на 1 млн. в год) и артериальная гипертензия (57 на 1 млн. в год). Т. е. среди лиц, находящихся на хроническом гемодиализе, 25% составляют больные диабетической и гипертонической нефропатией. В Российской Федерации среди причин ХПН преобладает гломерулонефрит. В странах Африки и Азии главные причины ХПН — поражение почек при паразитарных заболеваниях (малярийная и шистосомозная нефропатии) и нефропатии при вирусных инфекциях (ВИЧ, вирусы гепатитов В и С и др.). Среднегодовой прирост количества пациентов, нуждающихся в заместительной почечной терапии, составляет примерно 6%.
Одной из причин ХПН является длительный неконтролируемый прием анальгетиков, который приводит к развитию анальгетической нефропатии, занимающей заметное место в отдельных странах в структуре ХПН. Запрет безрецептурной продажи анальгетиков в Европе привел к снижению частоты анальгетической нефропатии, требующей диализа, с 3% до 1%, а в Швейцарии — с 28% до 12%.
Классификация.
В настоящее время ранее используемые классификации ХПН заменяются Международной классификацией хронической болезни почек (ХБП) (см. табл. 1), понятием, которое объединяет все возможные признаки хронического почечного поражения и позволяет описать его течение исходя из единых критериев. Согласно этой классификации определение ХПН соответствует V стадии ХБП. В Российской Федерации термин «хроническая почечная недостаточность» сохраняется применительно к пациентам с ХБП III-IV стадий, а термин «терминальная хроническая почечная недостаточность» — к пациентам с ХБП V стадии.
Хроническая болезнь почек — наличие признаков повреждения почек (изменения в анализах мочи, данные визуализирующих методов исследования) с или без снижения скорости клубочковой фильтрации (СКФ) в течение 3 месяцев или более, независимо от причины.
Хроническая почечная недостаточность — симптомокомплекс, развивающийся вследствие уменьшения числа (гибель 75% и более нефронов) и изменения функции оставшихся нефронов, что приводит к нарушению экскреторной и инкреторной деятельности почек, всех видов обмена и изменениям во всех системах организма.
Классификация ХБП
| Стадия | Характеристика | СКФ, мл/мин/1,73 м2 | Креатинин, ммоль/л | Рекомендации |
| I | Поражение почек с нормальной или повышенной СКФ | ≥90 | <0,123 | Лечение ХБП |
| II | Поражение почек с незначительным снижением СКФ | 60–89 | 0,123–0,176 | Лечение ХБП, ренопротекция |
| III | Умеренное снижение СКФ (латентная ХПН) | 30–59 | 0,177–0,352 | Лечение ХБП, ренопротекция, лечение осложнений |
| IV | Значительное снижение СКФ (выраженная ХПН) | 15–29 | 0,353–0,528 | Лечение ХБП, ренопротекция, лечение осложнений, подготовка к ТЗП |
| V | Терминальная стадия почечной недостаточности (уремия) | <15 | >0,528 | ТЗП, лечение осложнений |
ТЗП — терапия замещающая почки (диализные методы и трансплантация). Определение СКФ см. ниже.
Понятие «ренопротекция» предусматривает проведение мер сопроводительной терапии, способствующих возможно более долгому сохранению функции почек (при ХПН имеется в виду остаточной функции почек). Так, ренопротекторными свойствами обладают ингибиторы АПФ и антагонисты рецепторов ангиотензина II (сартаны). Заместительная терапия, например эритропоэтином, также способствует ренопротекции. Целесообразность ранней коррекции анемии способствует увеличению додиализного времени, замедлению снижения функции почек. Благодаря этому отмечается значительное повышение качества и продолжительности жизни больных с ХБП за счет органопротекции других органов, в первую очередь сердца и головного мозга.
Этиология.
Причинами развития ХПН могут стать различные заболевания:
· заболевания почек, протекающие с преимущественным поражением клубочков (гломерулонефрит);
· заболевания почек, протекающие с преимущественным поражением почечных канальцев и интерстиция (пиелонефрит, нефрит);
· болезни обмена веществ (сахарный диабет, подагра, амилоидоз и др.);
· наследственные и врожденные заболевания почек (поликистоз, гипоплазия почек и др.);
· диффузные заболевания соединительной ткани (системная красная волчанка, системная склеродермия, геморрагические васкулиты и др.);
· первичное поражение сосудов (артериальная гипертензия, стеноз почечных артерий);
· обструктивные нефропатии (мочекаменная болезнь, гидронефроз, простатит или аденома предстательной железы, другие опухоли, приводящие к постепенному сдавлению мочевыводящих путей);
· ВИЧ-нефропатия;
· лекарственные нефропатии.
Несмотря на многообразие этиологических факторов, морфологические изменения в почках при выраженной ХПН однотипны и представлены фибропластическими процессами с замещением функционирующих нефронов соединительной тканью, гипертрофией оставшихся нефронов и утратой морфологического своеобразия заболевания, приведшего к ХПН (рис. 1).

Рис. 1. Морфологические изменения при ХПН. Значительная часть почечных клубочков склерозирована и гиалинизирована. Соответствующие им канальцы атрофированы (эпителий уплощен), эпителий сохранившихся канальцев в состоянии белковой дистрофии. Сохранные клубочки несколько увеличены в размерах, многоклеточны за счет пролиферации мезангиальных клеток, с синехиями, утолщенными базальными мембранами капилляров. Отмечается лимфогистиоцитарная инфильтрация и склероз интерстиция. Стенки артерий и артериол склерозированы и гиалинизированы.
Патогенез.
Почки обладают большими компенсаторными возможностями, и гибель даже 50% из общего количества 2 млн. нефронов может не сопровождаться никакими клиническими проявлениями. Только при снижении СКФ до 30–40 мл/мин (что соответствует уменьшению численности нефронов до 30%) в организме происходит задержка продуктов азотистого обмена. В терминальной стадии ХПН величина нефронной популяции составляет менее 10%.
Резкое снижение количества действующих нефронов при ХПН проявляется в неспособности почек поддерживать нормальный гомеостаз.
Основные нарушения гомеостаза при ХПН:
- снижение выведения продуктов азотистого обмена;
- нарушение поддержания водно-электролитного равновесия;
- нарушение регуляции кислотно-основного состояния, которое приводит к развитию метаболического ацидоза;
- расстройства регуляции фосфорно-кальциевого обмена.
Также отмечается ухудшение эндокринных функций почки (уменьшение выработки эритропоэтина, изменение почечной прессорно-депрессорной системы).
Задержка конечных продуктов азотистого обмена (в первую очередь мочевины, креатинина) еще недавно считалась одной из причин наблюдаемых изменений в различных органах и тканях. Исследования последних лет полностью не подтвердили это предположение. Мочевина, повышение которой вызывает тошноту, рвоту, склонность к кровоточивости, головную боль, является, по-видимому, наименее токсичным продуктом. Также имеется мало доказательств токсичности креатинина. Хотя некоторые продукты его распада (креатин, саркозин, метиламин, N-метилгидантоин) очевидно могут оказывать токсический эффект. Поиск уремических токсинов продолжается. В последнее время основная роль отводится низко- и среднемолекулярным продуктам обмена белков.
В первую очередь при ХПН происходит нарушение обмена натрия, калия, кальция, фосфора. Выведение натрия с мочой может быть как повышенным, так и пониженным. Калий в норме выводится преимущественно почками (95%), поэтому при ХПН калий может накапливаться в организме, несмотря на то, что функцию по его выведению принимает на себя кишечник. Кальций, напротив, утрачивается, поэтому его в крови при ХПН недостаточно.
Механизмы компенсации при ХПН включают в себя усиление активности сохранившихся нефронов (гиперфильтрация, которая приводит к прогрессированию их поражения) и адаптивную перестройку работы всех прочих органов и систем.
У больных ХПН нарушается способность быстро реагировать на резкие колебания уровня натрия и воды. Потери натрия (понос, рвота и др.) не сопровождаются его компенсаторной задержкой. Вместо этого продолжается потеря натрия с мочой, что приводит к гипонатриемии, уменьшению объема внеклеточной жидкости, гипотонии, резкому сужению сосудов почек и далее к резкому ухудшению почечной функции. Таким образом формируется порочный круг (рис. 2).
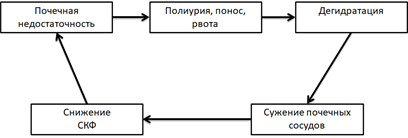
Рис. 2. Порочный круг патогенеза ХПН.
Клиника.
На развитие и прогрессирование ХПН влияют различные факторы:
- немодифицируемые (возраст, пол, генетические и расовые особенности);
- инициирующие (иммунные, гемодинамические, метаболические);
- модифицируемые (артериальная гипертензия, протеинурия, гипергликемия, дислипидемия, курение).
Скорость прогрессирования ХПН в основном зависит от артериальной гипертензии и протеинурии.
ХПН может нарастать различными темпами, давать неожиданные ремиссии, а может, особенно под влиянием инфекции, травмы и других неблагоприятных факторов, в течение нескольких дней закончиться смертью. Еще R. Bright (Ричард Брайт, «Брайтова болезнь», 1805 г.) писал о таких ремиссиях с возвращением больного к активной деятельности и терминальной олигурии, «свертывании жизни», отеке легких, коматозном статусе и зловещем уремическом перикардите.
Внешние проявления ХПН, как и лабораторные признаки почечной недостаточности (основной показатель — СКФ), начинают выявляться при утрате 65–75% нефронов.
Клиническая картина ХПН зависит от степени снижения СКФ.
Латентная ХПН (ХБП III стадии) (снижение СКФ до 59–30 мл/мин.). В этот период основными клиническими признаками ХПН являются полидипсия, полиурия и никтурия. При этом полиурия носит постоянный характер даже при ограничении приема жидкости. Также больные отмечают неспецифические симптомы: повышенную утомляемость, слабость, недомогание, иногда возникающую сухость во рту, снижение аппетита, утреннюю тошноту. У более чем 50% больных наблюдается артериальная гипертензия. Возможно развитие эритропоэтиндефицитной анемии (ЭДА) легкой степени («анемия брайтиков») (см. ниже).
Выраженная ХПН (ХБП IV стадии) характеризуется снижением СКФ до 29–15 мл/мин. В этой стадии клиническая картина становится более яркой за счет вовлечения в патологический процесс других органов и систем. Чаще всего нижеперечисленные симптомы возникают потому, что другие органы, например кожа, желудочно-кишечный тракт и пр., пытаются взять на себя функцию почек по выведению продуктов азотистого обмена и не справляются с этим. Проявляясь отдельными синдромами, которые иногда трактуются как самостоятельные заболевания, ХПН может быть диагностирована только после лабораторно-инструментальных исследований (уровень креатинина, СКФ и др.).
Уремическая энцефалопатия (слабость, утомляемость, сонливость днем, бессонница ночью, эмоциональная лабильность: апатия сменяется возбуждением), как правило, может сочетаться с периферической неврологической симптоматикой (токсический полиневрит с нарушением двигательной активности и расстройствами чувствительности) вплоть до развития уремической комы с большим шумным ацидотическим дыханием (дыхание Куссмауля) и вялой тетраплегии при развитии уремии.
Гипертензивный синдром развивается у 80% больных, часто сопровождаясь сердечной астмой, ретинопатией, ускоряя прогрессирование почечной недостаточности.
Кардиальный синдром (проявление токсической миокардиодистрофии) характеризуется клинической картиной застойной сердечной недостаточности с «ритмом галопа», нарушениями ритма, а также развитием в терминальной стадии уремического перикардита с выраженным шумом трения перикарда («похоронный звон»).
Гастродуоденит, в том числе эрозивно-язвенный, энтероколит сопровождаются диспептическим синдромом, который проявляется тошнотой, рвотой, снижением аппетита до развития анорексии, метеоризмом, расстройством стула — чаще диареей или, реже, запором. Возможно развитие стоматита, глоссита, хейлита.
Выраженность отечно-асцитического синдрома зависит от избытка жидкости в организме, наличия гипопротеинемии, первоначально проявляясь одутловатостью лица, периферическими отеками, а затем достигает анасарки. За счет этого синдрома маскируется снижение массы тела, которое обусловлено гипотрофией мышц вследствие снижения альбумина в сыворотке крови.
Бронхо-пульмональный синдром протекает в виде уремического бронхита за счет бронхиальной обструкции в результате токсического отека слизистой оболочки бронхов и вторичного бронхоспазма. В терминальной стадии возможно развитие «уремического легкого» (картина при рентгенисследовании напоминает двухстороннюю пневмонию: двухсторонние облаковидные инфильтраты, идущие от ворот легкого (имеющие форму крыла бабочки), связанные с общей гипергидратацией и левожелудочковой недостаточностью или с повышенной транссудацией из легочных капилляров); сухого и экссудативного плеврита.
Нарушение фосфорно-кальциевого обмена (дефицит витамина D, нарушение секреции паратгормона) приводит к развитию почечной остеодистрофии. При этом наблюдается деминерализация костей с прогрессирующим остеопорозом, сопровождающаяся оссалгией, артралгиями, спонтанными переломами костей.
Суставной синдром связан с наличием длительной задержки мочевой кислоты («уремическая подагра») с характерной болью в суставах, тофусами.
Эндокринные расстройства проявляются импотенцией, аменореей, гинекомастией, связанными с задержкой пролактина.
Клинические проявления синдрома электролитных нарушений зависят от патологических изменений различных электролитов (гипо-, гиперкалиемия и др.).
Геморрагически-анемический синдром проявляется носовыми, кишечными, маточными кровотечениями, подкожными кровоизлияниями, в том числе за счет тромбоцитопении, нарушений агрегационной функции тромбоцитов. При осмотре кожные покровы бледно-желтоватого цвета (сочетание анемии и задержки урохромов).
При ХБП анемия, как правило, носит эритропоэтиндефицитный характер. При развитии ХПН присоединяется (не всегда) железодефицитный компонент и, в меньшей мере, белково-витаминодефицитный, также анемия может быть обусловлена миелотоксическим эффектом уремических токсинов. ЭДА является разновидностью анемий, этиологическим фактором которых выступает дефицит эритропоэтина, вырабатывающегося преимущественно почками. Однако существует мнение, что у взрослых незначительное количество эритропоэтина может вырабатываться печенью и астроцитами нервной ткани.
В зависимости от механизма развития выделяют преренальную и ренальную ЭДА.
Преренальная ЭДА развивается при гиповолемических состояниях, преренальной ОПН. Снижение продукции эритропоэтина происходит вследствие дефицита кислорода в почках при недостатке перфузируемой через них крови.
Ренальная ЭДА связана с дефицитом кислорода в почках вследствие тубулярных поражений или на фоне гиперактивности ренин-ангиотензиновой системы.
По клиническому развитию ЭДА может быть скрытой и острой (например, при ОПН). По течению различают обратимую (например, при ОПН) и необратимую (например, при ХПН) ЭДА.
При ЭДА анемия носит нормоцитарный нормохромный характер. Для диагностики используется тест на определение сывороточного содержания эритропоэтина. Также необходимо определить уровень железа, ферритина, витамина В12, фолиевой кислоты, альбумина.
Терминальная стадия почечной недостаточности (ХБП V стадии) характеризуется интоксикацией организма конечными продуктами азотистого обмена — уремией (от греч. urina — моча, haima — кровь, т. е. «мочекровие»), которая проявляется вышеуказанными симптомами с их постепенным прогрессированием (СКФ составляет менее 15 мл/мин). Также отмечаются гипотермия, охриплость голоса. Волосы становятся тусклыми и ломкими. При осмотре кожные покровы сухие, со следами расчесов (за счет высокой концентрации мочевины в поте на поверхности кожи может наблюдаться «уремический иней»). Характерна коричневая пигментация кожных покровов, которая, возможно, обусловлена ретенцией меланоцитстимулирующего гормона. Язык сухой, коричневого цвета, изо рта исходит специфический сладковатый «уремический» запах (запах мочи или аммиака, который образуется при расщеплении мочевины слюной, но не мочевины, которая не имеет запаха). Уремия характеризуется специфическим изменением артерий — кальцификацией, ограниченной их средней оболочкой (в отличие от атеросклероза, при котором кальцификации подвергаются атероматозные бляшки). Нарушается иммунитет, что значительно повышает восприимчивость организма к бактериальным инфекциям. При отсутствии заместительной почечной терапии развивается уремическая кома с летальным исходом.
Диагностика.
Содержание мочевины крови подвержено влиянию экстраренальных факторов (перегрузка белковой пищей; белковый катаболизм, вызванный инфекциями, тяжелыми операциями, ожогами; обезвоживание) и поэтому не так точно отражает состояние почечной функции, как креатинин. В свою очередь, концентрация креатинина в плазме крови зависит от возраста и мышечной массы, поэтому в диагностике ХПН решающее значение принадлежит вычислению СКФ по формулам (см. ниже).
Также необходимо выполнить следующие лабораторно-инструментальные методы исследования: общий анализ крови (нормохромная нормоцитарная анемия, лейкоцитоз, лимфопения, тромбоцитопения) и мочи (альбуминурия, протеинурия, низкая относительная плотность мочи, микро/макрогематурия, цилиндрурия); биохимическое исследование крови (креатинин, мочевина, мочевая кислота, электролиты, коагулограмма, липидограмма и др.); ЭКГ; рентгенисследование органов грудной клетки; ультразвуковое исследование почек (уменьшение размеров почек) (рис. 3); радионуклидная ренография, которая основана на способности канальцевого эпителия почек извлекать из кровотока и секретировать меченый 131I-гиппуран (при ХПН ренографические кривые — плоские и вытянутые). Исследования, при которых используется контрастное вещество (например, компьютерная томография), проводятся только в случае крайней необходимости, т. к. высока вероятность развития контраст-индуцированной нефропатии (см. выше). Назначение остальных методов исследования зависит от причины, приведшей к ХПН, а также от преобладания поражения той или иной системы (например, при поражении органов желудочно-кишечного тракта необходимо проведение ФГДС и др.). Однако диагностика нозологической формы, приведшей к ХПН, тем сложнее, чем позже стадия ХПН. В терминальной стадии различия причин ХПН стираются, поэтому отличить ХПН от ОПН сложно, если нет анамнеза заболевания и медицинской документации. Однако наличие стойкой нормохромной анемии в сочетании с полиурией, артериальной гипертензией и симптомами гастроэнтерита говорит в пользу ХПН.
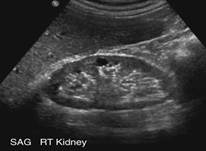
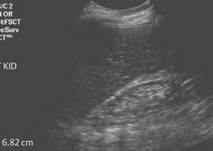

Рис. 3. Ультразвуковое исследование почек при ХПН. А — у пациента с ХПН почка маленького размера, гиперэхогенна, сглажена кортикомедуллярная дифференциация, паренхима истончена. Б, В — у пациентов в терминальной стадии ХПН очень маленькие (6,82 и 5,64 см) гиперэхогенные почки трудно обнаружить в забрюшинной клетчатке. Их можно визуализировать по движению при дыхании.
Основные методики функционального исследования почек: определение СКФ с помощью различных формул, вычисление канальцевой реабсорбции, проведение пробы Зимницкого (изучение водовыделительной и концентрационной функций).
При проведении пробы Реберга для определения СКФ вычисляется коэффициент очищения (клиренс) эндогенного креатинина. Методика проведения: утром натощак больной мочится, через 30 минут у пациента берут кровь из вены, через 60 минут после этого больной снова мочится. Во второй порции мочи и в крови определяется содержание креатинина и далее рассчитывается клиренс, выражающий величину СКФ, по формуле:

Самая частая ошибка — занижение СКФ из-за неполного сбора мочи. Также в этой формуле не учитывается масса тела, возраст и другие показатели, от которых зависит уровень креатинина, поэтому данная проба используется все реже.
Для вычисления СКФ предлагается следующая формула:

, где:
m — масса тела в кг,
Ж — данный коэффициент используется только для женщин,
Кр. крови — креатинин крови в мкмоль/л.
Для определения СКФ также используются формулы Cockroft-Gault, MDRD (учитывающие возраст, пол, расовую принадлежность, антропометрические данные, концентрацию сывороточного креатинина). В Интернете есть сайты для расчета этих формул. Определение СКФ возможно с помощью экзогенных маркеров (инулин и др.).
Канальцевая реабсорбция — разница между СКФ и минутным диурезом, вычисляемая в процентах к СКФ (норма — 97–99%):
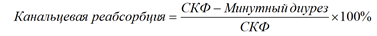
С помощью пробы Зимницкого определяются: объем мочи и ее относительная плотность в трехчасовых порциях; суточное количество мочи; количество мочи, выведенное за дневное и ночное время. Методика проведения: исследование выполняется на обычном питьевом режиме без приема мочегонных препаратов. Моча последовательно собирается в 8 банок, которые нумеруются по-порядку с указанием фамилии больного, а также промежутками времени, за которые моча должна собираться в каждый сосуд. В норме в течение суток с мочой выводится около ¾ выпитой жидкости. Дневной диурез примерно в два раза превышает ночной. Объем отдельных порций мочи и их относительная плотность колеблются в зависимости от количества выпитой жидкости. Разница между максимальной и минимальной относительной плотностью в различных порциях мочи должна быть не менее 12. При ХПН в зависимости от стадии возможно наличие полиурии (увеличение диуреза свыше 1800 мл), олигурии (диурез менее 500 мл), никтурии (одинаковый дневной и ночной диурез или превышение ночного диуреза над дневным); низкая относительная плотность мочи во всех порциях с колебаниями ее в отдельных порциях менее 12 (гипоизостенурия).
Пациентам с ХПН необходима консультация окулиста, который при исследовании глазного дна может выявить уремическую ретинопатию с отеком соска зрительного нерва, кровоизлияния, отслойку сетчатки. Задачей невролога является диагностика и коррекция лечения уремической энцефалопатии и полиневрита. При наличии обструктивной нефропатии необходима консультация уролога.
Лечение.
Лечение ХПН заключается в предупреждении и устранении метаболических нарушений и поддержании остаточной функции почек.
В начальных стадиях лечение ХПН проводится параллельно с лечением основного заболевания, цель которого — добиться стойкой ремиссии или замедлить прогрессирование процесса. При наличии препятствий на пути оттока мочи оптимально устранить их хирургическим путем. В дальнейшем на фоне продолжения лечения основного заболевания большая роль отводится симптоматическим средствам. Также необходимо продолжать лечение имеющихся сопутствующих заболеваний.
Больным рекомендуется диета №7. Важную роль играет ограничение в питании белковой пищи. Количество белка в диете больных с ХПН зависит от выраженности почечной недостаточности. Однако калорийность рациона должна оставаться высокой за счет жиров, углеводов, чтобы не допускать истощения и распада собственных белков организма. У пациентов с ХПН при диете с низким содержанием белка количество мочевины в крови может значительно снизиться, но при этом функция почек не улучшается, не возрастает СКФ и даже возможно повышение содержания креатинина. Прием поваренной соли больным с ХПН без отечного синдрома и артериальной гипертензии не следует резко ограничивать, т. к. резкое и длительное ограничение ведет к дегидратации больных, гиповолемии и ухудшению функции почек. При гиперкалиемии не рекомендуется использование соли с низким содержанием натрия, т. к. натрий в этой соли заменяется калием, и использование таких продуктов приводит к высокому риску развития опасной для жизни гиперкалиемии. Необходимо полноценное обеспечение потребности организма в витаминах и микроэлементах, а также контроль за питьевым режимом (с учетом уровня СКФ, т. к. при резком ограничении жидкости возможно развитие дегидратации и усугубление порочного круга (см. выше)).
Медикаментозная терапия.
Лечение основного заболевания, приведшего к ХПН.
Лечение артериальной гипертензии — петлевые диуретики, ингибиторы АПФ (необходимо назначать фозиноприл, который выводится печенью, а не почками), сартаны, β-адреноблокаторы, блокаторы медленных кальциевых каналов, при кризах — метилдопа, α-адреноблокаторы (доксозазин). На любой стадии ХПН противопоказаны ганглиоблокаторы, гуанетидин.
Для коррекции гиперлипидемии применяются статины.
Коррекция водно-электролитного состава крови:
- гиперкалиемия — показано введение петлевых диуретиков, солей кальция (физиологического антагониста калия), инсулина, глюкозы, при необходимости (уровень калия более 6,5 ммоль/л) — гемодиализ;
- при отечном синдроме применяются мочегонные препараты — фуросемид (Лазикс), торасемид. Однако при ХПН фуросемид накапливается в организме, что может привести к глухоте.
При наличии метаболического ацидоза показано внутривенное капельное введение гидрокарбоната натрия в индивидуально подобранной дозе, которая рассчитывается по формуле.
Для лечения нарушений фосфорно-кальциевого обмена и гиперпаратиреоза применяется кальцитриол, при необходимости выполняется паратиреоидэктомия.
Коррекция анемии. Больные с ЭДА нуждаются в назначении препаратов эритропоэтина в качестве заместительной терапии. Доза и длительность приема препаратов эритропоэтина зависят от исходного содержания гемоглобина и гематокрита у конкретного больного. В случае документированного дефицита железа, витамина В12, фолиевой кислоты необходима их коррекция соответствующими препаратами.
При наличии инфекционного процесса назначаются антибиотики. Однако следует помнить о нефротоксичности ряда антибактериальных препаратов (например, аминогликозиды) и вносить изменения в дозировку препаратов, учитывая стадию ХПН.
При сердечной недостаточности — сердечные гликозиды с коррекцией дозы в зависимости от стадии ХПН.
Для лечения вторичной подагры применяется аллопуринол.Когда метаболические нарушения при ХПН уже не поддаются коррекции консервативными методами, возникает необходимость в заместительной почечной терапии, которая включает в себя диализные методы (гемодиализ, перитонеальный диализ) и трансплантацию почки.
Есть несколько методов диализа. Гемодиализ — это очищение крови от различных веществ путем их диффузии через пористую мембрану диализатора в диализирующий раствор. Избыток воды удаляется за счет положительного гидростатического давления, а метаболиты — с помощью пассивной диффузии через полупроницаемую мембрану против градиента концентрации. Через ту же мембрану можно проводить и удаление безбелковой части плазмы (ультрафильтрация). Первый гемодиализ человеку был проведен в октябре 1924 года. В настоящее время в мире жизнь более 1,5 млн. пациентов продолжается благодаря замещающей терапии. Это число неуклонно возрастает, что связано как с увеличением продолжительности их жизни (нередко превышает 30–40 лет), так и с пересмотром показаний к гемодиализу. Очень важно заранее планировать поступление больного на лечение гемодиализом. Гемодиализ обычно выполняется по 3–6 часов (время проведения зависит от гемодиализного аппарата, веса больного и др.), 2–3 раза в неделю. В качестве сосудистого доступа, который необходим для забора крови и возвращения ее во время гемодиализа, используются артериовенозная фистула, артериовенозный шунт и др. При назначении больным на гемодиализе различных препаратов нужно учитывать не только время выведения этих лекарств из организма, но и их способность проникать во время гемодиализа через полупроницаемую диализную мембрану.
Показания к гемодиализу такие же, как и при ОПН (см. выше), а также уровень СКФ £10 мл/мин.
Противопоказания к гемодиализу:
· отказ пациента;
· психические заболевания;
· некурабельные злокачественные новообразования;
· сопутствующие заболевания с высоким риском кровотечения.
Осложнения гемодиализа:
· гипоосмоляльный диализный синдром (отек мозга в результате низкой осмоляльности плазмы);
· артериальная гипотония (уменьшение объема циркулирующей крови);
· сепсис (частые манипуляции на сосудах);
· кровотечения (из-за коагулопатии и гепаринотерапии);
· диализный перикардит;
· диализная деменция (алюминиевая интоксикация).
При перитонеальном диализе в качестве пористой мембраны используется брюшина больного. В брюшную полость пациента вставляется специальный катетер, через который вводится и выводится диализирующий раствор. Избыток воды удаляется за счет осмотического давления (наиболее широко распространенным осмотическим агентом является глюкоза). Данный вид диализа очищает кровь медленнее, чем гемодиализ, однако не вызывает резких колебаний артериального давления, электролитных нарушений, более удобен в применении и легче переносится. Используются различные режимы перитонеального диализа (постоянный амбулаторный перитонеальный диализ; постоянный циклический перитонеальный диализ). При проведении постоянного амбулаторного перитонеального диализа пациенту через постоянный катетер в брюшную полость вводят около 2–3 л диализирующего раствора, после чего больной сам меняет раствор 4–5 раз в день ежедневно. При постоянном циклическом перитонеальном диализе используется механизм, который позволяет автоматически переливать диализирующий раствор через катетер в брюшную полость, в то время как пациент спит (4-5 раз за ночь). Этот процесс обычно занимает от 9 до 12 часов в сутки.
На всех этапах проведения важна полная стерильность, т. к. инфекционные осложнения встречаются достаточно часто (перитонит, сепсис, катетерные инфекции), что является основным недостатком перитонеального диализа. Также возможна гипергликемия из-за всасывания глюкозы из диализирующего раствора. Может наблюдаться значительная потеря белка.
Дополнительные противопоказания к перитонеальному диализу:
· спаечная болезнь органов брюшной полости;
· ожирение III степени;
· инфекционные процессы в брюшной полости, коже и подкожной клетчатке в области передней брюшной стенки.
Трансплантация почки позволяет больному вернуться к нормальной жизни и обеспечивает ее большую продолжительность, чем гемодиализ. Однолетняя выживаемость трансплантата составляет 80% при трансплантации трупной почки и 90% при трансплантации донорской почки. Однако в терминальной стадии возможна плохая приживаемость органа, поэтому вопрос о пересадке донорской почки следует решать заблаговременно. Для оценки совместимости определяют антигены HLA, антитела к HLA донора, группу крови реципиента и донора. Противопоказания: злокачественные новообразования, инфекции, тяжелые поражения сердца и легких. После трансплантации для предупреждения реакции отторжения применяют различные схемы иммуносупрессивной терапии. Реакция отторжения трансплантата бывает острой и хронической (основная причина гибели трансплантата). Хроническая реакция отторжения протекает длительно, проявляясь постепенным снижением СКФ. Причины ее развития неизвестны, остановить процесс отторжения невозможно. Реакцию отторжения лечат в специализированных центрах.
Прогноз определяется основным заболеванием и стадией ХБП. ХПН нужно контролировать и начинать лечение на ранних стадиях болезни, иначе она может привести к полной утрате почечных функций и смерти. На состояние больного влияют интеркуррентные инфекции (пневмония, грипп и др.), обострение хронической очаговой инфекции, роды, оперативные вмешательства. Смерть может наступить в результате интоксикации, недостаточности кровообращения, желудочно-кишечного кровотечения, инсульта.
Профилактика ХПН сводится к предупреждению и своевременному лечению заболеваний, приводящих к ее развитию.
Дата добавления: 2021-03-18; просмотров: 52; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
