Расщепление простых эфиров H I и HBr
Простые эфиры разлагаются под действием концентрированных йодоводородной или бромоводородной кислот:
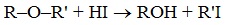
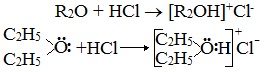
Образование комплексных соединений
Образование нестойких солей оксония (подобных солям аммония) в результате взаимодействия с сильными кислотами:
Окисление эфиров, образование перекисей
Несмотря на относительную химическую инертность, эфиры легко образуют при хранении на воздухе перекиси:
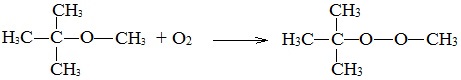
Получение простых эфиров
Межмолекулярная дегидратация спиртов
Симметричные простые эфиры R–O–R получают при межмолекулярной дегидратации спиртов: 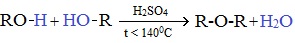
Взаимодействие галогенпроизводных с алкоголятами (реакция Вильямсона)
Эфиры несимметричного строения R–O–R' образуются при взаимодействии алкоголята и галогенуглеводорода. Например, метилэтиловый эфир можно получить из этилата натрия и хлорметана: 
3. Дегидратация спиртов в присутствии ионов водорода как катализаторов 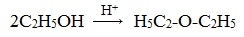
4. Получение гетероцикических кислородсодержащих соединений (циклические простые эфиры)

Альдегиды и кетоны
Химические свойства
Химические свойства альдегидов и кетонов обусловлены строением карбонильной группы. Из-за того, что в карбонильной группе у атома кислорода частичный отрицательный заряд, а у атома углерода – частичный положительный, для альдегидов характерны реакции присоединения.
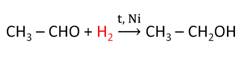
Для альдегидов и кетонов характерны реакции присоединения водорода. При этом образуются спирты.
|
|
|
Кроме этого, альдегиды легко окисляются до соответствующих карбоновых кислот.
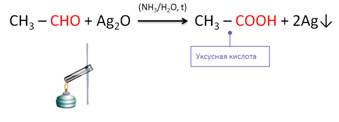
Эту реакцию называют реакцией «серебряного зеркала». Она является качественной для обнаружения альдегидов.
Ещё одной качественной реакцией на альдегиды является реакция со свежеприготовленным гидроксидом меди (II).
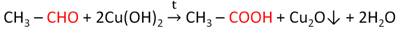
Окислить альдегиды можно также K2Cr2O7, KMnO4 или кислородом воздуха в присутствии катализатора. При этом также образуются карбоновые кислоты.
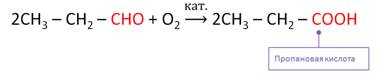
Получение альдегидов и кетонов
В лаборатории альдегиды и кетоны получают окислением спиртов.
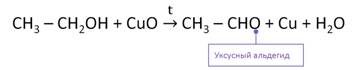
При окислении пропанола-2 в тех же условиях образуется ацетон, который является кетоном.
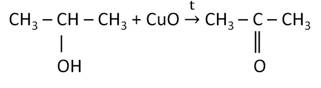
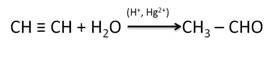
Альдегиды и кетоны можно получить гидратацией алкинов. Так, гидратацией ацетилена в условиях реакции Кучерова образуется уксусный альдегид.
В результате присоединения воды к пропину образуется кетон – ацетон.
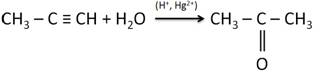
Одним из промышленных способов получения альдегидов является окисление алкенов в присутствии солей палладия.

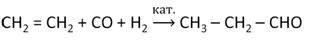
Альдегиды можно получить и в реакции с алкенами – оксосинтез. Так, в реакции этилена с синтез-газом в определённых условиях образуется пропаналь.
|
|
|
Альдегиды и кетоны можно получить в реакции гидролиза дигалогензамещённых алканов.

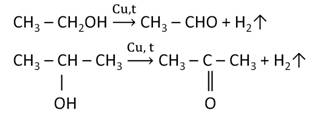
Альдегиды и кетоны получают дегидрированием спиртов в присутствии катализатора меди.
Карбоновые кислоты
Химические свойства
Химические свойства карбоновых кислот обусловлены карбоксильной группой. Как и любые кислоты, карбоновые кислоты способны отщеплять атом водорода в виде протона. Так, растворимые в воде кислоты диссоциируют обратимо с образованием иона водорода.
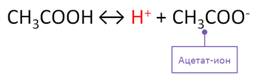
Кислотные свойства карбоновых кислот проявляются в реакциях с активными металлами.
2CH3COOH + Mg → (CH3COO)2Mg + H2↑
Кислотные свойства карбоновых кислот проявляются в реакциях нейтрализации, то есть в реакциях с сильными основаниями.
CH3COOH + KOH → CH3COOK + H2O
Карбоновые кислоты реагируют с основными оксидами.
2CH3COOH + MgO → (CH3COO)2Mg + H2O
Карбоновые кислоты реагируют с солями более слабых кислот.
CH3COOH + NaHCO3 → CH3COONa + CO2↑ + H2O
Карбоновые кислоты вступают в реакции со спиртами – это реакции этерификации. CH3COOH + CH3OH ↔ CH3COOCH3 + H2O
Карбоновые кислоты могут вступать в реакции замещения атома водорода у α-углеродного атома на атом галогена в присутствии красного фосфора. Так, в реакции уксусной кислоты с хлором в присутствии красного фосфора образуется хлоруксусная кислота.
|
|
|
CH3COOH + Cl2 ↔ CH2(Cl)COOH + HCl
Ненасыщенные карбоновые кислоты вступают в реакции присоединения по кратным связям.

Кроме этого, акриловая кислота может вступать в реакцию полимеризации с образованием полимера.
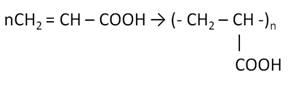
Получение карбоновых кислот
Наиболее распространённым способом получения карбоновых кислот является каталитическое окисление насыщенных углеводородом.
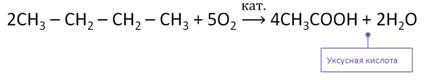
В промышленности кислоты получают окислением соответствующих альдегидов. Так, при окислении уксусного альдегида образуется уксусная кислота.
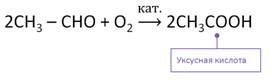
Метановую кислоту в промышленности получают при взаимодействии оксида углерода (II) и горячего раствора гидроксида натрия при повышенном давлении. Сначала образуется соль муравьиной кислоты, которая под действием сильной кислоты превращается в муравьиную.
CO + NaOH → HCOONa HCOONa + H2SO4 → HCOOH + NaHSO4
В лаборатории карбоновые кислоты можно получить окислением первичных спиртов и альдегидов. Окислителями здесь могут выступать K2Cr2O7, KMnO4.
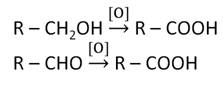
Сложные эфиры
Химические свойства
Для сложных эфиров характерны реакции горения.
HCOOCH3 + 2O2 → 2CO2↑ + 2H2O
|
|
|
Важная реакция сложных эфиров – это реакция их с водой в присутствии кислоты или щёлочи. Эта реакция называется гидролизом. Гидролиз – реакция, обратная реакции этерификации. Эта реакция является обратимой. CH3COOC2H5 + HOH ↔ CH3COOH + C2H5OH
В результате щелочного гидролиза этилэтаноата образуется этаноат натрия и этанол. Этот гидролиз необратим и называется омылением.
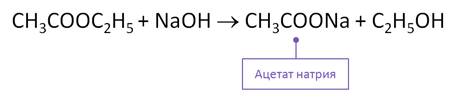
Получение сложных эфиров
Получить сложные эфиры можно несколькими способами. Например, в реакции карбоновых кислот и спиртов в присутствии минеральных кислот.
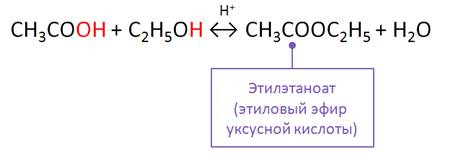
Реакцию образования сложного эфира, как известно, называют реакцией этерификации.
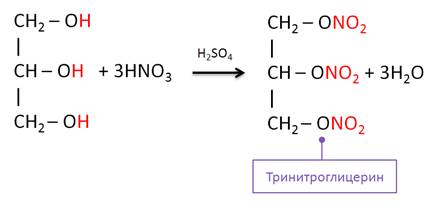
Сложный эфир можно получить и в реакции глицерина и азотной кислоты, в результате данной реакции образуется тринитроглицерин.
Дата добавления: 2021-02-10; просмотров: 505; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
