Получение многоатомных спиртов
Одноатомные спирты
Химические свойства
Химические свойства спиртов обусловлены наличием в составе гидроксильных групп.
Спирты реагируют с активными металлами с образованием алкоголятов и водорода.

Алкоголяты легко разлагаются водой.
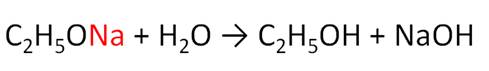
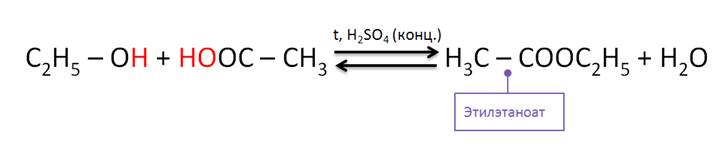
Спирты реагируют с карбоновыми и кислородсодержащими минеральными кислотами. Так, в реакции этанола с уксусной кислотой образуется сложный эфир – этилэтаноат, или этиловый эфир уксусной кислоты. Данные реакции являются обратимыми и протекают в присутствии концентрированной серной кислоты при нагревании. Реакции спиртов с карбоновыми кислотами называются реакциями этерификации.
В реакциях спиртов с кислородсодержащими минеральными кислотами образуются сложные эфиры этих кислот. Так, в реакции этанола с серной кислотой образуется диэтилсульфат.

Для спиртов характерно взаимодействие с галогеноводородами с образованием галогеналканов. Эта реакция является обратимой. В этой реакции проявляются слабые основные свойства спирта.
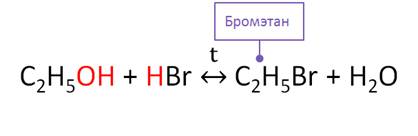
Для спиртов характерна дегидратация под действием концентрирован-ной серной кислоты при нагревании свыше 140 0С, при этом образуются алкены.

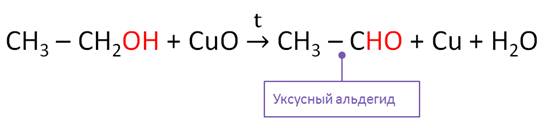
Для спиртов характерны реакции окисления. Спирты горят на воздухе или в кислороде некоптящим пламенем с выделение большого количества теплоты.

Под действием более слабых окислителей происходит частичное окисление спиртов.
|
|
|
Получение спиртов.
Одним из наиболее важных способов получения спиртов является гидратация алкенов.
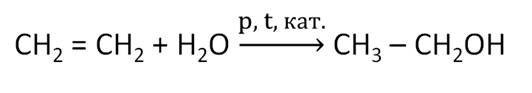
В пищевой промышленности этанол получают при спиртовом брожении глюкозы под действием ферментов.
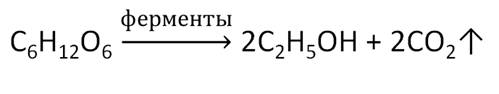
В промышленности метанол получают из синтез-газа в присутствии катализатора.
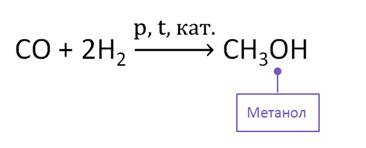
Спирты можно получить и при гидролизе моногалогеналканов с водными растворами щелочей.

Многоатомные спирты
Химические свойства
Для многоатомных спиртов характерны свойства, обусловленные наличием функциональной гидроксильной группы, а также одновременным присутствием нескольких гидроксильных групп в молекуле.
Так, многоатомные спирты взаимодействуют со щелочными металлами также, как и одноатомные спирты.

 Кислотные свойства многоатомных спиртов выражены сильнее, чем одноатомных спиртов. Поэтому, в отличие от одноатомных спиртов, многоатомные спирты реагируют с нерастворимыми гидроксидами тяжёлых металлов. Например, если в стакан с раствором щёлочи добавить несколько капель сульфата меди (II) и к образовавшемуся осадку гидроксида меди (II) прилить многоатомный спирт глицерин, то образуется ярко-синий раствор. Данная реакция является качественной реакцией на многоатомные спирты.
Кислотные свойства многоатомных спиртов выражены сильнее, чем одноатомных спиртов. Поэтому, в отличие от одноатомных спиртов, многоатомные спирты реагируют с нерастворимыми гидроксидами тяжёлых металлов. Например, если в стакан с раствором щёлочи добавить несколько капель сульфата меди (II) и к образовавшемуся осадку гидроксида меди (II) прилить многоатомный спирт глицерин, то образуется ярко-синий раствор. Данная реакция является качественной реакцией на многоатомные спирты.
|
|
|
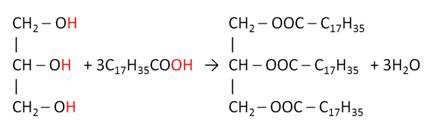
Многоатомные спирты, также как и одноатомные, взаимодействуют с кислородсодержащими минеральными и карбоновыми кислотами с образованием сложных эфиров.

В реакции глицерина со стеариновой кислотой образуется сложный эфир – тристеарат.
Получение многоатомных спиртов
Основным лабораторным способом получения гликолей является окисление алкенов раствором перманганата калия. Так, при окислении этилена раствором перманганата калия образуется этиленгликоль.
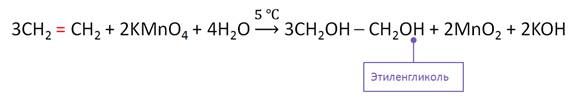
Этиленгликоль можно получить гидролизом дигалогеналкана. Так, при гидролизе 1, 2-дихлорэтана образуется этиленгликоль.
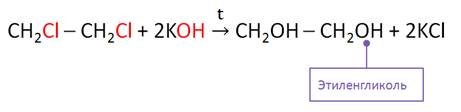
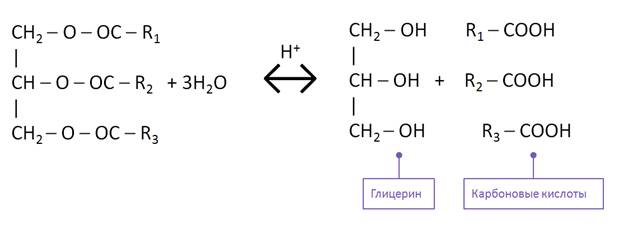
Промышленным способом получения глицерина является гидролиз жиров. В процессе гидролиза жиров образуется не только глицерин, но и карбоновые кислоты.
Этиленгликоль в промышленных масштабах получают гидратацией эпоксида, который получают при окислении этилена в присутствии катализатора – серебра.
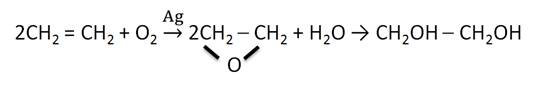
Фенол
Химические свойства
Химические свойства фенола будут обусловлены взаимным влиянием гидроксильной группы и бензольного кольца.
Фенол проявляет кислотные свойства, поэтому в водных растворах он диссоциирует по типу кислоты с образованием протона водорода, поэтому фенол называют карболовой кислотой.
|
|
|
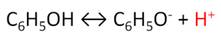
Фенол, как и спирты, взаимодействует со щелочными металлами.
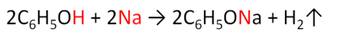
Фенол реагирует с растворами щелочей, так как кислотные свойства у него выражены сильнее, чем у спиртов.
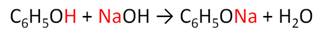
Кислотные свойства у фенола выражены слабее, чем у неорганических кислот, даже таких, как угольная кислота. Поэтому, если добавить к водному раствору фенолята натрия соляную кислоту, то образуется фенол и хлорид натрия.
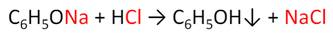
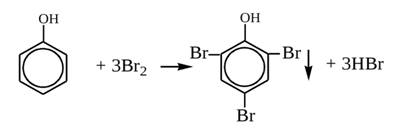
Реакции галогенирования у фенола протекают с замещением атомов водорода в бензольном кольце. Так, в реакции фенола с бромной водой образуется белый осадок 2, 4, 6-трибромфенола. Эта реакция используется для качественного обнаружения фенола.
 Фенол также даёт фиолетовое окрашивание с водным раствором хлорида железа (III), при этом образуется комплексная соль железа. Эту реакцию используют для качественного обнаружения фенола.
Фенол также даёт фиолетовое окрашивание с водным раствором хлорида железа (III), при этом образуется комплексная соль железа. Эту реакцию используют для качественного обнаружения фенола.
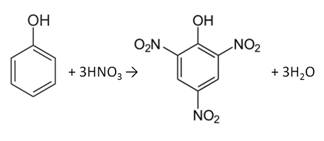
Фенол, как и бензол, реагирует с азотной кислотой. Но у фенола эта реакция идёт легче. В реакции фенола с азотной кислотой образуется 2, 4, 6-тринитрофенол, или пикриновая кислота.
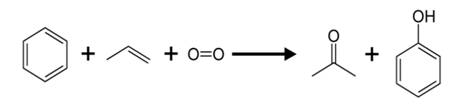
Одним из основных способов получения фенола в промышленности является кумольный метод. Для этого берут исходные вещества: бензол и пропен.
|
|
|
Сначала в реакцию вступает бензол с пропеном, образуется при этом изопропилбензол, или кумол. Затем кумол окисляют, продукт окисления кумола разлагается серной кислотой и получается фенол и ацетон.
Фенол можно получить и из бензола: сначала хлорируют бензол, получают при этом хлорбензол, затем хлорбензол обрабатывают водным раствором щёлочи с образованием фенолятов. Затем на фенолят действуют минеральными кислотами и получают фенол.

Простые эфиры — малоактивные соединения, они значительно менее реакционноспособны, чем спирты.
Химические свойства
Дата добавления: 2021-02-10; просмотров: 382; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
