Получение предельных монокарбоновых кислот
ОН гидроксил
Общая формула карбоновых кислот:
О
R (-C )m,
ОН
где m – число карбоксильных групп, определяющее основность кислоты
Карбоновые кислоты классифицируются по числу карбоксильных групп и в зависимости от природы радикала.
По основности (по числу карбоксильных групп) кислоты делятся на:
· одноосновные (монокарбоновые), m=1;
· двухосновные (дикарбоновые), m=2;
· трёхосновные (трикарбоновые, m=3; и т.д.
В зависимости от строения углеводородного радикала R карбоновые кислоты делятся на:
· предельные (насыщенные), R=алкил;
· непредельные (ненасыщенные) – производные непредельных углеводородов;
· ароматические – производные
· ароматических углеводородов.
Некоторые представители карбоновых кислот
| Формула | Название кислоты R-COOH | Название остатка RCOO- | |
| систематическое | тривиальное | ||
| HCOOH | Метановая | Муравьиная | Формиат |
| CH3COOH | Этановая | Уксусная | Ацетат |
| C2H5COOH | Пропановая | Пропионовая | Пропионат |
| C3H7COOH | Бутановая | Масляная | Бутират |
| C4H9COOH | Пентановая | Валериановая | Валеринат |
| C5H11COOH | Гексановая | Капроновая | Капронат |
| C15H31COOH | Гексадекановая | Пальмитиновая | Пальмитат |
| C17H35COOH | Октадекановая | Стеариновая | Стеарат |
| C6H5COOH | Бензолкарбоновая | Бензойная | Бензоат |
| CH2=СH-COOH | Пропеновая | Акриловая | Акрилат |
Наибольшее значение имеют насыщенные монокарбоновые кислоты или (предельные одноосновные кислоты).
|
|
|
Предельные одноосновные карбоновые кислоты – органические вещества, в молекулах которых имеется одна карбоксильная группа, связанная с радикалом предельного углеводорода или с атомом водорода.
Общая формула предельных одноосновных кислот
O
Общая формула: СnH2n+1 – C , n ≥ 0
ОН
Номенклатура и изомерия.
По международной заместительной номенклатуре название кислоты производят от названия, соответствующего (с тем же числом атомов углерода) углеводорода с добавлением окончания -оваяи слова кислота.Нумерацию цепи всегда начинают с атома углерода карбоксильной группы, поэтому в названиях положение группы -СООН не указывают.
Например:
5 4 3 2 1 О
СН3-СН2-СН-СН2-С 3-метилпентановая кислота
СН3 ОН
Внутрикласса возможна только изомерия углеродной цепи. Первые три члена гомологического ряда изомеров не имеют. Четвёртый член гомологического ряда существует в виде двух изомеров
· 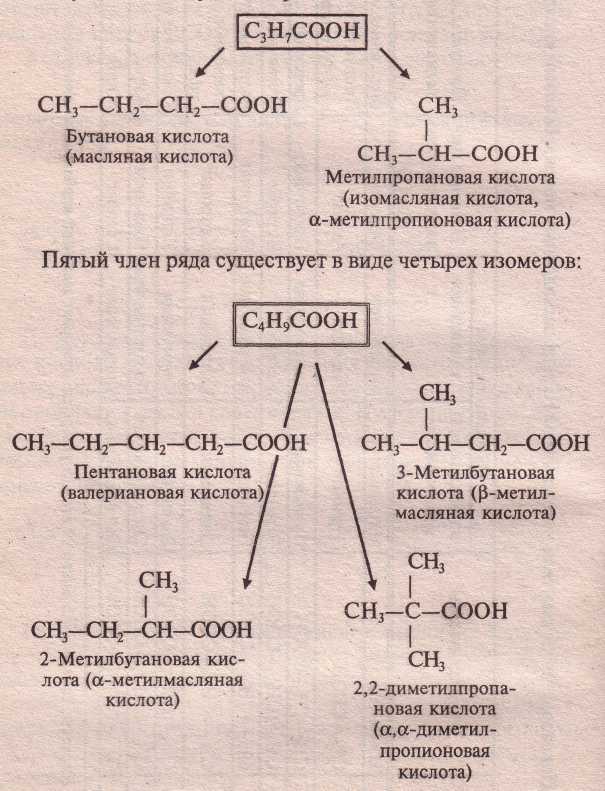
· Пятый член ряда существует в виде четырёх изомеров.
Физические свойства.
|
|
|
Кислоты, содержащие в молекуле до четырёх атомов “С”, - жидкости с характерным резким запахом. Кислоты, содержащие от 4 до 9 атомов “С”, - вязкие маслянистые жидкости с неприятным запахом; содержащие более 9 атомов “С” в молекуле – твёрдые вещества, без запаха, которые не растворяются в воде. Температуры кипения предельных одноосновных карбоновых кислот увеличиваются с ростом числа атомов “С” в молекуле и, следовательно, с ростом относительной молекулярной массы. Муравьиная и уксусная кислоты неограниченно растворимы в воде. С увеличением числа атомов “С” в цепи растворимость карбоновых кислот в воде уменьшается.
ДОМАШНЕЕ ЗАДАНИЕ
1) Составьте структурные формулы следующих карбоновых кислот:
1. 3-этилоктановая кислота
2. метилпропановая кислота
3. 3,5,5 – триметилгесановая кислота
4. 2-метил-3-этилгептановая кислота
5. 2,4-диметилпентановая кислота
2) Тест по теме: «Карбоновые кислоты»
Из четырёх возможных вариантов ответов выберите один правильный ответ
1. Общая формула предельных одноосновных карбоновых кислот:
а) СnН2n+1СООН; б) СnН2nО2; в) СnН2n+1СОН; г) СnН2n
2. Сколько карбоксильных групп содержится в молекулах дикарбоновых кислот?
а) одна; б) две; в) три; г) четыре
|
|
|
3. Как называется карбоновая кислота следующего строения:
СН3-СН2-СН2-СН-СООН
СН3
а) 4-метилпентановая; б) 2-метилбутановая; в) 2-метилпентановая; г) 4-метилбутановая
4. Какое из следующих веществ является предельной одноосновной кислотой?
а) Н2С=СН-СООН; б) СН3-СН2-СООН;
в) Н2С=СН-СН2-СООН; г) СООН-СН2-СООН
5. Пентановая кислота имеет: а) пять; б) четыре; в) шесть; г) два изомера?
УРОК № 28 , 29
Тема: Карбоновые кислоты
Химические свойства
Смотреть по ссылке (продолжение): https://www.youtube.com/watch?v=PdmRp01Wa0M
I. Реакции с разрывом связи О-Н (кислотные свойства, обусловленные подвижностью атома “Н” карбоксильной группы).Предельные одноосновные карбоновые кислоты обладают всеми свойствами обычных кислот.
1) Диссоциация
О О
R – C ↔ R – C + Н+
ОН О –
2. Образование солей:
а) взаимодействие с активными металлами:
2НСООН + Мg → (НСОО)2 Мg + Н2
|
|
|
формиат магния
б) взаимодействие с основными оксидами:
2СН3СООН + СаО → (СН3СОО)2Са + Н2О
ацетат кальция
в) взаимодействие со щелочами (реакции нейтрализации):
СН3СООН + NaOH → СН3СООNa + Н2О
ацетат натрия
г) взаимодействие с аммиаком или гидроксидом аммония:
СН3СООН + NН3 → СН3СООNН4
ацетат аммония
д) взаимодействие с солями более слабых кислот (карбонатами и гидрокарбонатами):
2СН3СООН + Na2CO3 → 2СН3СООNa + CO2↑+ Н2О
ацетат натрия
II. Реакции с разрывом связи С-О (замещение группы ОН) О
Взаимодействие со спиртами с образованием сложных эфиров R – C (реакция этерификации)
ОR
О Н2SO4 конц . О
СН3 – С – ОН + С2Н5ОН ↔ СН3 – С – ОС2Н5 + Н2О
уксусная кислота этилацетат
III. Реакции с разрывом связей С-Н (реакции с участием радикала), в присутствии Ркрасный
1) СН3 – СООН + Сl2 → СН2Сl – СООН + НСl
хлоруксусная кислота
2) СН3 – СООН + Сl2 → СНСl2 – СООН + НСl
дихлоруксусная кислота
3) СН3 – СООН + Сl2 → ССl3 – СООН + НСl
трихлоруксусная кислота
Лабораторная работа № 12
« Свойства уксусной кислоты, общие со свойствами минеральных кислот».
Цель работы: изучить свойства карбоновых кислот.
Оборудование и реактивы: штатив с пробирками (3 шт.), пробка с длинной стеклянной трубкой-холодильником, химический стакан, уксусная кислота (70%), магний, цинк, фенолфталеин, гидроксид натрия, этанол, серная кислота (конц.), вода, хлорид натрия.
Ход работы:
Смотреть по ссылке: https://www.youtube.com/watch?v=fU0Pg8tIEqg
Опыт № 1. Взаимодействие уксусной кислоты с некоторыми металлами.
В две пробирки влейте по 1 мл раствора уксусной кислоты. В одну пробирку всыпьте немного стружек магния, а во вторую – несколько гранул цинка. В первой пробирке происходит бурная реакция, а во второй – реакция протекает спокойно (иногда она начинается только при нагревании).
Задания для самостоятельного вывода:
1. Как уксусная кислота реагирует с магнием и цинком?
2. Сравните скорость этих реакций и напишите уравнения в молекулярном, ионном и сокращенном ионном виде.
Опыт № 2. Взаимодействие уксусной кислоты с основаниями.
Влейте в пробирку 1-1,5 мл раствора гидроксида натрия и добавьте несколько капель раствора фенолфталеина. При добавление уксусной кислоты происходит обесцвечивание.
Опыт № 3. Взаимодействие уксусной кислоты со спиртами.
В пробирку налейте 2 мл раствора уксусной кислоты. Прилейте 2 мл этанола. Затем в пробирку осторожно добавьте 1 мл концентрированной серной кислоты. Пробирку закройте пробкой с длинной стеклянной трубкой-холодильником. Смесь осторожно подогрейте. Жидкость налейте в сосуд с насыщенным раствором хлорида натрия.
Задания для самостоятельного вывода:
1. Какие свойства уксусной кислоты сходны со свойствами минеральных кислот?
2. Какие вещества образуются при взаимодействии уксусной кислоты с основаниями?
3. Какие вещества образуются при взаимодействии уксусной кислоты со спиртами?
4. Напишите уравнения всех этих трѐх опытов.
5. Составьте уравнения реакций муравьиной кислоты: а) с цинком; б) с гидроксидом калия; в) с содой.
Получение предельных монокарбоновых кислот
I. Общие способы получения.
1. Окисление первичных спиртов и альдегидов под действием различных окислителей:
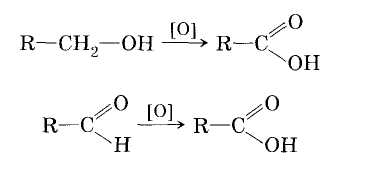
2. Окисление алканов кислородом воздуха (в присутствии катализаторов)
2СН3 – СН2 – СН2 – СН3 + 5О2 → 4СН3 – СООН + 2Н2О
бутан уксусная кислота
В лаборатории карбоновые кислоты получают из их солей, действуя на них серной кислотой при нагревании:
t
СН3СООNa + Н2SО4 → Na2SО4 + СН3СООH
ацетат натрия уксусная кислота
Дата добавления: 2020-12-12; просмотров: 562; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
