Катализ. Зависимость скорости реакции от катализатора.
Катализатор – вещество, меняющее скорость химической реакции, но остающееся в неизменном количестве и с неизменным химическим составом.
Катализ – явление изменения скорости реакции, вызванное присутствием катализатора.
Зависимость скорости реакции от свойств катализатора различна (специфична) и обусловлена составом, физическими свойствами и иногда способом его обработки.
В том случае, если катализатор ускоряет химическую реакцию, его называют – «положительным», если замедляет – «отрицательным» или «ингибитором»
Различают гомогенный и гетерогенный катализ.
Гомогенный катализ – между катализатором и гомогенной системой нельзя указать границу раздела.
Гетерогенный катализ – между катализатором и гомогенной системой можно указать границу раздела, т.е. катализатор самостоятельная фаза.
Принципиальное различие гомогенного и гетерогенного катализа состоит в том, что в первом случае катализатор всей своей массой участвует в катализе, в во втором, его каталитическое действие проявляется только на поверхности и он участвует лишь незначительной своей частью, а основная масса внутри него не принимает непосредственного участия.
Основные теоретические представления о гомогенном катализе опираются на так называемую «теорию промежуточных соединений». Эта теория исходит из предположения об образовании промежуточного, переходного состояния или активированного комплекса при протекании химических реакций:
|
|
|
А + В = (АВ)* → продукт, где
А и В - исходные вещества;
(АВ)* - активированный комплекс.
Образование активированного комплекса связано с затратой энергии – энергии активации. Катализаторы также могут принимать участие в формировании промежуточных соединений, при распаде которых, происходит образование продуктов реакции и регенерация катализатора:
А + В + К → (АВК)* → продукт + К.
Активированный комплекс, образовавшийся при участии катализатора, естественно отличается по строению и свойствам от комплекса, образованного только молекулами реагентов. Вследствие этого изменяется и энергия активации. Это может стать причиной того, что в присутствии катализатора образуются одни продукты, а без него – другие. Схематическое участие катализатора в промежуточных стадиях показано выше. Энергия активации процесса без участия катализатора Еа1:
Еа1 = Е2 – Е1 , где
Еа1 – энергия активации;
Е1 –энергия исходных продуктов;
Е2 – энергия активированного комплекса.
Катализатор вносит изменения в ход процесса. Энергия активации с участием катализатора Еа2:
|
|
|
Еа2 = Е3 – Е1 , где
Еа2 – энергия активации процесса с участием катализатора;
Е1 –энергия исходных продуктов;
Е3 – энергия активированного комплекса с участием катализатора.
Ускорение процесса достигается за счет снижения энергии активации в результате образования иного по своей природе активированного комплекса
Еа2 < Еа1.
Примером использования гомогенного катализа является получение серной кислоты нитрозным способом. На стадии окисления SO2 в SO3 в качестве катализатора используют оксиды азота. Без использования катализатора процесс окисления диоксида серы SO2 в триоксид SO3 практически не идет:
2SO2(г) + О2(г) = 2SO3(г).
Процесс окисления NO в NO2 легко происходит при обычных условиях:
2NO(г)+ О2(г) = 2NO2(г), полученный NO2 является промежуточным продуктом который легко окисляет SO2 в триоксид SO3:
2SO2(г) + 2NO2(г) = 2SO3(г) + 2NO(г).
В результате, взятый в качестве катализатора оксид азота NO регенерируется в неизменном количестве и химическом составе.
Очень широко в технологии применяют гетерогенный катализ.
И как уже было сказано в этом случае реакция протекает на поверхности твердой фазы. Механизм складывается из нескольких стадий: 1) диффузия реагентов к поверхности катализатора, 2) адсорбция их на его поверхности, в результате чего происходят изменения в строении и уменьшается прочность связей, т.е. снижается активационный барьер, далее 3) происходит химическая реакция и десорбция продуктов с последующей 4) диффузией в объём. Скорость процесса определяется лимитирующей стадией – это 2, 3 и 4 стадии.
|
|
|
Ускорение процесса также объясняется образованием активированного комплекса, сопровождающегося затратой меньшей энергии активации. Кроме того, ускорение реакции на поверхности катализатора связывают также с ослаблением связей в молекулах и дальнейшем их перераспределении вследствие адсорбции веществ на «активных центрах». Этими центрами считаются участки, где есть искажение геометрического или стехиометрического порядка Площадь активных центров составляет ничтожную долю общей поверхности, поэтому стремятся создать твёрдые катализаторы с очень развитой поверхностью. Для активности катализатора важно не только наличие активных центров, но и их число, и характер расположения Если число активных центров или их расположение не соответствует структуре молекул реагирующих веществ, процесс ускоряться не будет.
|
|
|
Вопрос о природе (строении) активных центров находится в стадии изучения. Единой теории катализа, а потому и критерия подбора гетерогенных катализаторов нет, но всё же представления о механизме катализа позволяют выдвинуть некоторые общие принципы для различных типов реакций.
Активность катализатора может быть увеличена в результате обработки специальными веществами – промоутерами, или уменьшена ядами, которые адсорбируясь на поверхности отравляют катализатор.
Таким образом, сущность катализа заключается в том, что в присутствии катализатора изменяется путь, по которому проходит суммарная реакция, образуются другие переходные состояния с иными энергиями активации, а потому изменяется скорость реакции, а иногда и продукты реакции.
Химическое равновесие
Все известные самопроизвольно протекающие реакции можно разделить на две группы: необратимые и обратимые.
Необратимые реакции протекают только в одном направлении, при этом происходит практически полное взаимодействие взятых в стехиометрических соотношениях, исходных веществ.
Но известно множество реакций, которые заканчиваются раньше, чем исходные вещества полностью прореагировали. В реакционной смеси сосуществуют и исходные вещества, и продукты реакции. Изменяя незначительно внешние условия (С – концентрацию, Т – температуру, Р – давление) можно заставить протекать реакцию в ту или другую сторону. Такие реакции получили название – обратимые. Взаимодействие между исходными веществами называют прямой реакцией, а между продуктами – обратной.
Но могут быть случаи, когда состояние системы не изменяется, такое состояние называется: либо стационарными – неизменность системы поддерживается внешними условиями; либо равновесным – неизменность системы не обусловлена условиями внешними по отношению к системе. При наличии в системе равновесия во всех её точках С, Т, Р одинаковы.
Устойчивое (стабильное) – малое воздействие извне вызывает
∕ малое изменение системы
Равновесие → неустойчивое (лабильное) – малое воздействие вызывает
\ резкое изменение
метастабильное - не все малые воздействия вызывает
значительные изменения
Состояние системы, к которому она приходит в результате протекания двусторонней химической реакции (при неизменных внешних условиях Р, Т) называется химическим равновесием.
В зависимости от числа фаз в равновесной системе, различают гомогенное и гетерогенное равновесие.
Существенное отличие гомогенного и гетерогенного равновесия состоит в том, что в первом случае каждое вещество можно количественно охарактеризовать его концентрацией, т.е. оно участвует всей массой, при гетерогенном – лишь через поверхность конденсированной фазы.
5.2.1. Гомогенное химическое равновесие.
Рассмотрим установление химического равновесия на примере:
Ʋ1
аА + бБ + вВ ↔ mM + nN
Ʋ2
C точки зрения химической кинетики концентрации С веществ А, Б, В убывают, убывает и скорость прямой реакции Ʋ1, а концентрации С веществ M и N возрастают, следовательно, возрастает и скорость обратной реакции. Ʋ2, Наступает момент, когда Ʋ1 = Ʋ2, наступает химическое равновесие.
Рис.
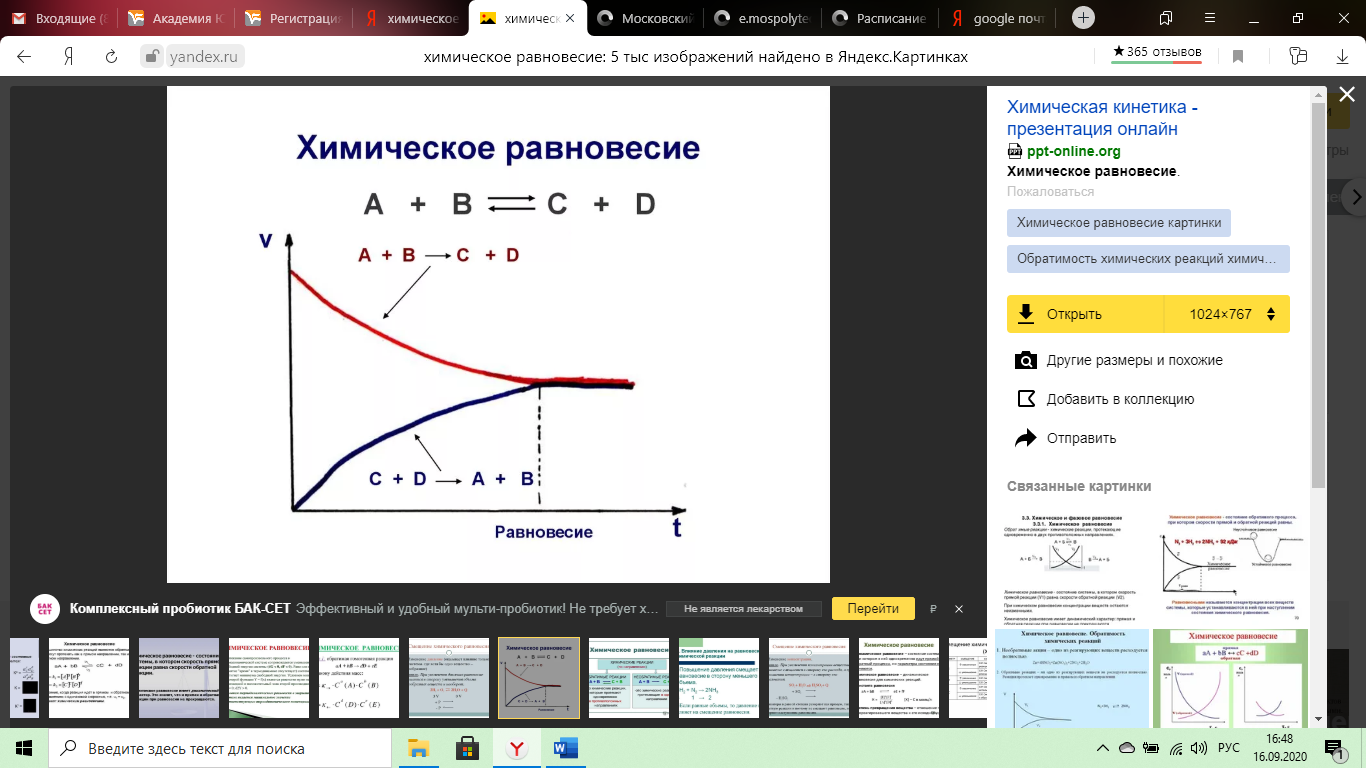
Основной закон химического равновесия , установленный Гульдбергом и Вааге – закон действующих масс для химического равновесия формулируется следующим образом:
«В изотермических условиях химического равновесия отношение произведения равновесных концентраций продуктов реакции, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции, к аналогично построенному произведению равновесных концентраций исходных веществ, есть величина постоянная».
Эта величина называется константой равновесия Кр.
[M]m•[N]n
Kp = [A]a•[Б]б•[B]в ; ʄ (T)
[M], [N], [A], [Б], [B] – равновесные концентрации продуктов реакции и исходных веществ.
Кр – константа равновесия Кр = const, является функцией только температуры.
Изменение концентраций на Кр не влияет, система переходит в новое состояние равновесия Кр = const .
Катализатор не изменяет Кр. Он в равной степени ускоряет и прямую и обратную реакции, он изменяет лишь время достижения равновесия.
Гомогенное химическое равновесие при видимом покое, когда при неизменных внешних условиях ничто не изменяется, является результатов внешне незаметных внутренних движений, т.е. оно является динамическим
(подвижным).
5.2.2. Гетерогенное равновесие.
Большинство химических равновесий являются гетерогенными. Опыт показывает, что конденсированные (твердые и жидкие) фазы не оказывают влияния на константу равновесия. Так для реакции:
t0
MgCO3(т) ↔ MgO(т) + CO2(г)
константа равновесия Кр = [CO2]. Константа равновесия определяется только значением концентраций газообразных веществ. Константу равновесия можно выразить через парциальные давления газообразных веществ.
Парциальное давление – давление газа в смеси, которое бы он оказывал, если бы он один занимал весь предоставленный объём приданной температуре Т.
Общее давление Р = ∑рi.
Р = (n1 + n2 + …..)•RT/V , n/V = C, pi = CiRT, Ci = pi /RT, тогда
р N n • pMm
Кр = pAa•pБб•pBв
Над твёрдыми веществами pi = const.
Смещение равновесия
Установившееся равновесие можно сместить изменяя внешние условия (Р, Т) или изменяя концентрации.
Общая закономерность смещения равновесия известна под названием принципа Ле-Шателье:
«Если на систему, находящуюся в равновесии, произведено внешнее воздействие, то равновесие смещается в сторону уменьшающую это воздействие (система переходит в новое состояние равновесия, уменьшая при этом эффект внешнего воздействия)».
Направление смещения равновесия:
1. При повышении температуры → в сторону эндотермической реакции;
2. При понижении температуры → в сторону экзотермической реакции;
3. При повышении давления → в сторону меньшего объёма газообразных веществ;
4. При понижении давления → в сторону большего объёма газообразных веществ;
5. При повышении концентрации исходных веществ → в сторону продуктов реакции;
6. Приуменьшении концентрации продуктов реакции (удаление продуктов) → в сторону продуктов реакции.
Применение принципа Ле-Шателье для определения оптимальных условий производства аммиака.
Аммиак получают взаимодействием азота и водорода:
T1
N2(г) + 3H2(г) ↔ 2NH3(г); ∆H > 0,
T2
т.к. реакция сопровождается уменьшением объёма, то повышение давления (сжатие) должно приводить к повышению выхода.
При 200 – 250С реакция не идет, при более высоких температурах 4000 – 5000С реакция идет, но медленно. Ускорения процесса добиваются введением катализатора.
Таким образом в промышленности синтез аммиака ведут обычно при давлении ~ 30 Мпа и ~ 4500. (При температуре > 5000C аммиак разлагается). Катализатором является губчатое железо с активирующими добавками Al2О3, K2О и др. Образовавшийся аммиак постоянно отводят и поглощают водой.
Дата добавления: 2021-01-21; просмотров: 503; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
