Б. Зависимость от температуры Т.
Лекция 7
Тема 5. «Химическая кинетика»
Химическая кинетика – это раздел общей химии, занимающийся изучением скоростей и механизмов химических реакций во времени.
Скорость химических реакций
Количественной характеристикой быстроты течения односторонней химической реакции является её скорость, т.е. изменение количества одного из компонентов системы в единицу времени в единице объёма:
_
_ Ʋ = -+∆n / ∆t•∆v,
где Ʋ - средняя скорость реакции;
∆n – изменение количества вещества;
∆t – изменение времени;
∆v – изменение объёма. _
Размерность величины Ʋ - [ моль / л•сек].
Компонентами называются составные части системы или фазы, между которыми нет границы раздела, и каждая из которых может быть выделена в свободном состоянии.
Т.к. отношение количества вещества к объёму определяет концентрацию:
n/v = C (моль/л), то приведённое выражение для скорости можно записать в виде: _
_ Ʋ = -+∆С / ∆t,
где Ʋ - средняя скорость реакции.
Средняя скорость не даёт характеристики быстроты в любой момент времени. Скорость процесса в данный момент времени характеризует – истинная скорость: _
Ʋист. = limƲ = -+∆С / ∆t
∆t → 0
|
|
|
Истинная скорость – предел, к которому стремится средняя скорость при условии, что ∆ t неограниченно сокращается.
Основное отличие процессов, протекающих в гомогенной и гетерогенной системах, состоит в том, что:
в гомогенной системе, химическая реакция происходит одновременно во всём объёме, а в гетерогенной системе – только на границе раздела фаз.
Гомогенные реакции
Для гомогенных реакций: Ʋ = -+∆С / ∆t, где С – концентрация любого реагента. Следует учитывать, что если речь идет о продуктах реакции, то
∆С > 0 и Ʋ > 0; Ʋ < 0, если речь идет об исходных веществах, т.к. ∆С < 0.
На скорость реакции влияют множество факторов: концентрация (для газов давление), температура, наличие катализатора, примеси, измельченность тв. фазы, кислотность среды в растворах, для цепных реакций – форма сосуда. Мы рассмотрим зависимость скорости реакции от трёх основных факторов: 1) концентрации реагирующих веществ;
2)температуры;
1) наличия катализатора.
А. Влияние концентрации С.
Изучая течение химической реакции в газовых смесях и растворах, норвежские ученые Гульдберг и Вааге в 1867 г. установили зависимость скорости реакции от концентраций участвующих веществ. Вначале предполагалось, что это прямая зависимость, но в последствии было экспериментально установлено – зависимость более сложная.
|
|
|
Основной закон химической кинетики гомогенной реакции, который называют «Кинетическим законом действия масс» формулируется следующим образом:
«При постоянной температуре скорость химической реакции в каждый момент времени прямо пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых степенях».
Напишем реакцию, протекающую в гомогенной системе в общем виде:
аА + бБ → вВ + mМ,
тогда согласно закону действующих масс выражение для скорости реакции будет иметь вид:
Ʋ = k•Са1А•Сб1Б,
где Ʋ – скорость реакции,
СА и СБ – концентрации веществ А и Б,
k - константа скорости химической реакции. Физический смысл этого коэффициента состоит в том, он является скоростью реакции, при условии, что концентрации реагирующих веществ равны 1.
Величина k характерна для данной реакции и не зависит от концентрации С, а зависит только от температуры Т и катализатора.
а1 и б1 – показатели степеней, определяются экспериментально и зависят от механизма реакции.
|
|
|
Под механизмом реакции понимают совокупность тех элементарных процессов, в результате которых из данных исходных веществ образуются продукты реакции. Если реакция между двумя веществами состоит из множества одинаковых элементарных процессов, то показатели степеней
а1 и б1 соответствуют коэффициентам в уравнении реакции. Например:
1. 2NO + O2 = 2NO2, Ʋ = k•Са1А•Сб1Б, Ʋ1 = k1•С2NO•CO2;
2. H2 + I2 = 2HI, Ʋ = k•Са1А•Сб1Б, Ʋ2 = k2•СH2•CI2
В большинстве случаев уравнение реакции не описывает её механизм, например взаимодействие водорода с хлором на свете записывают уравнением:
hν
H2 + Cl2 = 2HCl,
в действительности механизм реакции цепной:
hν
Cl2 = Cl• + Cl•
Cl• + H2 = HCl + H•
H• + Cl2 = HCl + Cl•
Cl• + H2 = HCl + H•
. . . . . . . . . . . . . . . . .
Обрыв цепи может произойти в результате взаимодействия: H• + H• = Н2,
которое протекает на стенках сосуда.
|
|
|
Убедительным примером, иллюстрирующим, что если уравнение и не описывает механизм, но закон действующих масс остаётся в силе является реакция образования бромида водорода из брома и водорода:
H2 + Br2 = 2HBr,
Выражение для скорости реакции представить в виде: Ʋ = k•СH2•CBr2 нельзя, т.к. реакция состоит из следующих процессов:
1. Br2 → Br• + Br•
2. Br• + H2 → HBr + H• - самая медленная стадия
3. H• + Br2 → HBr + Br• - реакция происходит при каждом соударении
4. H• + HBr → H2 + Br• - реакция происходит при каждом соударении
5. Br• + Br• → Br2 - реакция на стенках сосуда.
ƲHBr = Ʋ2 + Ʋ3 – Ʋ4 = k2•СH2•CBr + k3•СH•CBr2 - k4•СH•CHBr.
Скорость, рассчитанная по этой формуле, оказалась хорошо согласуется с экспериментальными данными.
Каков бы ни был механизм реакции, для того чтобы она произошла необходимы соударения молекул реагирующих веществ. Т.к. силы взаимодействия между молекулами проявляются на очень маленьких расстояниях, порядка диаметров атомов, для химической реакции необходимо непосредственное касание молекул, а раз так, то с увеличением концентрации увеличивается и число соударений, что приводит к увеличению скорости реакции.
Б. Зависимость от температуры Т.
В большинстве случаев скорость реакции при повышении температуры
Возрастает. Так синтез воды при 200С осуществить практически невозможно, при 5000С время реакции – 50 минут, а при 7000С – это происходит мгновенно.
Опытные данные свидетельствуют о справедливости приближенного правила Вант-Гоффа:
«При повышении температуры на каждые 100 градусов скорость гомогенной реакции увеличивается в 2 – 4 раза».
Если Т2 > T1, тогда:
Т2 – Т1
Ʋт2/ Ʋт1 = γ 10
Значительное ускорение процесса при нагревании, казалось бы можно было объяснить учащением соударений реагирующих частиц, за счет повышения скорости их движения. Но, опыт это предположение не подтверждает – скорость движения частиц при нагревании на 100 градусов возрастает только на 1% - 2%, поэтому объяснять возрастание скорости реакции при нагревании только увеличением числа соударений нельзя. Движение частиц (молекул) хаотично и беспорядочно, поэтому и число соударений велико, и если бы каждое соударение приводило к реакции, то любая реакция происходила бы со взрывом. Это значит, что не каждое соударение приводит к химическому взаимодействию. Ряд столкновений может сообщить молекуле большую скорость, а другие – мгновенно остановить, т.е. как правило лишь небольшая часть (иногда очень малая) столкновений между молекулами приводит к реакции.
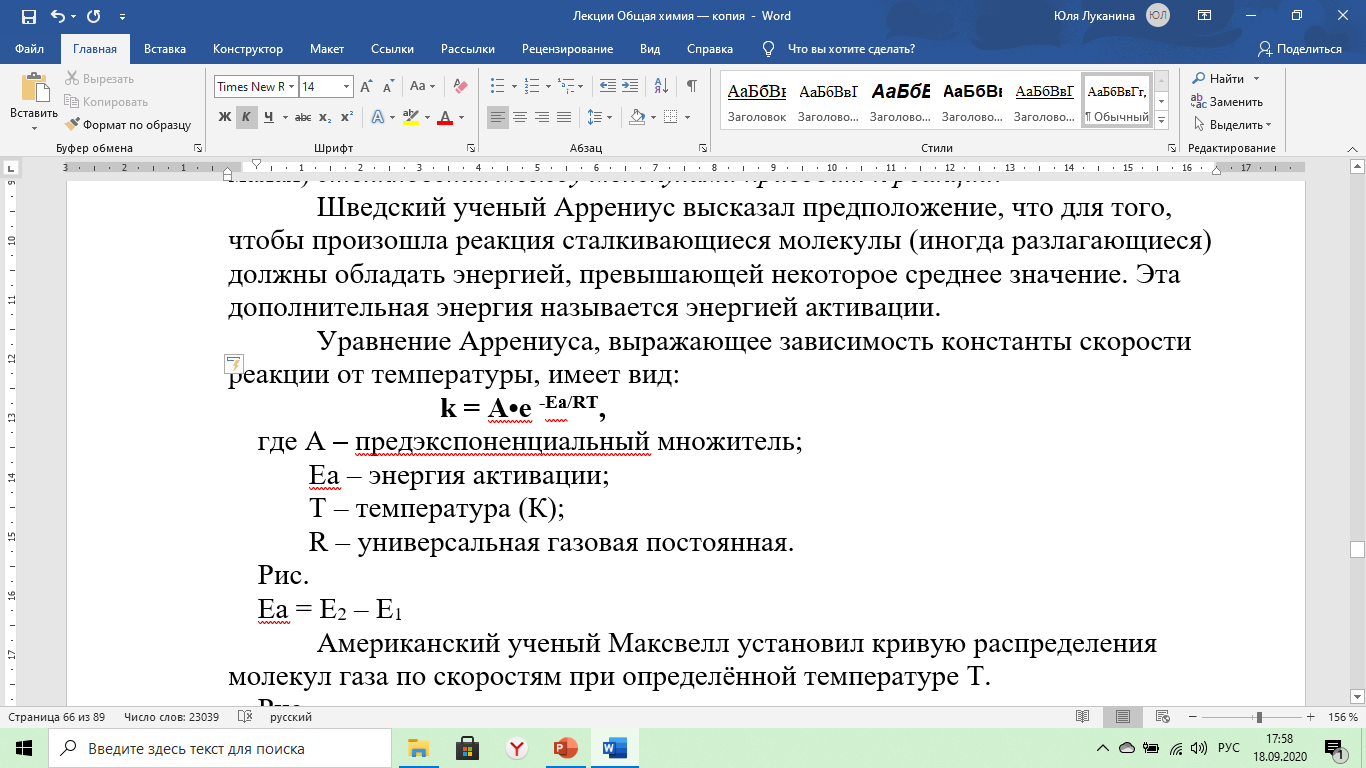
Шведский ученый Аррениус высказал предположение, что для того, чтобы произошла реакция сталкивающиеся молекулы (иногда разлагающиеся) должны обладать энергией, превышающей некоторое среднее значение. Эта дополнительная энергия называется энергией активации.
Уравнение Аррениуса выражающее зависимость константы скорости реакции от температуры имеет вид:
k = А•е -Еа/ RT ,
где А – предэкспоненциальный множитель;
Еа – энергия активации;
Т – температура (К);
R – универсальная газовая постоянная.
Рис.
Еа = Е2 – Е1
Американский ученый Максвелл установил кривую распределения молекул газа по скоростям при определённой температуре Т.
Рис.

При увеличении температуры Т2 > T1, T3 > T2 кривые имеют вид:
Рис.
Т. к. скорости связаны с кинетической энергией Е = mc2/ 2, то и энергетические кривые будут иметь тот же вид. Реакционноспособными будут только те молекулы, скорость которых превышает некоторую величину – ей соответствует порог скорости с i, т.е.:
Е = mc 2 / 2 > Е i = mci 2 / 2
Молекулы со скоростями > ci называются быстрыми или горячими. Именно они обладают энергией достаточной для вступления в реакцию. Для двух температур Т2 > T1, T3 > T2 число молекул с большими скоростями резко возрастает. Следовательно с увеличением температуры растет число молекул со значением энергии, благодаря которой при столкновении молекул возможно химическое взаимодействие и растет следовательно скорость реакции.
Энергия активации Еа – один из основных параметров, описывающих кинетику химических реакций. Чем больше Еа, тем меньше (при прочих равных условиях) скорость реакции. Еа зависит от природы реагирующих веществ.
Гетерогенные реакции.
Вероятность столкновения молекул газа или частиц раствора с твёрдым веществом пропорциональна площади поверхности твёрдого вещества и концентрации частиц раствора или молекул газа:
Ʋ = k•Сi•S,
где Ʋ -скорость гетерогенной реакции,
k – константа скорости реакции;
Сi – концентрация молекул газа или раствора;
S – площадь поверхности твердой фазы (поверхность раздела фаз.
Концентрация твёрдого вещества не влияет на скорость реакции. Размерность [моль/м2•с].
Скорость гетерогенной реакции равна числу актов химического взаимодействия в единицу времени на единице поверхности.
СаО(тв.) + СО2(г) = СаСО3(тв.) Процесс взаимодействия складывается
………………. Из следующих стадий:
_____________ СО2 1. Подвод СО2 к поверхности;
/////////////////////// 2. Реакция на поверхности;
_____________ СаСО3 3. Отвод продукта реакции от
~~~~~~~~~~~~ поверхности.
_____________ CaO
Результирующий эффект обусловлен тем, что газ (в данном случае) или растворенное вещество должен диффундировать сквозь тонкий слой продуктов реакции и скорость обусловлена скоростью диффузии.
Диффузия перенос вещества от мест с большей его концентрацией к местам с меньшей концентрацией, т.е. выравнивание концентраций.
Таким образом, скорость зависит от быстроты удаления продуктов реакции с поверхности твердого или жидкого вещества. Быстроту можно увеличить путём механического удаления продуктов реакции. В растворах, например, перемешиванием.
Дата добавления: 2021-01-21; просмотров: 59; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
