Электроиммуноанализ (электроиммунодиффузия, ракетный иммуноэлектрофорез)
ГБОУ ВПО РОССИЙСКИЙ НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ ИМЕНИ Н.И.ПИРОГОВА МИНЗДРАВСОЦРАЗВИТИЯ РОССИИ
Кафедра Биохимии МБФ
Лабораторная работа на тему:
«Иммуноэлектрофорез»
Выполнила:
Студентка МБФ отделения «Медицинская биохимия»
3.4.12 группы
Дариенко Кристина Александровна
Содержание
Иммуноэлектрофорез и родственные методы…………………………………3
Классический ммуноэлектрофорез.....………………………………..…….......3
Двойная радиальная иммунодиффузия……………………………………....3
Иммуноэлектрофорез в агаровом геле…………….…………………..……..4
Пути введения в организм РФП…………….…………….……………...….….5
Свойства РФ…………………………..……………………………………….….5
Распределение РФП в тканях ……………………..……………….…………....6
Получение РФП………………………. …………………………………………7
Диагностика РФП………………………………….……….………..………...…8
Перспективные радионуклиды в терапии………………………………………9
Радиофармпрепараты…………………………………………………………....10
Список литературы…………………………..…………………………………..11
http://www.elektronika-vrn.ru/72.html
Иммуноэлектрофорез и родственные методы
Белки обладают антигенными свойствами, что широко используется при их изучении. Реакцию между растворимыми белками и специфическими по отношению к ним преципитирующими антителами проводят в гелях или на пленках из ацетата целлюлозы с помощью различных методов простой или двойной иммунодиффузии. Такие иммунодиффузионные тесты можно применять и к белкам, предварительно разделенным путем электрофореза.
|
|
|
Иммунодиффузия - наиболее распространенный из всех методов, основанных на реакции преципитации. Количественное определение белков можно осуществлять с помощью электрофореза в среде, содержащей антитела (электроиммуноанализ, электроиммуно-диффузия, ракетный иммуноэлектрофорез). Этот метод применяют также для анализа смеси белков, предварительно разделенных в процессе электрофореза (перекрестный иммуноэлектрофорез, перекрестный электрофорез в среде с антителами).
Классический ммуноэлектрофорез
В своей классической форме иммуноэлектрофорез представляет сочетание электрофореза в агаровом (или агарозном) геле с последующей двойной иммунодиффузией в той же среде.
Двойная радиальная иммунодиффузия. В 1948 г. Орьян Оухтерлони и независимо от него Стефан Элек опубликовали разработанную ими методику двойной, или встречной, иммунодиффузии, т.е. диффузии антител и антигенов навстречу друг другу в геле. Они использовали физико-химические свойства агарового геля, поры которого имеют размеры, достаточные, чтобы пропустить (дать возможность диффундировать) молекулы свободных антител и многих растворимых антигенов, но задерживающие более крупные по размеру комплексы антител с антигенами. В результате в месте встречи антител с антигенами выпадает осадок; в геле он виден невооруженным глазом как полоса преципитации. Оухтерлони и Элек подобрали концентрацию агар-агара - 1,25-1,5%.
|
|
|
Суть метода заключается в следующем:
- в тонком слое геля вырезают лунки для антигена и антител;
- антиген и антитела диффундируют навстречу друг другу, образуя линии преципитации на некотором расстоянии от лунок. По расстоянию от лунки с антигеном до линии преципитации можно определить концентрацию антигена.
Можно в лунки заносить разные антигены и проверять их идентичность (рис.1). Для выявления полной или частичной идентичности обычно располагают лунки в углах треугольника, в две помещают растворы сравниваемых антигенов, в третью — антисыворотку.








|
|
|
 |  | ||||||
 | |||||||
 | |||||||
1 2 3 4
Принципиально возможны четыре варианта расположения линий преципитации:
1. Обе линии преципитации полностью сливаются. Это говорит об идентичности обоих антигенов.
2. Линии преципитации пересекаются. Это значит, что реагирующие с антисывороткой детерминанты антигены неидентичны и, следовательно, сами антигены различны.
3. Одна линия длиннее и продолжается за другую в виде так называемой "шпоры". "Шпора" часто бывает тоньше основной линии преципитации. Линия преципитации от второй лунки с антигенами сливается с первой линией. Это означает, что оба антигена обладают некоторыми общими детерминантами и образуют с соответствующими антителами иммунные комплексы, приводящие к слиянию линий. Кроме того, один из антигенов имеет больше детерминант, чем другой, что при наличии соответствующих антител в антисыворотке приводит к образованию "шпоры".
4. Обе линии преципитации перекрещиваются и сливаются одновременно. Это означает, что оба антигена содержат как одинаковые, так и различные детерминанты, которые вступают в реакцию с антителами полиспецифической антисыворотки.
|
|
|
Иммуноэлектрофорез в агаровом геле. Сочетание электрофореза с двойной иммунодиффузией впервые описали в 1953 г. Грабар и Уильяме. Исходный метод обычно называют макрометодом (рис. 2), так как в нем применяют относительно большую стеклянную пластинку (13Х Х18 см), покрытую слоем геля толщиной 2—4 мм.
В геле с одного края пластины пробивают ряд из несколько лунок, в которые вносят исследуемые на содержание тех или иных интересующих белков растворы или сыворотки пациентов. К пластине с гелем прикладывают электрическое поле и проводят электрофорез. По завершении электрофореза в геле в центре пластины вырезают канавку, параллельную направлению движения белков в электрическом поле. В эту канавку вносят антисыворотку или смесь антител против искомых белков и оставляют на 16-24 ч для диффузии, после чего регистрируют образующиеся полосы преципитации. Число полос преципитации показывает, к какому количеству компонентов, находящихся в биопробе, в антисыворотке есть комплементарные антитела (рис.2).
В качестве примера можно привести следующий. В стартовые лунки для электрофореза внесены сыворотки крови двух пациентов - 1 и 2, в канавку в центре пластины по завершении электрофореза проб сывороток внесена смесь антисывороток против основных фракций сывороточных белков - альбуминов, α-, β- и γ-глобулинов. После диффузии сыворотки-1 видны дуги преципитации со всеми основными фракциями сывороточных белков, в том числе с иммуноглобулинами. В сыворотке пациента 2 гамма-глобулины отсутствуют. На основании данных электрофореза пациенту 2 поставлен диагноз агаммаглобулинемии.
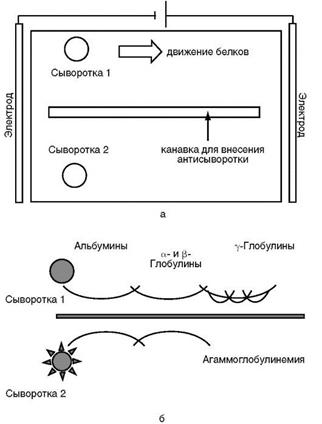 Рис. 2. Схема иммуноэлектрофореза по Грабару и Уиллиамсу: а - схема установки; б - результаты электрофореза
Рис. 2. Схема иммуноэлектрофореза по Грабару и Уиллиамсу: а - схема установки; б - результаты электрофореза
В 1955 г. Шейдеггер предложил микромодификацию этого метода, применив обычные предметные стекла.
Картина преципитации, получаемая при иммуноэлектрофорезе, сильно зависит от свойств иммунной сыворотки. Для каждого компонента смеси антигенов существует определенный диапазон концентраций, в котором получаются хорошо сформированные четкие линии преципитации (зона эквивалентности). В многокомпонентных смесях концентрация отдельных антигенов может различаться в широких пределах.
Существует много способов количественного определения антигенов путем иммуноэлектрофореза. Был описан метод, основанный на принципе простой иммунодиффузии, при которой углубления для антигенов и антител примыкают непосредственно друг к другу. Антиген, находящийся в одной части геля, диффундирует в другую, содержащую антитела, и на границе этих двух частей образуется линия преципитации. Первичная зона преципитации растворяется затем в избытке антигена, продолжающего поступать благодаря диффузии в ту часть геля, где находятся антитела. Растворимые комплексы антиген-антитело вновь преципитируют при реакции с антителами в прилежащей зоне геля.
Описанная последовательность событий — преципитация, растворение и повторная преципитация — создает впечатление, что преципитат движется. Путь, пройденный передним краем преципитата за тот или иной период времени, может служить мерой для определения концентрации антигенов.
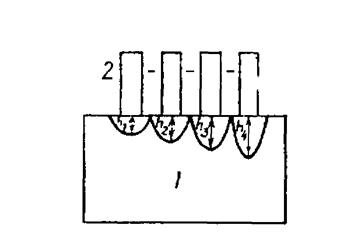 Рис.3. 1- участок геля, содержащего антитела; 2—участки геля, содержащие антиген в повышающихся концентрациях; h1-h4 — расстояние, между самой дальней точкой дуги преципитата и границей между двумя гелями при возрастающих концентрациях антигена.
Рис.3. 1- участок геля, содержащего антитела; 2—участки геля, содержащие антиген в повышающихся концентрациях; h1-h4 — расстояние, между самой дальней точкой дуги преципитата и границей между двумя гелями при возрастающих концентрациях антигена.
По методу, предложенному Альфонсо, точно измеренный объем раствора антигена подвергают электрофорезу. Затем пластинки оставляют на некоторое время, чтобы дать материалу, разделившемуся при электрофорезе, диффундировать, после чего поверхность геля дважды в течение 1 ч покрывают антисывороткой (4—5 мкл/см2). Образуются зоны преципитации круглой или овальной формы. Количество антигена рассчитывают по величине поперечного диаметра этих зон.
Методика Хереманса позволяет сравнивать некоторые компоненты двух смесей антигенов, предварительно подвергнутых электрофорезу. С этой целью канавку с антителами укорачивают или прерывают участком геля, не содержащим антител, что позволяет соответствующим зонам преципитации взаимодействовать между собой. В результате на иммуноэлектрофореграмме возникает картина, указывающая на полную или частичную идентичность либо на неидентичность сравниваемых антигенов.
Электроиммуноанализ (электроиммунодиффузия, ракетный иммуноэлектрофорез)
Суть метода электроиммуноанализа заключается в том, что антигены в процессе электрофореза мигрируют в гель, содержащий антитела, в результате чего происходит реакция преципитации. В обратной постановке опыта антитела перемещаются в гель, содержащий антиген.
Как правило, антигены мигрируют в гель, содержащий антитела. Раствор антигенов помещают в лунки, вырезанные в геле. Во время электрофореза образуются зоны преципитации, имеющие форму пиков (рис 8). Передний край преципитата перемещается с постепенно уменьшающейся скоростью по направлению к одному из электродов до тех пор, пока мигрирующий антиген не перестает поступать в избытке.
Впервые электроиммуноанализ описали Лорелл, а также Мерилл.
Электроиммуноанализ проводится следующим образом. Готовят 0,8—1,5%-ный золь агарозы в соответствующем буфере. После охлаждения золя до 45—55 °С его смешивают с антисывороткой или с выделенными антителами и формируют слой геля толщиной 1—1,5 мм. С этой целью теплый золь агарозы выливают на стеклянную пластинку, установленную строго горизонтально, или заливают агарозу в форму, образованную двумя стеклянными пластинками и U-образной рамкой. Рамку оставляют между стеклами до завершения электрофореза, но ее можно удалить и залить освободившееся пространство агарозой. Как правило, требуется сравнительно небольшое количество антисыворотки, но оно, естественно, зависит от ее титра. Для количественного анализа наиболее удобны пики преципитации высотой 20—30 мм. Работать следует с самым большим разведением антисыворотки, при котором еще возможно образование видимого преципитата. Разведение антигена должно быть подобрано соответствующим образом. Если исследуют антигены с мол. массой более 200 000, то в этом случае особенно важно разбавлять реагенты до такой степени, чтобы происходила лишь слабая преципитация, поскольку крупные комплексы таких антигенов с антителами могут забивать поры в геле, что приведет к образованию полос преципитации неправильной формы.
Лунки диаметром 3—4 мм вырезают в геле ближе к его катодному концу. Делают это с помощью пластмассового трафарета и металлической трубки с достаточно острыми краями. Простое приспособление такого типа описал Вееке. Лунки должны быть расположены на расстоянии не менее 6 мм друг от друга и 1—1,5 см от краев геля (во избежание краевых эффектов). Чаще всего используют 20—80 мМ вероналовые буферы с рН 8,6. При таком значении рН средняя подвижность антител в гелях агарозы близка к нулю. Электрофорез можно проводить либо при относительно высоком напряжении (8—10 В/см) в течение 2—4 ч (быстрый ракетный электрофорез, при котором необходимо эффективное охлаждение), либо при низком напряжении (2 В/см) более длительное время (удобно проводить электрофорез в течение ночи).
При электроиммуноанализе и перекрестном иммуноэлектрофорезе используют, как правило, антитела кроликов или коз. С антителами лошади были получены неудовлетворительные результаты, что, вероятно, объясняется более высокой подвижностью антител гипериммунной сыворотки данного вида. Петерфи и др. получили отчетливые, хорошо оформленные преципитаты путем превращения антител лошади во фрагменты F(ab')2. Это, по-видимому, обусловлено тем, что фрагменты F(ab'h обладают такой же подвижностью, как и у-глобулины, тогда как антитела мигрируют вместе с γ-глобулинами. Фрагменты получают путем обработки цельной сыворотки пепсином при рН 3,6 и последующего дробного осаждения гидролизата (NH4)2S04.
После электрофореза непреципитированные белки можно удалять промыванием солевым раствором. Лорелл рекомендует более быстрый способ. Гель покрывают листом фильтровальной бумаги, величина которого слегка превышает размеры геля. Затем на него помещают слой толстой фильтровальной бумаги толщиной 2—3 см, а сверху кладут легкий груз (около 10 г/см2), например толстую стеклянную пластинку. Через 10—15 мин фильтровальную бумагу снимают и гель промывают в течение 15 мин солевым раствором. После многократного промывания солевым раствором гель вымачивают в течение 15 мин в дистиллированной воде, опять кладут на 10—15 мин под пресс и, наконец, сушат горячим воздухом. Сухие пластинки геля можно окрашивать обычными красителями для белков или с помощью более специфических реакций.
Строго говоря, площадь под пиком преципитата пропорциональна количеству внесенного антигена и обратно пропорциональна концентрации антител в геле. Если допустить, что высота пика преципитата пропорциональна его площади, то можно с достаточной точностью определить количество антигена путем измерения расстояния от верхнего края лунки до вершины пика. Для получения калибровочной кривой на гель наносят ряд стандартных антигенов с известной концентрацией. Сколари и др. обнаружили, что линейная зависимость между площадью пика и количеством антигена сохраняется в более широком интервале концентраций антигена по сравнению с такой же зависимостью между концентрацией антигена и высотой пика. Точность метода зависит от того, насколько близки между собой размеры молекул и величина зарядов исследуемых и стандартных антигенов. Воспроизводимость количественных определений наиболее высока в том случае, когда образуются симметричные пики преципитации с отчетливыми внутренними и внешними границами. Стандартная ошибка может при этом составлять 2—5%, несколько превышая ошибку, которую дает простая радиальная иммунодиффузия при оптимальных условиях.
С помощью электрофореза в геле, содержащем антитела, можно проводить сравнительный анализ антигенов. Данный вопрос обсуждают Грабб и более детально
Аксельсен и его соавторы. Здесь мы рассмотрим один из многих возможных вариантов этого метода. Стандартный антиген помещают в прямоугольную канавку, а исследуемый образец — в круглую лунку, расположенную ближе к катоду. При таком расположении можно получить картину, указывающую на полную или частичную антигенную идентичность, либо на отсутствие идентичности (рис. 89). Эта методика представляет собой упрощенный вариант ракетно-линейного иммуноэлектрофореза.
В обычных условиях (вероналовый буфер, рН 8,6, ионная сила 0,02—0,08) подвижность преципитирующих антител у большинства видов животных практически равна нулю. В действительности, конечно, это не совсем так, поскольку антитела гетерогенны по своей электрофоретической подвижности. И тем не менее для правильного проведения электроиммуноанализа необходимо, чтобы основная масса антител оставалась неподвижной. Такое ограничение суживает пределы применимости метода, так как те антигены, которые в указанных условиях движутся к аноду не намного быстрее, чем антитела, будут давать несимметричные пики, а следовательно, данный метод непригоден для точного определения их количества.
Указанное ограничение можно устранить, если повысить анодную подвижность антигенов путем их химической модификации. Сделать это можно с помощью карбамилирования, а также реакции с формальдегидом или с 3-про-пиолактоном.
Способ карбамилирования очень прост: к исследуемым и стандартным пробам добавляют 2 М KOCN в соотношении 1 : 1 (объем/объем). Смесь оставляют на 30 мин при 45°С, а затем охлаждают в ледяной бане, чтобы остановить реакцию, Пробы разводят до необходимого объема буфером, после чего они готовы для электроиммуноанализа.
Шуллер и Темпе ;описали надежный метод электроиммуноанализа малых количеств медленно мигрирующих антигенов (иммуноглобулинов), основанный на добавлении в гель карбоксиметилцеллюлозы.
Если предполагается проводить электроиммуноанализ при более низком значении рН, то химической модификации должны быть подвергнуты антитела. Было проведено детальное изучение реакции карбамилирования антител. Варьируя продолжительность реакции, можно легко контролировать степень карбамилирования и таким образом получать антитела, обладающие при нужном значении рН нулевой электрофоретической подвижностью. Так, например, карбамилированные антитела дают возможность проводить электроиммуноанализ иммуноглобулинов при рН 5,0, когда иммуноглобулины перемещаются к катоду под действием электроосмоса. Преимущество использования модифицированных антител состоит в том, что оно позволяет избежать модификации исследуемых образцов.
Дата добавления: 2021-01-21; просмотров: 180; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
