Смещение химического равновесия
На состояние химического равновесия оказывают влияние концентрация реагирующих веществ, температура, а для газообразных веществ и давление. При изменении одного из этих параметров равновесие нарушается и концентрации всех реагирующих веществ будут изменяться до тех пор, пока не установится новое равновесие, но уже при иных значениях равновесных концентраций. Переход реакционной системы из одного состояния равновесия в другое называется смещением (или сдвигом) химического равновесия.
Направление смещения химического равновесия определяется общим положением, известным под названием принципа Ле Шателье: изменение одного из условий (температуры, концентрации, давления), при которых система находится в состоянии равновесия, вызывает смещение равновесия в направлении той реакции, которая противодействует произведенному изменению.
Согласно принципу Ле Шателье, при повышении температуры происходит смещение равновесия сторону эндотермической реакции, при понижении - в сторону экзотермической реакции.
Введение в равновесную систему дополнительныхколичеств любого из реагирующих веществ ускоряет ту реакцию, при которой оно расходуется: увеличение концентрации исходных веществ смещает равновесие в сторону образования продуктов реакции; увеличение концентрации продуктов реакции смешает равновесие в сторону образования исходных веществ.
|
|
|
Изменение давления действует на смещение равновесия газовых реакций, идущих с изменением числа молей. Увеличение давления смещает равновесие в сторону той реакции, которая приводит к уменьшению общего числа молей в газовой фазе, а следовательно, к уменьшению давления в системе.
Равновесие в гетерогенной системе
Гетерогенная система разделена на отдельные части -фазы - границами раздела. Если между веществами, составляющими фазы, происходит обратимая реакция, то равновесие должно устанавливаться на всех границах раздела между всеми фазами.
Если в гетерогенной реакции участвуют твердые вещества и газы, например, реакция горения угля, то в выражение для константы химического равновесия входят лишь парциальные давления газообразных участников реакции:
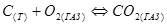 ;
;
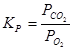 .
.
Цель работы: изучить зависимость скорости химической реакции от концентрации и температуры, а также влияние изменения концентрации реагирующих веществ на смещение химического равновесия.
Опыт I . Зависимость скорости гомогенной реакции от концентрации.
Классическим примером гомогенной реакции является взаимодействие между раствором тиосульфата натрия с серной кислотой, протекающее по уравнению:
|
|
|
Na2S2O3+H2SO4=S 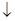 +H2SO3+Na2SO4. (18)
+H2SO3+Na2SO4. (18)
Возникающая при этой реакции сера вызывает помутнение раствора. Необходимо измерить по секундомеру время от момента сливания до появления едва заметной мути. Зная время протекания реакции (с), легко определить скорость реакции, так как последняя является величиной, обратной времени:
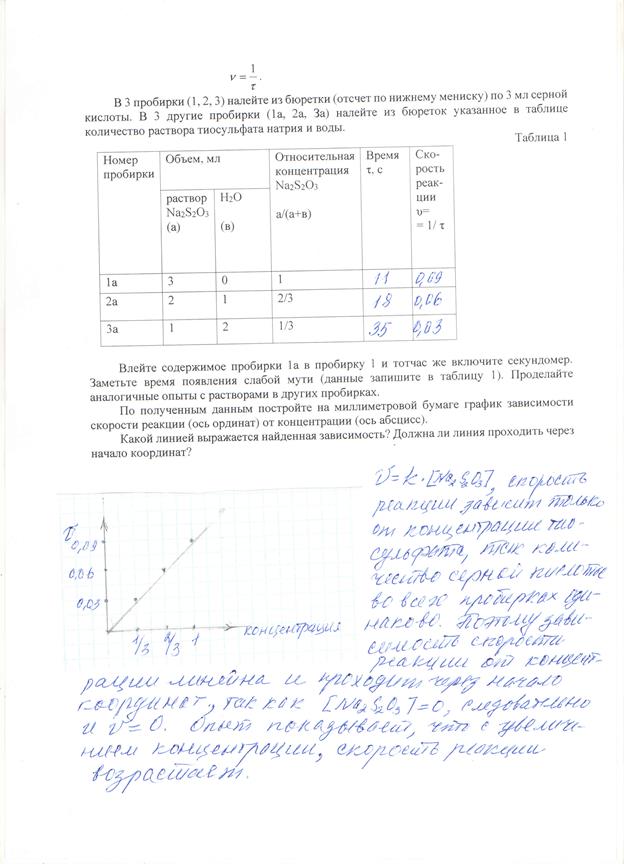


Вывод :
Контрольные вопросы
1. Скорость химической реакции, ее размерность.
2. Основной кинетический закон (закон действующих масс) для гомогенных и гетерогенных реакций.
3. Зависимость скорости химической реакции от температуры.
3.1. Правило Вант-Гоффа.
3.2. Уравнение Аррениуса.
3.3. Энергия активации.
4. Химическое равновесие, его особенности.
5. Математическое выражение константы равновесия гомогенной и гетерогенной химических реакций.
6. Выражение константы равновесия через концентрации и парциальные давления реагирующих веществ.
7. Влияние изменения концентрации, температуры и давления на смещение химического равновесия. Принцип Ле Шателье.
8. Расчет химического равновесия с использованием закона действующих масс.
Дата добавления: 2021-01-21; просмотров: 39; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
