Зависимость скорости химической реакции
ЛАБОРАТОРНАЯ РАБОТА № 3
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Скорость химических реакций
Раздел химии, рассматривающий скорость и механизм химических процессов, называется химической кинетикой. Химические реакции могут совершаться медленно, в течение целых геологических периодов, как. например, выветривание горных пород, и могут совершаться очень быстро, в микросекунды и их доли. Например, разложение взрывчатых веществ. Поэтому любое химическое взаимодействие можно характеризовать скоростью.
Скорость химической реакции равна изменению концентрации реагирующих веществ в единицу времени.
Для реакции m А + пВ = рС + qД
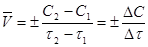 . (1)
. (1)
В уравнении (1) знак «+» относится к изменению концентрации продуктов реакции, а «-» - к изменению концентрации исходных веществ.
Поскольку скорость реакции все время изменяется, то в химической кинетике чаще рассматривают истинную скорость, понимая под ней скорость в данный момент времени:
 . (2)
. (2)
Скорость химической реакции зависит от природы реагирующих веществ и условий протекания реакции: концентрации, температуры, присутствия катализаторов, а также от некоторых других факторов (например, от давления в случае газовых реакций, от степени измельчения - в случае твердофазных реакций).
|
|
|
Зависимость скорости химической реакции
От концентрации
Чтобы осуществилось химическое взаимодействие веществ А и В, их молекулы должны столкнуться. Чем больше столкновений, тем быстрее протекает реакция. Число столкновений увеличивается при увеличении концентрации реагирующих веществ.
На основе обширного экспериментального материала сформулирован основной закон кинетики, устанавливающий зависимость скорости химической реакции от концентрации реагирующих веществ: скорость химической реакции пропорциональна произведению концентрации реагирующих веществ в степенях, соответствующих стехиометрическим коэффициентам в уравнении реакции:
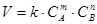 , (3)
, (3)
где С A и Св - концентрации веществ А и В, моль/л;
k-коэффициент пропорциональности, называемый константой скорости реакции.
Основной закон химической кинетики часто называют законом действия масс.
Из уравнения (3) нетрудно установить физический смысл константы скорости. Она численно равна скорости реакции при условии, если концентрация каждого из реагирующих веществ составляет 1 моль/л. Зная величину k , можно сравнивать скорости химического взаимодействия различных веществ: чем больше k , тем быстрее реагируют данные вещества. Константа скорости реакции зависит от температуры и от природы реагирующих веществ, но не зависит от концентрации последних.
|
|
|
Если в гомогенных (однофазных) системах химическое взаимодействие происходит во всем объеме, то в гетерогенных (многофазных) системах лишь на поверхности твердой фазы, которая остается неизменной. При этом концентрация твердого участника реакции также не изменяется.
Так, для реакции горения угля Ст + О2(ГАЗ) = СО2(ГА3) закон действующих масс может быть записан следующим образом:
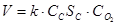 , (4)
, (4)
где k - константа скорости; Sc - величина поверхности угля; Сc - его концентрация.
Обозначая произведение постоянных величин через К1 получим:
 , (5)
, (5)
т.е. скорость гетерогенной химической реакции пропорциональна лишь концентрации газообразного реагента (кислорода), концентрация и площадь поверхности твердого вещества (угля) входит в значение константы скорости.
Зависимость скорости химической реакции
От температуры
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа: при повышении температуры на каждые 10 градусов скорость реакции увеличивается в 2—4 раза.
|
|
|
Математически эта зависимость выражается соотношением:
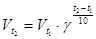 , (6)
, (6)
где  и
и 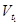 - скорости реакции при конечной t2и начальной t 1 температурах, а
- скорости реакции при конечной t2и начальной t 1 температурах, а 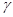 - температурный коэффициент скорости реакции, показывающий, во сколько раз увеличивается скорость реакции с повышением температуры реагирующих веществ на 10 градусов. Правило Вант-Гоффа является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакции.
- температурный коэффициент скорости реакции, показывающий, во сколько раз увеличивается скорость реакции с повышением температуры реагирующих веществ на 10 градусов. Правило Вант-Гоффа является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакции.
Температура влияет на скорость реакции, увеличивая константу скорости.
Энергия активации. Для того, чтобы произошла реакция, т.е. чтобы образовались новые молекулы, необходимо сначала разорвать или ослабить связи между атомами в молекулах исходных веществ. Но это надо затратить определенную энергию. Если сталкивающиеся молекулы не обладают такой энергией, то столкновение будет неэффективным - не приведет к образованию молекулы нового вещества.
Избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества, называется энергией активации данной реакции. Энергия активации выражается в килоджоулях на моль или килокалориях на моль. Молекулы, обладающие такой энергией, называются активными молекулами.
|
|
|
При увеличении температуры константа скорости растет, и тем сильнее, чем больше величина энергии активации. Математически зависимость константы скорости от температуры выражается уравнением Аррениуса:
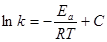 . (7)
. (7)
Величина энергии активации зависит от природы реагирующих веществ и является важной кинетической характеристикой реакции.
Химическое равновесие
Все химические реакции можно разбить на две группы: необратимые и обратимые реакции. Необратимые реакции протекают только в одном направлении. Примеры необратимых реакций:
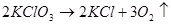 , (8)
, (8)
Na2CO3+H2SO4 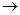 Н 2 О + СО 2
Н 2 О + СО 2 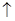 +Na2SO4, (9)
+Na2SO4, (9)
BaCl2+H 2 SO 4 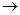 BaSO 4
BaSO 4 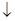 +2 HCI . (10)
+2 HCI . (10)
Большинство реакций являются обратимыми, т.е. они протекают в противоположных направлениях и не идут до конца, так как продукты реакции, взаимодействуя между собой, вновь дают исходные вещества. Таковы, например, реакции:
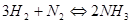 , (11)
, (11)
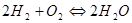 , (12)
, (12)
 . (13)
. (13)
Обратимые реакции заканчиваются достижением состояния химического равновесия. В общем случае химическое равновесие можно определить как такое состояние системы реагирующих веществ, при котором скорости прямой и обратной реакций равны между собой.
В состоянии равновесия прямая и обратная реакции не прекращаются, поэтому такое равновесие называется подвижным, или динамическим. В реагирующей смеси видимых изменений не происходит: концентрации всех веществ, как исходных, так и образующихся, остаются постоянными. Концентрации всех веществ, которые устанавливаются при химическом равновесии, называются равновесными.
Так, для обратимого процесса
тА+пВ  рС+ q Д (14)
рС+ q Д (14)
при установившемся равновесии, Vnp = Vo 6 p , т.е. согласно основному кинетическому закону:
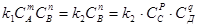 , (15)
, (15)
откуда

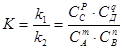 , (16)
, (16)
где СА, Св, Cс, и Сд - равновесные концентрации участников реакции; k1и k2 - константы скорости прямой и обратной реакций; К - константа химического равновесия.
Выражение (17) носит название закона действия масс: отношение произведения равновесных концентраций продуктов к произведению концентраций исходных веществ в степенях, равных стехиометрическим коэффициентам в уравнении реакции, есть величина постоянная при данной температуре.
Из этого закона следует, что константа химического равновесия не зависит от концентрации, а изменяется лишь с изменением температуры.
Если константа равновесия выражена через концентрации реагирующих веществ, то ее принято обозначать Кс. Для реакций, протекающих с участием газообразных веществ, константу равновесия выражают через пропорциональные давления и обозначают КР, например, для реакции:
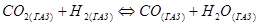 ,
,
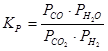 . (19)
. (19)
Дата добавления: 2021-01-21; просмотров: 57; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
