Вопрос 2.Обратимость химических реакций.
Схема 1. Классификация реакций по направлению протекания
 Химические реакции
Химические реакции
Необратимые Обратимые



 BaCl2+K2SO4 BaSO4 +2KCI H2+N2 2NH3
BaCl2+K2SO4 BaSO4 +2KCI H2+N2 2NH3


 NaOH+HCI NaCI+H2O SO2 + O2 2SO3
NaOH+HCI NaCI+H2O SO2 + O2 2SO3

 K2CO3 + 2HCI H2O + CO2 + 2KCI
K2CO3 + 2HCI H2O + CO2 + 2KCI
 Схема 2. Смещение равновесия по прнципу Ле Шателье
Схема 2. Смещение равновесия по прнципу Ле Шателье

 При Cpear , при Cper ;
При Cpear , при Cper ;
 При P (для газов ) в сторон уменьшего V,
При P (для газов ) в сторон уменьшего V,
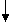 При P в сторону большего V;
При P в сторону большего V;
 При T в сторону эндотермической реакции;
При T в сторону эндотермической реакции;
 При T в сторону экзотермической реакции.
При T в сторону экзотермической реакции.
Катализатор не смещает равновесие , но ускоряет его достижение
Прнцип Ле Шателье: если на систему, находящуюся в состоянии химического равновесия, оказать внешнее воздействие, то равновесие смещается в сторону той реакции, которая противодействует этому воздействию
Задание

 Дать характеристику реакции 3H2+N2 2NH3 + Q
Дать характеристику реакции 3H2+N2 2NH3 + Q
Как необходимо изменить условия для смещения равновесия в сторону прямой реакции (образования NH3).
Примерная схема ответов Характеристика реакции.

 3H2+N2 2NH3 + Q соединения
3H2+N2 2NH3 + Q соединения
|
|
|
обратимая
о.в.р.
экзотермическая
гомогенная
некаталитическая
Условия смещения равновесия в сторону прямой реакции (образования NH3)


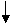
 3H2+N2 2NH3 + Q C (H2) и C (N2), т.к. эти вещества исходные, а С (NH3) продукта реакции
3H2+N2 2NH3 + Q C (H2) и C (N2), т.к. эти вещества исходные, а С (NH3) продукта реакции
|
|
|
 P, т. к. до реакции 4V (3V(H2) +1V(N2)), а после реакции 2 V(NH3)
P, т. к. до реакции 4V (3V(H2) +1V(N2)), а после реакции 2 V(NH3)
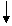 Т, т.к. экзотермическая реакция (с выделекнием теплоты)
Т, т.к. экзотермическая реакция (с выделекнием теплоты)
Задание
Дать характеристику реакции. Как необходимо изменить условия для смещения в сторону обратной реакции (образования N2 и H2) :


 3H2 + N2 2NaH3 + Q
3H2 + N2 2NaH3 + Q
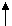

 C (NH3), т.к. это вещество теперь исходное, а C (H2) и C (N2) продуктов реакции реакции P, т. к. до реакции 2 V(NH3), а после реакции 4V (3V(H2) +1V(N2)) T, т.к. эндотермическая реакция (с поглащением теплоты)
C (NH3), т.к. это вещество теперь исходное, а C (H2) и C (N2) продуктов реакции реакции P, т. к. до реакции 2 V(NH3), а после реакции 4V (3V(H2) +1V(N2)) T, т.к. эндотермическая реакция (с поглащением теплоты)
(После выполнения задания проводится обсуждение ответов).
V . Закрепление нового материала.
Решим задачу. Как изменится скорость реакции, при повышении температуры от 100 до 500 С. Температурный коэффициент равен 3?
Решение:
V 2 / V 1 = Υ D t /10 , подставим значения в формулу
V 2 / V 1 = 3 ⁵0 -10 /10 = 3 ⁴ = 81
Ответ: в 81 раз возрастет скорость
Итак, мы познакомились с понятием «скорость химической реакции», рассмотрели от каких факторов она зависит.
Что изменяется в ходе химической реакции?
|
|
|
Какие факторы влияют на скорость химической реакции?
Что такое катализаторы и ингибиторы?
VI. Подведение итогов занятия, выставление оценок
“Труд, работа не всякая, а осмысленная, сознательная, нужная людям”.
“Сами, трудясь, вы сделаете все и для близких, и для себя, а если при труде успеха не будет, будет неудача – не беда, пробуйте еще”. Д.И. Менделеев
Выставление оценок.
VII . Рефлексия
Каждый обучающийся высказывается о занятии, выбирая начало фразы из (приложение 2).
IV . Домашнее задание О.1читать §4.2,сделать в тетради упр.,5 с.72
Д.1читать§12, сделать в тетради упр. 4, стр. 58.
Приложение 1
«ОВР»
Вариант 1.
А1. Какая из реакций, схемы которых приведены ниже, является окислительно-восстановительной:
1) 2Na + 2H2O = 2 NaOH + H2
2) Na2O + 2HCl = 2 NaCl + H2O
3) ZnSO4 + Na2CO3 = ZnCO3 + Na2SO4
4) CaO + 2HNO3 = Ca(NO3)2 + H2O
А2. Окислительно – восстановительную двойственность проявляет вещество, формула которого:
1) KClO4, 2) Cl2O3, 3) Cl2O7, 4) NaCl.
А3. Определите схему процесса восстановления:
|
|
|
0 +2 -2 +2 +7 +2 -1 0
1) Fe → Fe, 2) O → O, 3) Mn → Mn, 4) 2 Cl → Cl2.
А4. Расставьте коэффициенты методом электронного баланса:
S02 + С12 + Н20 → Н2S04 + НС1
Сумма коэффициентов в уравнении равна:
1) 11; 2) 13; 3) 7; 4) 10.
А5. Расставьте коэффициенты методом электронного баланса:
S02 + Н20 + NаIO3 → Н2S04 + NаI
Коэффициент перед формулой восстановителя равен:
1) 3; 2) 4; 3) 2; 4) 5.
А6. Вещество проявляет окислительно - восстановительные свойства, если атом, входящий в его состав, может:
1) только отдавать электроны
2) только присоединять электроны
3) проявлять промежуточную степень окисления
4) иметь только постоянную степень окисления.
В1. Установите соответствие между схемой превращения веществ и изменением степени окисления окислителя в ней.
СХЕМА ПРЕВРАЩЕНИЯ ИЗМЕНЕНИЕ СТЕПЕНИ
ОКИСЛЕНИЯ ОКИСЛИТЕЛЯ
А) C + K2Cr2O7 → Cr2O3 + K2CO3 + CO2 1) Э+7 → Э+6
Б) NaNO2 + NH4Cl → N2 + NaCl + H2O 2) Э+6 → Э+3
В) KMnO4 + KOH → K2MnO4 + O2 + H2O 3) Э+3 → Э0
4) Э0 → Э+4
5) Э-3 → Э0
Вариант 2.
А1. Какая из реакций, схемы которых приведены ниже, является окислительно-восстановительной:
1) ZnCl2 + H2S = ZnS + 2HCl
2) СаО + СО2 = СаСО3
3) 4HCl + MnO2 = Cl2 + MnCl2 + 2H2O
4) К2O + 2HCl = 2 КCl + H2O
А2. Окислительно – восстановительную двойственность проявляет вещество, формула которого:
1) HNO3, 2) N2O5, 3) Mg3N2, 4) KNO2.
А3. Определите схему процесса окисления:
+3 +2 +2 -2 +5 +2 -1 0
1) Fe → Fe, 2) O → O, 3) Mn → Mn, 4) 2 Cl → Cl2
А4. Расставьте коэффициенты методом электронного баланса:
S + НNО3 → Н2SО4 + NO2 + H2O
Коэффициент перед формулой восстановителя равен:
1) 6; 2) 3; 3) 1; 4) 5.
А5. Расставьте коэффициенты методом электронного баланса:
KClO3 + HCl → Cl2 + KCl + Н2O
Сумма коэффициентов в уравнении равна:
1) 12; 2) 9; 3) 14; 4) 15.
А6. Вещество проявляет только восстановительные свойства, если атом, входящий в его состав, может:
1) только отдавать электроны
2) только присоединять электроны
3) проявлять промежуточную степень окисления
4) иметь только постоянную степень окисления.
В1. Установите соответствие между схемой превращения веществ и изменением степени окисления окислителя в ней.
СХЕМА ПРЕВРАЩЕНИЯ ИЗМЕНЕНИЕ СТЕПЕНИ
ОКИСЛЕНИЯ ОКИСЛИТЕЛЯ
А) Fe2O3 + CO→ Fe + CO2 1) Э-1 → Э0
Б) Al2S3 + HNO3 → Al2(SO4)3 + NO2 + H2O 2) Э+3 → Э+2
В) HNO2 + HJ→ J2 + NO + H2O 3) Э+5 → Э+4
4) Э+2 → Э+4
5) Э-2 → Э+6
Приложение 2
Рефлексия
Каждый обучающийся высказывается о занятии , выбирая начало фразы :
Было трудно...... Было интересно..... Сегодня я узнал......
Теперь я могу...... Я понял что...... Теперь я смогу......
Я почувствовал что...... Я приобрел...... Я научился.....
Я выполнил задания...... Я смог ...... Занятие дало мне для жизни......
Меня удивило...... Я попробую...... Мне захотелось......
Дата добавления: 2021-01-20; просмотров: 154; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
