Составление уравнений окислительно-восстановительных реакций методом электронного баланса
- Метод основан на сравнении степеней окисления атомов в исходных веществах и продуктах реакции и на балансировании числа электронов, смещенных от восстановителя к окислителю. Применяется метод для составления уравнений реакций, протекающих в любых фазах. В этом универсальность и удобство метода.
Преподаватель предлагает обучающимся рассмотреть алгоритм составления уравнений ОВР методом электронного баланса (приложение 2).
Обучающиеся уравнивают схему реакции
2K 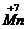 O4 + 2KOH + Na2
O4 + 2KOH + Na2 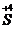 O3 → 2K2
O3 → 2K2 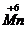 O4 + Na2
O4 + Na2 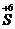 O4 + H2O
O4 + H2O

 Mn+7 + 1
Mn+7 + 1 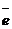 → Mn+6 2 вос-ся, ок-тель
→ Mn+6 2 вос-ся, ок-тель
2
S+4 - 2 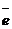 → S+6 1 ок-ся, вос-тель
→ S+6 1 ок-ся, вос-тель
2K 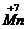 O4 + H2О + 3Na2
O4 + H2О + 3Na2 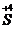 O3 → 2
O3 → 2 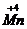 O2↓ + 3Na2
O2↓ + 3Na2 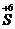 O4 + 2КОH
O4 + 2КОH

 Mn+7 + 3
Mn+7 + 3 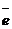 → Mn+4 2 вос-ся, ок-тель
→ Mn+4 2 вос-ся, ок-тель
6
S+4 - 2 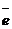 → S+6 3 ок-ся, вос-тель
→ S+6 3 ок-ся, вос-тель
2K 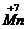 O4 + 3H2SO4 + 5Na2
O4 + 3H2SO4 + 5Na2 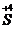 O3 → 2
O3 → 2 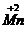 SO4 + 5Na2
SO4 + 5Na2 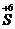 O4 + К2SO4 + 3H2O
O4 + К2SO4 + 3H2O

 Mn+7 + 5
Mn+7 + 5 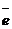 → Mn+2 2 вос-ся, ок-тель
→ Mn+2 2 вос-ся, ок-тель
10
S+4 - 2 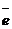 → S+6 5 ок-ся, вос-тель
→ S+6 5 ок-ся, вос-тель
V . Закрепление
1. Задание
I вариант
1.К окислительно-восстановительным реакциям не относится реакция, представленная схемой:
А) N 2 + 3Н2 = 2 N Н3
Б) Mg + 2 HCl = MgCl 2 + H 2 ↑
В )MgCO3 = MgO + CO2 ↑
Г ) 2CuO = 2Cu + O2↑
2.В каком соединении степени окисления элементов равны -3 и +1
А) NF 3 Б) Cl 2 O 3
В) NH 3 Г) AlCl 3
3.Схема Na 0 → Na +1 отражает процесс:
А) Окисления
Б) Восстановления
В) Нейтрализации
|
|
|
Г) Диссоциации
4.Восстановительные свойства простых веществ, образованных элементами второго периода, с увеличением заряда ядра:
А) Уменьшаются
Б) Усиливаются
В) Изменяются периодически
Г) Не изменяются
II вариант
1.К окислительно-восстановительным реакциям относится реакция, представленная схемой:
А ) H2O + CaO = Ca(OH)2
Б ) H2O + N2O5 = 2HNO3
В ) Na2CO3 + 2HCl = 2NaCl + H2O + CO2
Г) CuO + H 2 = Cu + H 2 O
2.В каком соединении степени окисления элементов равны +3 и -2
А) NF 3 Б) Cl 2 O 3
В) NH 3 Г) AlCl 3
3.Схема С l 0 → С l -1 отражает процесс:
А) Окисления
Б) Восстановления
В) Нейтрализации
Г) Диссоциации
4.Окислительные свойства простых веществ, образованных элементами седьмой группы, главной подгруппы с увеличением заряда ядра:
А) Уменьшаются
Б) Усиливаются
В) Изменяются периодически
Г) Не изменяются
2.Обучающимся предлагается поменяться с соседом тетрадями, проверить задания и выставить друг другу оценки (или проверить и самим себе поставить оценку).
VI . Подведение итогов занятия, выставление оценок
Преподаватель подводит итоги урока, обращая внимание обучающихся на значение химии. Выставляются оценки.
|
|
|
VII. Рефлексия
По итогам урока обучающимся предлагается выбрать на столах кружок, который отображает их усвоение материала:
 Зеленый - все понял, желтый – понял, но есть вопросы,
Зеленый - все понял, желтый – понял, но есть вопросы,
Красный – ничего не понял
VIII . Домашнее задание О.1читать §4.2,сделать в тетради упр.,5 с.72
Д.1читать §12,сделать в тетради упр. 4, стр. 58.
Приложение 1
Вариант №1
1. Какую общую формулу имеют оксиды?
а) Ме(ОН)у б) ЭnOm в) Нх(Ас)у г) Мех(Ас)у
2. Какой из оксидов является несолеобразующим?
а) Al2O3 б) CO2 в) CO г) Fe2O3
3. Какое из оснований является однокислотным?
а) Сu(ОН)2 б) NaOH в) Fe(OH)3 г) Fe(OH)2
4. Какая из кислот является одноосновной?
а) H2Sб) HClв) H2SO4 г) H2SO3
5. Какая из солей является нормальной (средней) солью?
а) NaH2PO4 б) Na2HPO4 в) Na3PO4 г) Na2HPO3
6. Какова валентность кислотообразующего элемента в молекуле сернистой кислоты?
а) III б) II в) IV г) VI
7. Какой из кислот соответствует название «фосфористая кислота»?
а) H4P2O7 б) HPO3 в) Н3PO3 г) H3PO4
8. Какой соли соответствует название «силикат свинца (II)»?
|
|
|
а) Pb(OH)2SiO3 б) Pb(HSiO3)2 в) Pb(SiO3)2 г) PbSiO3
9. Какой соли соответствует название «гидрокарбонат железа (II)»?
а) Fe(HCO3)3 б) FeOHCO3 в) Fe(HCO3)2 г) (FeOH)2CO3
10. Какой соли соответствует название «дигидрокосульфат висмута (III)»?
а) BiOHSO3 б) [Bi(OH)2]2SO4 в) BiOHSO4 г) [Bi(OH)2]2SO3
Вариант .№2
1. Какую общую формулу имеют основания?
а) Ме(ОН)у б) ЭnOm в) Нх(Ас)у г) Мех(Ас)у
2. Какой из оксидов является амфотерным?
а) Al2O3 б) CO2 в) CO г) Fe2O3
3. Какое из оснований является двухкислотным?
а) Сu(ОН)2 б) NaOH в) Fe(OH)3 г) Fe(OH)2
4. Какая из кислот является двухосновной?
а) H2S б) HCl в) H3ВO3 г) H2СO3
5. Какая из солей является кислой солью?
а) (FeOH)2CO3б) Fe(HCO3)3 в) FeOHCO3 г) Fe2CO3
6. Какова валентность кислотообразующего элемента в молекуле хлорноватой кислоты?
а) III б) II в) IV г) V
7. Какой из кислот соответствует название «сернистая кислота»?
а) H2Sб) H2S2O3 в) Н2SO3 г) H2SO4
8. Какой соли соответствует название «карбонат висмута (III)»?
а) BiOHСO3 б) Bi2(СO3)3 в) Bi(HСO3)3 г) [Bi(OH)2]2СO3
9. Какой соли соответствует название «гидросульфат висмута (III)»?
а) Bi(HSO4)3 б) Bi(HSO3)3 в) BiOHSO4 г) [Bi(OH)2]2SO4
10. Какой соли соответствует название «дигидрокосульфит алюминия»?
а) [Al(OH)2]2SO4б) Al(OH)SO3 в) [Al(OH)2]2SO3г) Al(OH)SO4
Критерии оценки:
|
|
|
1балл за каждый правильный ответ на вопрос
10-9 правильных ответов – «5»
8-7 правильных ответов –«4»
5-6 правильных ответов – «3»
1,2,3,4, правильных ответов – «2»
Приложение 2.
Алгоритм составления уравнений окислительно-восстановительных реакций.
| Последовательность действий | Примеры |
| Составить схему химической реакции | KClO3→KCl + O2 |
| Определить и расставить степени окисления элементов | 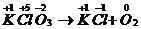
|
| Выбрать элементы, изменившие степень окисления. Выписать их и показать схематично переход электронов (составить электронный баланс). | 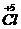 + 6 + 6 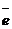 = = 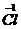 2
2 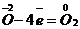
|
| Найти наименьший общий множитель и определить коэффициенты перед окислителем и восстановителем |   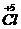 + 6 + 6 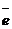 = = 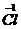 2 вос-ся, ок-ль
6
2 2 вос-ся, ок-ль
6
2 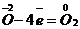 3 ок-ся, вос-тель 3 ок-ся, вос-тель
|
| Расставить коэффициенты из электронного баланса. | 2KClO3→2KCl + 3O2 |
| Сравнением числа атомов каждого элемента в правой и левой части уравнения реакции определить и проставить недостающие коэффициенты. |
Дата добавления: 2021-01-20; просмотров: 225; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
