Определите понятие «окислитель».
КАРТА ЗАНЯТИЯ № 11
Учебный предмет: Химия
Тема Химические реакции.
Цели занятия:
образовательные: сформировать представление обучающихся о единой природе химической связи; познакомить обучающихся с различными типами химических связей; научить определять типы химических связей в различных соединениях.
развивающие: формировать умение определять тип химической связи в соединении; развивать устную речь обучающихся, умение применять знания в новой ситуации;
воспитательные :развивать познавательный интерес обучающихся; способствовать росту инициативы и самостоятельности; формирование культуры общения, чувства уважения друг к другу.
Норма времени: 2 часа
Тип занятия: изучение нового материала и первичного закрепления
Вид занятия: лекция с элементами презентации
Форма организации учебной деятельности: групповая
План занятия:
1.Классификация химических реакций.
2. Окислительно-восстановительные реакции .
Оснащение: проектор, экран, презентация, литературное сопровождение,
Литература:
Основные источники:
- Естествознание. Химия: учеб. студ учреждений сред. Проф. Образования/.О.С. Габриелян, и.Г. Остроумова.-4-е изд., стер.- М.: Издательский центр «Академия», 2018-240с., [8] с. цв.вкл.
Дополнительные источники:
1. Рудзитис Г.Е., Фельдман Ф.Г., Химия. 11 класс. – М.: Просвещение, 2014
2. Рудзитис Г.Е., Фельдман Ф.Г., Химия. 10 класс. – М.: Просвещение, 2014
|
|
|
3. Габриелян О. С., Остроумов И. Г. Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред. проф. образования. — М., 2014.
4. Габриелян О. С., Остроумов И. Г., Остроумова Е. Е. и др. Химия для профессий и специальностей естественно-научного профиля: учебник для студ. учреждений сред. проф. образования. — М., 2014.
5. Габриелян О. С., Остроумов И. Г. Химия для профессий и специальностей социально-экономического и гуманитарного профилей: учебник для студ. учреждений сред. проф. образования. — М., 2014.
6. Габриелян О. С., Остроумов И. Г., Сладков С. А., Дорофеева Н.М. Практикум: учеб. Пособие для студ. учреждений сред. проф. образования. — М., 2014.
Интернет ресурсы:
- www. hemi. wallst. ru (Образовательный сайт для школьников «Химия»).
- www. alhimikov. net (Образовательный сайт для школьников).
- www. chem. msu. su (Электронная библиотека по химии).
- www. enauki. ru (интернет-издание для учителей «Естественные науки»).
- www.5ballov. ru/test (Тест для абитуриентов по всему школьному курсу биологии).
- www. informika. ru (Электронный учебник, большой список интернет-ресурсов).
- www. kozlenkoa. narod. ru (Для тех, кто учится сам и учит других; очно и дистанционно,биологии, химии, другим предметам).
Преподаватель: Корниенко Т.В.
Тема: Химические реакции.
|
|
|
Ход занятия
I . Организационный момент.
Проверка готовности группы к занятию, проверка присутствующих на занятии.
II . Актуализация опорных знаний
Тестовая работа по теме «Классификация неорганических соединений и их свойства»(Приложение 1)
III . Мотив ация и целепологания
В окружающем нас мире протекает огромное число реакций. Вот мы просто сидим, стоим, идем куда-либо, а в каждой клеточке нашего тела каждую секунду происходят десятки и сотни тысяч превращений одних веществ в другие. Сформулируем тему занятия: «Химические реакции».
IV . Объяснение нового материала
Вопрос 1.Классификация химических реакций.
Признаки классификации химических реакций
1. По числу и составу исходных веществ и продуктов реакции.
2. По тепловому эффекту.
3. По признаку обратимости.
4. По признаку изменения степеней окисления.
5. По агрегатному состоянию веществ.
6. По наличию катализатора.
7. По механизму.
Т ипы химических реакций:
1. По числу и составу реагентов .
- Реакции, идущие с изменением состава вещества
· Р-я соединения
· Р-я разложения
· Р-я замещения
· Р-я обмена
2. По изменению степеней окисления химических элементов - Окислительно – восстановительные(С. О. у элементов меняется)
|
|
|
- Неокислительно- восстановительные (С. О. – const)
3. По направлению:
-Обратимые реакции - протекают одновременно в двух противоположных направлениях
- Необратимые реакции - протекают только в одном направлении
Признаки необратимости:
· образование осадка,
· образование слабого электролита (Н2О …),
· выделение газа,
По тепловому эффекту(Q):
- Экзотермические (+ Q)
-Эндотермические (-Q)
Вопрос 2. Окислительно-восстановительные реакции .
Окислительно-восстановительные реакции чрезвычайно распространены. Окислительно-восстановительные реакции сопровождают многие процессы, осуществляемые в промышленности и в различных сферах быта: горение газа в газовой плите, приготовление пищи, стирка, чистка предметов домашнего обихода, изготовление обуви, парфюмерных, текстильных изделий. Зажигаем ли мы спичку, горят ли в небе причудливые фейерверки – все это окислительно-восстановительные процессы.
Окислительно-восстановительные реакции лежат в основе преобразования энергии взаимодействующих химических веществ в электрическую энергию в аккумуляторах, гальванических элементах.
-Что такое степень окисления?
|
|
|
Степень окисления – это условный заряд атома химического элемента в соединении, вычисленный исходя из предположения, что оно состоит только из ионов. (Степень окисления может быть положительной, отрицательной или равняться нулю, что зависит от природы соответствующих соединений.)
- А лгоритм определения степени окисления химического элемента в неорганических соединениях.
Для подсчета степеней окисления имеется ряд простых правил:
· Степень окисления элемента в составе простого вещества принимается равной нулю. Если вещество находится в атомарном состоянии, то степень окисления его атомов также равна нулю.
· Ряд элементов проявляют в соединениях постоянную степень окисления. Среди них фтор (−1), щелочные металлы (+1), щелочноземельные металлы, бериллий, магний и цинк (+2), алюминий (+3).
· Кислород, как правило, проявляет степень окисления −2 за исключением пероксидовH2O2(−1) и фторида кислородаOF2(+2).
· Водород в соединении с металлами (в гидридах) проявляет степень окисления −1, а в соединениях с неметаллами, как правило, +1 (кромеSiH4,B2H6).
· Алгебраическая сумма степеней окисления всех атомов в молекуле должна быть равной нулю, а в сложном ионе — заряду этого иона.
Самостоятельная работа (письменная работа, 1 ученик выполняет задание у доски)
Задание. Определите степени окисления элементов в заданных формулах бинарных соединений. Назовите вещества, формулы которых: P2O5, MnCl2, NO2, Al2O3, H2S, H2O2, SiH4, Ca3P2, FeCl3, SO2, KBr, NO, P2S3, AlH3, CO2.
Определите понятие «окислитель».
Окислитель – частица, принимающая электроны.
- Определите понятие «восстановитель».
Восстановитель– частица, отдающая электроны.
- Что называется процессом восстановления? Как изменяется степень окисления элемента при восстановлении?
Восстановление – процесс принятия электронов, при этом степень окисления элемента понижается.
- Что называется процессом окисления? Как изменяется степень окисления элемента при окислении?
Окисление - процесс отдачи электронов, при этом степень окисления элемента повышается.
Задание .
(Обучающиеся выполняют задание по вариантам, после выполнения – самопроверка с ответами).
Какие из перечисленных ниже процессов представляют собой: окисление (О), какие – восстановление (В)? Определите число отданных или принятых электронов.
Вариант I Вариант II Вариант III Вариант IV
1.Cl  2Cl-1 1. Se0→Se-2 1. 2H+1→H
2Cl-1 1. Se0→Se-2 1. 2H+1→H 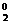 1. Fe0→ Fe+3
1. Fe0→ Fe+3
2.S-2 → S0 2. Cu+2 → Cu0 2. Fe0→ Fe+2 2. N+5 → N+3
3.Cs0 → Cs+1 3. Cr0 → Cr+3 3. Fe+2→ Fe+3 3. N+3 → N+5
4.Sn+2 → Sn+4 4. H 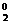 → 2H+1 4. S+4 → S0 4. Cu+2 → Cu0
→ 2H+1 4. S+4 → S0 4. Cu+2 → Cu0
5.Fe+3→ Fe+2 5. 2O-2 → O 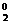 5. S+4 → S+6 5. Sn+4 → Sn+2
5. S+4 → S+6 5. Sn+4 → Sn+2
6.Ni0 → Ni+2 6. Cr+6 → Cr+3 6. S0 → S+4 6. H 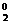 → 2H+1
→ 2H+1
В результате выполнения этой работы преподаватель предлагает обучающимся сформулировать
Правила определения функции соединения в ОВР (записывают в тетрадь).
1. Если элемент проявляет в соединении высшую степень окисления, то это соединение может быть окислителем.
2. Если элемент проявляет в соединении низшую степень окисления, то это соединение может быть восстановителем.
3. Если элемент проявляет в соединении промежуточную степень окисления, то это соединение может быть как восстановителем, так и окислителем.
Задание.
Предскажите функции веществ в окислительно-восстановительных реакциях: H2SO4, SO2, S, H2S.
Ответ.
H2 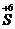 O4 – окислитель, так как элемент сера проявляет в данном соединении высшую степень окисления (+6).
O4 – окислитель, так как элемент сера проявляет в данном соединении высшую степень окисления (+6).
H2 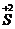 - восстановитель, так как элемент сера проявляет в данном соединении низшую степень окисления (-2).
- восстановитель, так как элемент сера проявляет в данном соединении низшую степень окисления (-2).
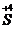 O2,
O2, 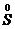 - окислитель и восстановитель, так как элемент сера проявляет в данном соединении промежуточную степень окисления
- окислитель и восстановитель, так как элемент сера проявляет в данном соединении промежуточную степень окисления
Важнейшие восстановители: HCl; HBr; NH3; H2S; MnSO4; из простых веществ – С, Н2, металлы.
Важнейшие окислители: H2SO4; HNO3; KMnO4; K2MnO4; HClO4; K2Cr2O7; K2CrO4 и др.; некоторые простые вещества O2; F2; Cl2; Br2; S
Метод электронного баланса
KMnO4 + KOH + Na2SO3 → K2MnO4 + Na2SO4 + H2O
- Как уравнять данную реакцию? Как называются реакции, в которых степень окисления элементов изменяется?
- Окислительно-восстановительные реакции.
Предлагается составить достаточно сложное уравнение ОВР методом электронного баланса.
Дата добавления: 2021-01-20; просмотров: 102; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
