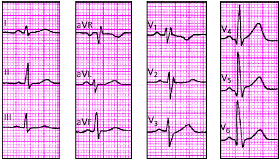
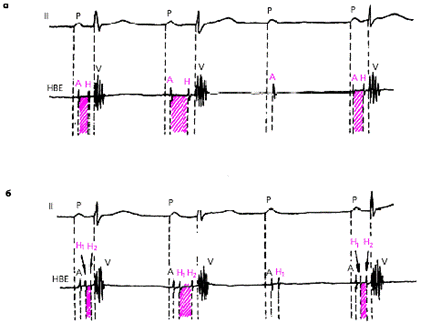
Чреспищеводная электрическая стимуляция сердца
Основные функции сердца
Сердце обладает рядом функций, определяющих особенности его работы: функцией автоматизма, проводимости, возбудимости и сократимости.
Функция автоматизма — это способность сердца вырабатывать электрические импульсы при отсутствии внешних раздражений. Функцией автоматизма обладают только клетки синоатриального узла (СА-узла) и проводящей системы предсердий и желудочков (пейсмекеры). Сократительный миокард лишен функции автоматизма.
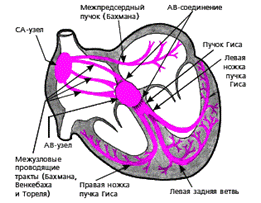
Различают три центра автоматизма (рис. 3.6):
1. Центр автоматизма первого порядка — это клетки СА-узла, вырабатывающие электрические импульсы с частотой около 60–80 в минуту.
2. Центры автоматизма второго порядка — клетки АВ-соединения (зоны перехода АВ-узла в пучок Гиса и нижние отделы предсердий), а также пучка Гиса, которые продуцируют импульсы с частотой 40–60 в минуту.
3. Центры автоматизма третьего порядка — конечная часть пучка Гиса, ножки и ветви пучка Гиса. Они обладают самой низкой функцией автоматизма, вырабатывая около 25–45 импульсов в минуту.
В норме единственным водителем ритма является СА-узел, который подавляет автоматическую активность остальных (эктопических) водителей ритма.
|
| Рис. 3.6. Проводящая система сердца. СА-узел - синоатриальный узел, АВ-узел - атриовентрикулярный узел |
Функция проводимости — это способность к проведению возбуждения волокон проводящей системы сердца и сократительного миокарда. В последнем случае скорость проведения электрического импульса значительно ниже. В предсердиях возбуждение распространяется от СА-узла по трем межузловым трактам (Бахмана, Венкебаха и Тореля) к АВ-узлу и по межпредсердному пучку Бахмана — на левое предсердие (рис. 3.6). Вначале возбуждается правое (рис. 3.7, а), затем правое и левое (рис. 3.7, б), в конце — только левое предсердие (рис. 3.7, в). Скорость проведения возбуждения 30–80 см . с–1, время охвата возбуждением обоих предсердий не превышает в норме 0,1 с.
|
|
|
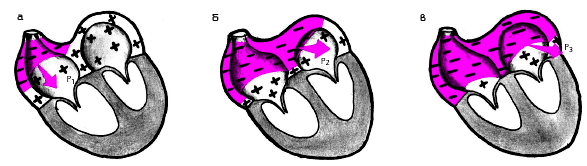
|
| Рис. 3.7. Распространение возбуждения по предсердиям а - начальное возбуждение правого предсердия, б - возбуждение правого и левого предсердий, в - конечное возбуждение левого предсердия. Р1, Р2 и Р3 - моментные векторы деполяризации |
В АВ-узле происходит физиологическая задержка возбуждения (скорость проведения снижается до 2–5 см.с–1). Задержка возбуждения в АВ-узле способствует тому, что желудочки начинают возбуждаться только после окончания полноценного сокращения предсердий. АВ-узел в норме «пропускает» из предсердий в желудочки не более 180–220 импульсов в мин. При большей частоте синусового или предсердного ритма даже у здорового человека развивается неполная атриовентрикулярная блокада проведения импульсов от предсердий к желудочкам. В норме АВ-задержка не превышает 0,1 с.
|
|
|
В желудочках возбуждение быстро рапространяется по пучку Гиса, его ветвям и волокнам Пуркинье (скорость проведения от 100–150 до 300–400 см . с–1). Волна деполяризации рапространяется от субэндокардиальных к субэпикардиальным участкам сердечной мышцы (рис. 3.8).
|
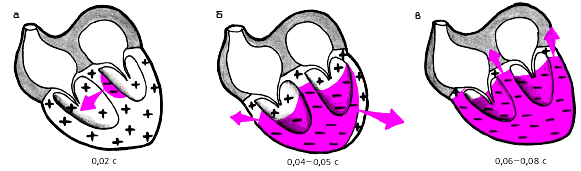
| Рис. 3.8. Распространение возбуждения по сократительному миокарду желудочков. а - деполяризация межжелудочковой перегородки (0,02 с), б - деполяризация верхушки, передней, задней и боковой стенок желудочков (0,04 - 0,05 с), в - деполяризация базальных отделов желудочков и межжелудочковой перегородки (0,06 - 0,08 с) |
В первые 0,02 с (рис. 3.8, а) деполяризуется левая половина межжелудочковой перегородки (МЖП), а также большая часть ПЖ. Через 0,04–0,05 с (рис. 3.8, б) возбуждаются значительная часть ЛЖ. Последними в период 0,06–0,08 с активируются базальные отделы ЛЖ, ПЖ и МЖП (рис. 3.8, в). При этом фронт волны возбуждения постоянно меняет свое направление, как это видно на рисунке. Общая продолжительность деполяризации желудочков составляет 0,08–0,09 с.
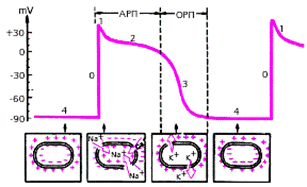
Функция возбудимости — это способность клеток проводящей системы сердца и сократительного миокарда возбуждаться под влиянием внешних электрических импульсов. Возбуждение сердечной мышцы сопровождается возникновением трансмембранного потенциала действия (ТМПД) — изменяющейся разности потенциалов между наружной и внутренней поверхностью клеточной мембраны. В исходном состоянии наружная поверхность невозбужденной миокардиальной клетки заряжена положительно, а внутренняя — отрицательно (рис. 3.9).
|
|
|
|
| Рис. 3.9. Трансмембранный потенциал действия (ТМПД). Объяснения в текте. АРП и ОРП - абсолютный и относительный рефрактерный периоды |
Различают несколько фаз ТМПД миокардиальной клетки:
Фаза 0 — во время которой происходит быстрая (в течение 0,01 с) перезарядка клеточной мембраны: внутренняя ее поверхность заряжается положительно, а наружная отрицательно.
Фаза 1 — небольшое начальное снижение ТМПД от +20 мV до 0 или чуть ниже (фаза начальной быстрой реполяризации).
Фаза 2 — относительно продолжительная (около 0,2 с) фаза плато, во время которой величина ТМПД поддерживается на одном уровне.
Фаза 3 (конечной быстрой реполяризации), в течение которой восстанавливается прежняя поляризация клеточной мембраны: наружная ее поверхность заряжается положительно, а внутренняя отрицательно (-90 мV).
|
|
|
Фаза 4 (фаза диастолы). Величина ТМПД сократительной клетки сохраняется примерно на уровне -90 мV. Происходит восстановление исходной концентрации К+, Na+, Ca2+ и Cl–, благодаря работе «Na+–К+-насоса».
В разные фазы ТМПД возбудимость мышечного волокна различна. В начале ТМПД (фаза 0, 1, 2) клетки полностью невозбудимы (абсолютный рефрактерный период). Во время быстрой конечной реполяризации (фаза 3) возбудимость частично восстанавливается (относительный рефрактерный период). Во время диастолы (фаза 4 ТМПД) рефрактерность отсутствует, и миокардиальное волокно полностью возбудимо (рис. 3.9).
Функция сократимости — это способность сердечной мышцы сокращаться в ответ на возбуждение. Этой функцией обладает, в основном, сократительный миокард. Процесс сокращения запускается ионами Ca2+, входящими в клетку во время ТМПД. Во время реполяризации мембраны происходит удаление ионов кальция из клетки в межклеточную жидкость, в результате чего наступает расслабление мышечного волокна. В результате последовательного сокращения и расслабления различных отделов сердца осуществляется основная — насосная функция сердца.
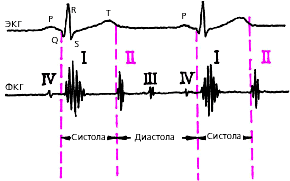
Фазовая структура сердечного цикла и деление его на систолу и диастолу желудочков представлена на рис. 3.10.
|
| Рис. 3.10. Деление сердечного цикла на систолу и диастолу |
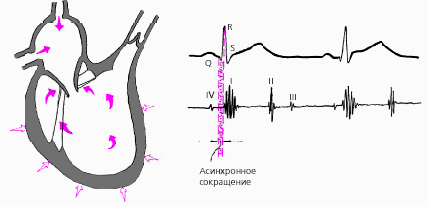
Систола желудочков начинается с фазы асинхронного сокращения, которая определяется от начала комплекса QRS на ЭКГ до первых высокочастотных осцилляций I тона сердца на фонокардиограмме (ФКГ) (рис. 3.11). В течение этой фазы электрическое возбуждение быстро распространяется по миокарду желудочков и инициирует сокращение отдельных мышечных волокон. Их сокращение происходит асинхронно, поэтому внутрижелудочковое давление не возрастает, хотя форма желудочков существенно меняется. В конце этой фазы атриовентрикулярные клапаны неплотно смыкаются, но их напряжения и, соответственно, колебательных движений еще не наблюдается.
|
| Рис. 3.11. Изменения внутрисердечной гемодинамики во время фазы асинхронного сокращения желудочков (заштриховано красным цветом). Римскими цифрами обозначены тоны сердца. Объяснения в тексте. |
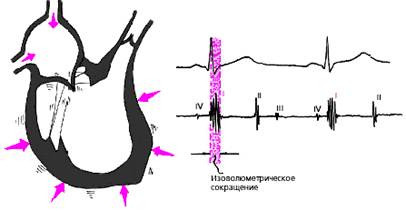
Фаза изоволюметрического сокращения (рис. 3.12) характеризуется быстрым и мощным сокращением миокарда желудочков, в результате чего в условиях полностью закрытых атриовентрикулярных и полулунных клапанов происходит резкое повышение внутрижелудочкового давления. Во время этой фазы возникает I тон сердца.
|
| Рис. 3.12. Изменения внутрисердечной гемодинамики во время фазы изоволюметрического сокращения желудочков. Объяснения в текте. |
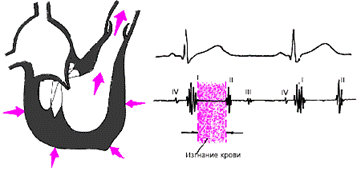
Как только давление в желудочках становится чуть больше, чем в аорте и легочной артерии, открываются полулунные клапаны, и кровь поступает в магистральные сосуды — начинается фаза изгнания (рис. 3.13).
|
| Рис. 3.13. Изменения внутрисердечной гемодинамики во время фазы изгнания. Объяснения в тексте. |
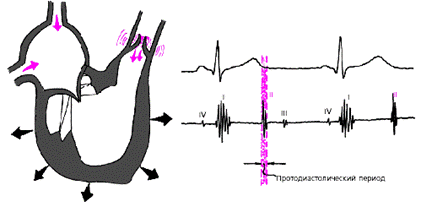
Диастола желудочков включает 5 фаз. Протодиастолический интервал (рис. 3.14) соответствует времени закрытия полулунных клапанов аорты и легочной артерии. В результате начавшегося расслабления миокарда желудочков давление в них падает чуть ниже давления в магистральных сосудах, что и является причиной закрытия клапанов. Во время этой фазы возникает II тон сердца.
|
| Рис. 3.14. Изменения внутрисердечной гемодинамики во время протодиастолического периода. Объяснения в тексте. |
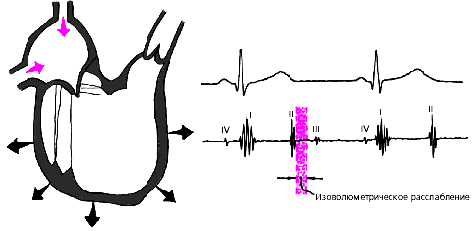
Во время фазы изоволюметрического расслабления (рис. 3.15) продолжается активное расслабление желудочков, давление в них падает до уровня давления в предсердиях, после чего открываются атриовентрикулярные клапаны. Фаза изоволюметрического расслабления в норме протекает в условиях герметически закрытых атриовентрикулярных и полулунных клапанов, и объем желудочков не меняется.
|
| Рис. 3.15. Изменения внутрисердечной гемодинамики во время изоволюметрического расслабления желудочков. Объяснения в тексте. |
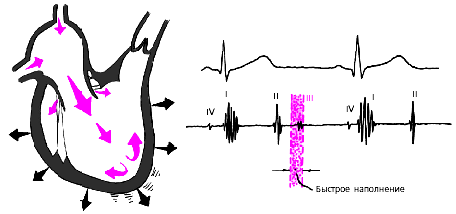
Далее начинается продолжительный период наполнения желудочков, включающий три диастолические фазы. Во время фазы быстрого наполнения (рис. 3.16) кровь «пассивно», под действием градиента давлений, поступает из предсердий в желудочки, причем в течение этой фазы происходит максимальное наполнение желудочков кровью. В конце этой фазы при определенных условиях (см. ниже) может возникнуть III дополнительный тон сердца.
|
| Рис. 3.16. Изменения внутрисердечной гемодинамики во время фазы быстрого наполнения желудочков. Объяснения в тексте. |
В дальнейшем давление в предсердиях и желудочках выравнивается, и наполнение последних замедляется. Это фаза медленного наполнения желудочков (рис. 3.17).
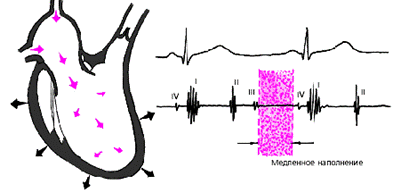
|
| Рис. 3.17. Изменения внутрисердечной гемодинамики во время фазы медленного наполнения желудочков. Объяснения в тексте. |
Последняя диастолическая фаза (фаза систолы предсердий) характеризуется сокращением миокарда предсердий и активным изгнанием крови из предсердий в желудочки (рис. 3.18). В конце этой фазы створки атриовентрикулярных клапанов «всплывают» и неплотно смыкаются — желудочек вновь готов к очередному сокращению. При определенных условиях (см. ниже) во время этой фазы может возникнуть IV дополнительный тон сердца.
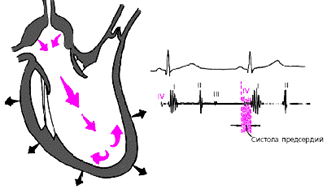
|
| Рис. 3.18. Изменения внутрисердечной гемодинамики во время систолы предсердий. Объяснения в тексте. |
Факторы, определяющие функцию сократимости . Важнейшей характеристикой функционирующей сердечной мышцы является зависимость между скоростью укорочения миокардиального волокна и развиваемым им напряжением (зависимость «силаскорость»). Согласно данным Hill, скорость сокращения мышцы обратно пропорциональна силе (напряжению). Иными словами, чем больше нагрузка на мышцу, тем меньше скорость ее укорочения. Наоборот, при уменьшении нагрузки скорость сокращения увеличивается (рис. 3.19).
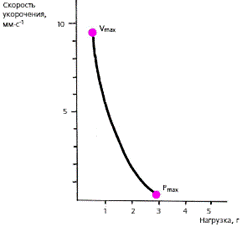
|
| Рис. 3.19. Кривая "сила-скорость", полученная на препарате изолированного миокарда (по E. Braunwald с соавт., 1976). Объяснения в тексте. |
Функция сердечной мышцы, в том числе зависимость «сила–скорость», определяется двумя основными факторами:
1. исходной длиной мышечного волокна или конечно-диастолическим объемом желудочка;
2. состоянием инотропизма (сократимостью) миокарда, связанного с интенсивностью обменных процессов в сердечной мышце.
Зависимость силы сокращения от исходной длины мышечного волокна является решающим фактором, который определяет функцию сердечной мышцы (E. Braunwald с соавт.). Согласно закону Старлинга, увеличение исходного конечно-диастолического объема желудочка в норме приводит к усилению сокращения желудочка, который становится способным развивать большее напряжение и преодолевать большую нагрузку (рис. 3.20).

|
| Рис. 3.20. Зависимость силы сокращения от исходной длины мышечного волокна (конечно-диастолического объема) в контроле и при изменении инотропизма (по E. Braunwald с соавт., 1976). Объяснения в тексте. |
Существенно изменяется при этом и зависимость «сила-скорость» (рис. 3.21, а): увеличение исходной длины мышечного волокна сопровождается возрастанием максимально развиваемой силы сокращения, тогда как максимальная скорость сокращения не меняется.
Увеличение инотропизма сердечной мышцы, происходящее под действием возросшей симпатической активности или других факторов (см. ниже), ведет к увеличению как силы, так и максимальной скорости сокращения (рис. 3.21, б). Таким образом, инотропное состояние (сократимость) миокарда характеризуется способностью желудочка без увеличения конечно-диастолического объема (т. е. без «привлечения» механизма Франка-Старлинга) либо выбрасывать в сосудистое русло больший объем крови, либо выбрасывать тот же объем крови против большего сопротивления (давления) в магистральных сосудах. На рис. 3.20 видно, что при увеличении инотропизма (сократимости) кривая функции желудочка (т. е. взаимосвязи напряжения и конечно-диастолического объема) смещается вверх и влево. Это означает, что при тех же значениях конечно-диастолического объема желудочки в состоянии развивать большее напряжение. При угнетении инотропной функции (снижение сократимости) кривая функции желудочка смещается вправо и вниз. Причем при выраженном падении сократимости кривая идет вначале горизонтально, а затем опускается вниз. Иными словами, при данном состоянии инотропной функции растяжение сердечной мышцы (увеличение конечно-диастолического объема) сопровождается не увеличением, а снижением напряжения миокарда.
Следует еще раз обратить внимание, что состояние инотропизма оказывает влияние и на зависимость «сила-скорость» (рис. 3.21, б): при увеличении инотропизма возрастает не только сила, но и максимальная скорость сокращения, а при снижении сократимости сила и максимальная скорость уменьшается.
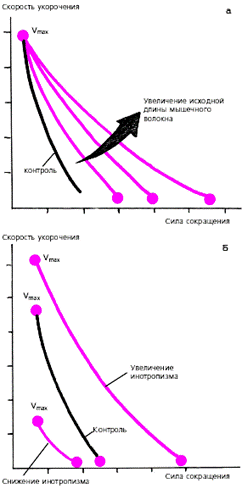
|
| Рис. 3.21. Изменения кривой "сила-скорость" (а) при увеличении исходной длины мышечного волокна и (б) изменении инотропизма (по E. Braunwald с соавт., 1976). Объяснения в тексте. |
Ниже подробно обсуждаются основные факторы, оказывающие влияние на конечно-диастолический объем желудочков, состояние их инотропной функции и величину постнагрузки.
Регуляция функций сердца
Сердце обладает хорошо развитой многоступенчатой системой регуляции, приспосабливающей его деятельность к постоянно меняющимся условиям функционирования системы кровообращения и потребностям организма.
Внутрисердечная регуляция сердца осуществляется в первую очередь за счет деятельности так называемой метасимпатической нервной системы, нейроны которой располагаются в многочисленных интрамуральных ганглиях сердца. В ответ на раздражение рецепторов, расположенных в самом сердце (например механорецепторов растяжения предсердий и желудочков), метасимпатическая нервная система рефлекторно регулирует силу и скорость сокращения миокарда, скорость его расслабления, ЧСС, скорость атриовентрикулярного проведения и другие параметры сердечной деятельности. Важно, что эти приспособительные реакции осуществляются независимо от функционирования центральных регуляторных механизмов, в том числе от изменений симпатических и парасимпатических влияний на сердце.
Большое значение имеют также внутриклеточные механизмы регуляции, обеспечивающие, например, функционирование известного механизма Франка-Старлинга (увеличение силы сокращения в ответ на растяжение миофибрилл при увеличении кровенаполнения сердца) или компенсаторное удлинение систолы в ответ на усиление работы сердца.
Внесердечная (центральная) регуляция осуществляется благодаря хорошо развитой двойной (симпатической и парасимпатической) иннервации сердца, схематически представленной на рис. 3.22.

|
| Рис. 3.22. Нервно-гуморальная регуляция сердца (по А.В. Коробкову и С.А. Чесноковой, 1986). Ах - ацетилхолин, На - норадреналин |
При возбуждении симпатических нервов, сопровождающемся выделением норадреналина, увеличиваются ЧСС (положительный хронотропный эффект), сила и скорость сокращения предсердий и желудочков (положительный инотропный эффект), скорость расслабления миокарда, ускоряется проведение электрического импульса в атриовентрикулярном узле (положительный дромотропный эффект), увеличивается возбудимость сердечной мышцы (батмотропный эффект).
Возбуждение ствола блуждающего нерва сопровождается освобождением ацетилхолина, происходит урежение сердечных сокращений (отрицательный хронотропный эффект), замедление проводимости по атриовентрикулярному узлу вплоть до полной блокады проведения (отрицательный дромотропный эффект), уменьшение силы и скорости сокращения (отрицательный инотропный эффект).
Следует помнить также, что симпатические и парасимпатические влияния на сердце регулируются сердечными центрами продолговатого мозга и моста, корой головного мозга и гипоталамусом.
| 3.1.2. Сосудистая система |

|
|
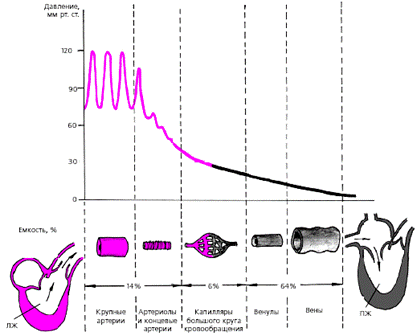
| Рис. 3.23. Уровень давления (вверху) и распределения крови (внизу) в различных отделах сосудистого русла большого круга кровообращения |
 Запомните
Способность артериол существенно менять свой просвет является главным механизмом, регулирующим объемную скорость кровотока в различных сосудистых областях и распределение крови по разным органам. Запомните
Способность артериол существенно менять свой просвет является главным механизмом, регулирующим объемную скорость кровотока в различных сосудистых областях и распределение крови по разным органам.
|
Уровень АД в концевых артериях и артериолах снижается примерно в 1,5–2 раза по сравнению с давлением в аорте, а пульсирующий кровоток постепенно сменяется непрерывным.
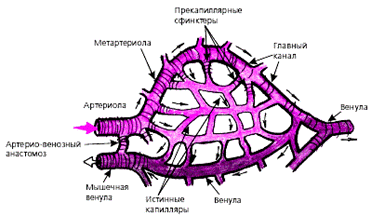
В капиллярах, объем которых составляет около 6% объема крови, ток крови равномерный в разные фазы сердечного цикла. Истинные капиляры, т. е. сосуды, стенки которых содержат лишь один слой клеток эндотелия, лишены гладкомышечных элементов. В большинстве случаев они под прямым углом отходят от так называемых метартериол («основных каналов»), которые переходят в венулы (рис. 3.24). В области отхождения капилляров от метартериол имеются прекапиллярные сфинктеры. Именно от их сокращения или расслабления зависит, какая часть крови проходит через истинные капилляры, а какая часть по метартериолам попадает непосредственно в венулы, минуя истинные капилляры. Общий же объем кровотока через метартериолы и капилляры определяется соотношением прекапиллярного и посткапиллярного сопротивления артериол и венул.
|
| Рис. 3.24. Схема микроциркуляторного сосудистого русла. Объяснения в тексте. |
Емкостные сосуды (венулы и вены ) отличаются низким кровяным давлением. Они являются важнейшими депо крови в организме: даже в нормальных физиологических условиях в них сосредоточено до 64% крови. При патологии емкость венул и вен может увеличиваться еще больше.
Гемодинамика
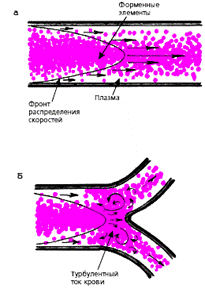
Движение крови по сосудам подчиняется законам гемодинамики. Движущей силой кровотока является градиент давления между артериальной и венозной областями сосудистой системы. У взрослого здорового человека кровоток в сосудах носит, главным образом, ламинарный характер, причем центральный осевой поток крови, состоящий в основном из форменных элементов, имеет максимальную скорость, а периферические слои, непосредственно прилежащие к стенке сосуда и состоящие из плазмы, — минимальную скорость (рис. 3.25, а). Турбулентный ток крови в норме возникает в местах разветвлений и естественных сужений, а также изгибов аорты и крупных артерий (рис. 3.25, б).
|
| Рис. 3.25. Распределение скоростей потока крови в поперечном сечении крупного артериального сосуда. Стрелками обозначены векторы скоростей. |
Средняя скорость кровотока в различных сосудистых областях зависит от градиента давлений в начале и в конце сосуда и величины сосудистого сопротивления, которое, в свою очередь, определяется вязкостью крови и поперечным сечением сосуда. Чем больше градиент давлений и/или чем меньше вязкость крови и суммарное поперечное сечение сосудов данной области, тем выше линейная скорость кровотока. В аорте она максимальна (50–70 см х с–1), в артериях и артериолах, поперечный просвет и сосудистое сопротивление которых во много раз больше, средняя линейная скорость падает (20–40 см х с–1 в аорте и около 0,5 см х с–1 — в артериолах). Наибольшей суммарной площадью просвета обладают капилляры. Здесь скорость движения крови не превышает 0,05 см х с–1.
Общее время прохождения «частиц» крови по большому и малому кругу кровообращения в норме составляет примерно 23 с.
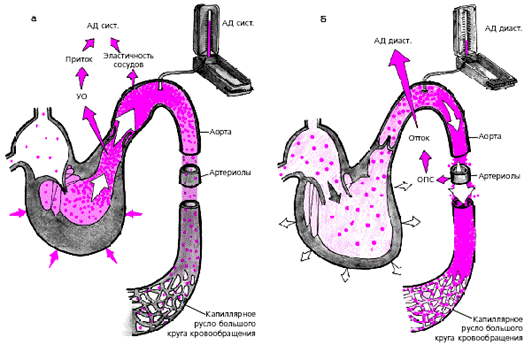
Артериальное давление (АД) является важнейшим интегральным показателем функционирующей системы кровообращения. Оно зависит от действия множества гемодинамических факторов: величины сердечного выброса, числа сердечных сокращений (ЧСС), объема циркулирующей крови, суммарного сопротивления резистивных сосудов, объема емкостных сосудов, вязкости крови и других. Систолическое АД (рис. 3.26, а) преимущественно определяется величиной сердечного выброса и эластичностью аорты, а диастолическое АД — величиной общего периферического сопротивления, т. е. в основном уровнем сосудистого артериолярного тонуса (рис. 3.26, б) и ЧСС.
|
| Рис. 3.26. Основные гемодинамические факторы, определяющие уровень систолического (а) и диастолического артериального давления. УО - ударный объем, ОПС - общее периферическое сопротивление. |
Регуляция кровообращения
Изменения центральной и региональной гемодинамики, постоянно происходящие в организме под действием разнообразных внешних и внутренних факторов, осуществляются за счет изменений минутного объема (сердечный выброс и ЧСС) и сосудистого сопротивления (просвет кровеносных сосудов, преимущественно артериол).
Местные (периферические) механизмы саморегуляции сосудистого тонуса обеспечивают адекватный кровоток в органах в зависимости от уровня метаболизма в них. В интенсивно работающем органе под действием продуктов метаболизма (ионов H+, аденозина, АТФ, АДФ, АМФ, СО2, молочной кислоты и др.) и биологически активных веществ (кинины, простагландины, гистамин и др.) происходит снижение тонуса артериол и прекапиллярных сфинктеров, и, таким образом, увеличивается число функционирующих капилляров.
Периферические механизмы саморегуляции позволяют поддерживать необходимую объемную скорость кровотока в жизненно важных органах (головной мозг, сердце, почки) даже при резком изменении системного АД — его падении или повышении.
 Запомните
Резкое повышение системного АД, как правило, сопровождается сокращением гладкой мускулатуры артериол жизненно важных органов (эффект Бейлиса). В результате объемная скорость кровотока в этих органах не изменяется или возрастает незначительно. Наоборот, при падении системного АД гладкие мышцы сосудов расслабляются, что позволяет поддерживать должную объемную скорость регионального кровотока. Запомните
Резкое повышение системного АД, как правило, сопровождается сокращением гладкой мускулатуры артериол жизненно важных органов (эффект Бейлиса). В результате объемная скорость кровотока в этих органах не изменяется или возрастает незначительно. Наоборот, при падении системного АД гладкие мышцы сосудов расслабляются, что позволяет поддерживать должную объемную скорость регионального кровотока.
|
Центральные механизмы регуляции сосудистого тонуса включают в себя афферентное (сенсорное), центральное и эфферентное звенья.
Афферентное звено представлено многочисленными баро- и хеморецепторами, расположенными в нескольких рефлексогенных зонах сосудистой системы (аорта, синокаротидная зона, сосуды легких и др.) (рис. 3.27). Барорецепторы реагируют на степень и скорость растяжения стенки сосудов (или полостей сердца). При повышении АД или наполнения камер сердца барорецепторы отвечают усилением афферентной импульсации, при снижении АД — ее уменьшением. Хеморецепторы дуги аорты, синокаротидной зоны и других рефлексогенных зон (сердце, почки, органы пищеварения) аналогично реагируют на изменение в крови концентрации О2, СО 2, ионов Н+ и других. Чувствительные волокна от баро- и хеморецепторов дуги аорты и каротидного синуса проходят в составе синокаротидного нерва, ветвей языкоглоточного нерва и депрессивного нерва (рис. 3.27).
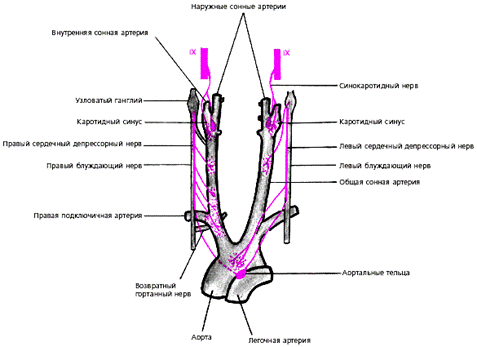
|
| Рис. 3.27. Баро- и хеморецепторы аорты и каротидного синуса. IX - девятая пара черепномозговых нервов. |
Центральным звеном регуляции сосудистого тонуса является вазомоторный центр, представленный различными функционально связанными между собой нервными структурами, расположенными в продолговатом, спинном мозге, гипоталамусе, коре больших полушарий.
Эфферентное звено включает нервные и гуморальные механизмы регуляции сосудистого тонуса. В зависимости от скорости развития циркуляторных эффектов различают: 1) механизмы быстрого кратковременного действия; 2) механизмы промежуточного действия; 3) механизмы длительного действия.
К механизмам быстрого кратковременного действия относятся нервные рефлекторные реакции, возникающие при раздражении баро- и хеморецепторов описанных рефлексогенных зон, а также при ишемии ЦНС. Эти реакции развиваются в течение нескольких секунд и реализуются через рефлекторные изменения активности симпатической и парасимпатической нервных систем, а также через изменение концентрации гуморальных веществ — адреналина и норадреналина. Раздражение барорецепторов аорты и каротидного синуса (например при повышении АД или механическом воздействии на эти зоны) закономерно приводит к снижению симпатических (вазоконстрикторных) и усилению парасимпатических (депрессорных) влияний. В результате снижается сосудистый тонус, а также частота и сила сокращения сердца, что способствует нормализации АД. Наоборот, при падении АД (например при кровопотере) импульсация с барорецепторов уменьшается и начинают преобладать симпатические влияния — увеличение ЧСС, сердечного выброса и сосудистого тонуса.
Аналогичным образом возникает ответ на раздражение В-рецепторов растяжения предсердий и рецепторов растяжения желудочков, например при быстром увеличении их наполнения. В результате снижения тонуса симпатических и повышения активности парасимпатических нервов развивается брадикардия и вазодилатация.
Возбуждение хеморецепторов дуги аорты и каротидного синуса при снижении напряжения О2, повышении напряжения СО2 или увеличении концентрации ионов Н+ в крови приводит к сужению резистивных сосудов и подъему АД. К такому же эффекту приводит рефлекторная реакция на ишемию ЦНС, например при недостаточном кровоснабжении головного мозга, гипоксемии или резком падении АД. Повышение концентрации Н+ и СО2 сопровождается раздражением хеморецепторов ствола мозга и значительным подъемом АД.
Влияние адреналина и норадреналина на тонус различных сосудистых областей зависит от концентрации этих веществ в крови и от соотношения в разных сосудах α- и β-адренорецепторов (рис. 3.28). Как известно, возбуждение α-рецепторов сопровождается сокращением гладких мышц, а возбуждение β-рецепторов — их расслаблением.

|
| Рис. 3.28. Влияние норадреналина (На) и адреналина (А) на альфа- и бета-рецепторы сосудов и различные циркуляторные эффекты. Объяснения в тексте. |
Норадреналин воздействует преимущественно на α-адренорецепторы, вызывая в экстремальных условиях увеличение сосудистого тонуса, системного периферического сопротивления и АД.
Адреналин взаимодействует как с α-, так и с β-адренорецепторами. В физиологических концентрациях он возбуждает преимущественно β-рецепторы, вызывая расслабление гладкой мускулатуры сосудов, особенно тех из них, в которых преобладают β-адренорецепторы (скелетные мышцы, мозг, сердце). Одновременно адреналин повышает УО и ЧСС, в результате чего в обычных физиологических условиях (в покое, при умеренной физической нагрузке, эмоциональном возбуждении) уровень системного АД под действием адреналина существенно не меняется. В этих условиях главный циркуляторный эффект адреналина заключается в перераспределении сердечного выброса и обеспечении интенсивного кровотока в скелетных мышцах, мозге и сердце.
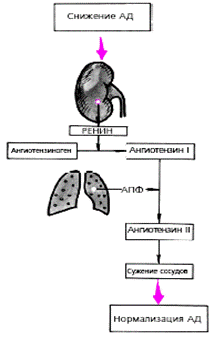
|
| Рис. 3.29. Схема активации ренин-ангиотензиновой системы при снижении артериального давления. АПФ - ангиотензинпревращающий фермент |
В экстремальных ситуациях (сильный эмоциональный стресс, острое кровотечение и т. п.), когда концентрация адреналина в крови повышается в десятки раз, может проявляться его взаимодействие с α-адренорецепторами сосудов, при этом преобладают сосудосуживающие реакции (особенно в коже, органах пищеварения и легких, в которых имеется большое количество α-рецепторов).
Главным регуляторным механизмом промежуточного действия является ренин-ангиотензиновая система. Ее активация, наступающая при снижении кровоснабжения почек любого генеза (падение АД, сужение почечных сосудов и т. п.), сопровождается выделением ренина, который способствует превращению ангиотензиногена в ангиотензин I (рис. 3.29). Последний под действием АПФ превращается в ангиотензин II, обладающий мощным вазоконстрикторным действием. Кроме того, ангиотензин II возбуждает центральные и периферические симпатические структуры. Все это приводит к росту периферического сопротивления и повышению (нормализации) АД.
К регуляторным механизмам длительного действия относят почечные системы контроля за объемом жидкости, системы альдостерона и вазопрессина, механизмы действия которых разбираются в главе 6.
| 3.2. Электрокардиография |

|
| 3.2.1. Методика регистрации электрокардиограммы |

|
|
| Рис. 3.30. Портативный шестиканальный электрокардиограф |
Изменения разности потенциалов на поверхности тела, возникающие во время работы сердца, фиксируют с помощью различных систем отведений ЭКГ. Каждое отведение регистрирует разность потенциалов, существующую между двумя определенными точками электрического поля сердца, в которых установлены электроды. Последние подключаются к гальванометру электрокардиографа: один из электродов присоединяют к положительному полюсу гальванометра (это положительный, или активный, электрод отведения), второй электрод — к его отрицательному полюсу (отрицательный, или индифферентный, электрод отведения).
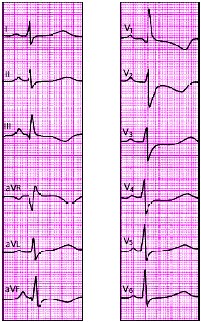
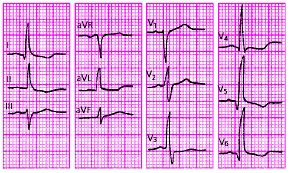
В настоящее время в клинической практике наиболее широко используют 12 отведений ЭКГ, запись которых является обязательной при каждом электрокардиографическом обследовании больного: 3 стандартных отведения, 3 усиленных однополюсных отведения от конечностей и 6 грудных отведений.
Стандартные отведения
Стандартные двухполюсные отведения, предложенные в 1913 г. Эйнтховеном, фиксируют разность потенциалов между двумя точками электрического поля, удаленными от сердца и расположенными во фронтальной плоскости — на конечностях. Для записи этих отведений электроды накладывают на правой руке (красная маркировка), левой руке (желтая маркировка) и на левой ноге (зеленая маркировка) (рис. 3.31). Эти электроды попарно подключаются к электрокардиографу для регистрации каждого из трех стандартных отведений. Четвертый электрод устанавливается на правую ногу для подключения заземляющего провода (черная маркировка).
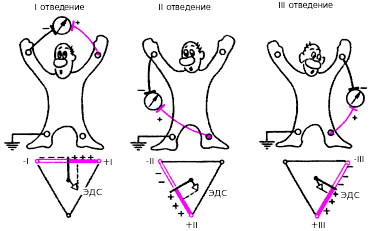
|
| Рис. 3.31. Схема формирования трех стандартных электрокардиографических отведений от конечностей. Внизу - треугольник Эйнтховена, каждая сторона которого является осью того или иного стандартного отведения |
Стандартные отведения от конечностей регистрируют при следующем попарном подключении электродов:
I отведение — левая рука (+) и правая рука (–);
II отведение — левая нога (+) и правая рука (–);
III отведение — левая нога (+) и левая рука (–).
Знаками (+) и (—) здесь обозначено соответствующее подключение электродов к положительному или отрицательному полюсам гальванометра, т. е. указаны положительный и отрицательный полюс каждого отведения.
Как видно на рис. 3.31, три стандартных отведения образуют равносторонний треугольник (треугольник Эйнтховена), вершинами которого являются правая рука, левая рука и левая нога с установленными там электродами. В центре равностороннего треугольника Эйнтховена расположен электрический центр сердца, или точечный единый сердечный диполь, одинаково удаленный от всех трех стандартных отведений. Гипотетическая линия, соединяющая два электрода, участвующих в образовании электрокардиографического отведения, называется осью отведения. Осями стандартных отведений являются стороны треугольника Эйнтховена. Перпендикуляры, проведенные из центра сердца, т. е. из места расположения единого сердечного диполя, к оси каждого стандартного отведения, делят каждую ось на две равные части: положительную, обращенную в сторону положительного (активного) электрода (+) отведения, и отрицательную, обращенную к отрицательному электроду (–).
Усиленные отведения от конечностей
Усиленные отведения от конечностей были предложены Гольдбергером в 1942 г. Они регистрируют разность потенциалов между одной из конечностей, на которой установлен активный положительный электрод данного отведения (правая рука, левая рука или левая нога), и средним потенциалом двух других конечностей (рис. 3.32).
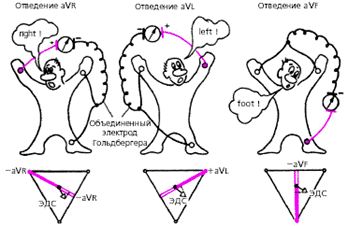
|
| Рис. 3.32. Схема формирования трех усиленных однополюсных отведений от конечностей. Внизу - треугольник Эйнтховена и расположение осей трех усиленных однополюсных отведений от конечностей |
Таким образом, в качестве отрицательного электрода в этих отведениях используют так называемый объединенный электрод Гольдбергера, который образуется при соединении через дополнительное сопротивление двух конечностей. Три усиленных однополюсных отведения от конечностей обозначают следующим образом:
aVR — усиленное отведение от правой руки;
aVL — усиленное отведение от левой руки;
aVF — усиленное отведение от левой ноги.
Обозначение усиленных отведений от конечностей происходит от первых букв английских слов: «a» — augemented (усиленный); «V» — voltage (потенциал); «R» — right (правый); «L» — left (левый); «F» — foot (нога).
Как видно на рис. 3.32, оси усиленных однополюсных отведений от конечностей получают, соединяя электрический центр сердца с местом наложения активного электрода данного отведения, т. е. фактически — с одной из вершин треугольника Эйнтховена. Электрический центр сердца как бы делит оси этих отведений на две равные части: положительную, обращенную к активному электроду, и отрицательную, обращенную к объединенному электроду Гольдбергера.
Шестиосевая система координат
(по Bayley)
Стандартные и усиленные однополюсные отведения от конечностей дают возможность зарегистрировать изменения ЭДС сердца во фронтальной плоскости, т. е. в плоскости, в которой расположен треугольник Эйнтховена. Для более точного и наглядного определения различных отклонений ЭДС сердца в этой фронтальной плоскости была предложена так называемая шестиосевая система координат (Bayley, 1943). Она получается при совмещении осей трех стандартных и трех усиленных отведений от конечностей, проведенных через электрический центр сердца. Последний делит ось каждого отведения на положительную и отрицательную части, обращенные, соответственно, к активному (положительному) или к отрицательному электроду (рис. 3.33).

|
| Рис. 3.33. Шестиосевая система координат по Bayley. Объяснения в тексте. |
Электрокардиографические отклонения в разных отведениях от конечностей можно рассматривать как различные проекции одной и той же ЭДС сердца на оси данных отведений. Поэтому, сопоставляя амплитуду и полярность электрокардиографических комплексов в различных отведениях, входящих в состав шестиосевой системы координат, можно достаточно точно определять величину и направление вектора ЭДС сердца во фронтальной плоскости.
Направление осей отведений принято определять в градусах. За начало отсчета (0 ) условно принимается радиус, проведенный строго горизонтально из электрического центра сердца влево по направлению к положительному полюсу I стандартного отведения. Положительный полюс II стандартного отведения расположен под углом +60°, отведения aVF — под углом +90°, III стандартного отведения — под углом +120°, aVL — под углом –30°, а aVR — под углом –150° к горизонтали. Ось отведения aVL перпендикулярна оси II стандартного отведения, ось I стандартного отведения перпендикулярна оси aVF, а ось aVR перпендикулярна оси III стандартного отведения.
Грудные отведения
Грудные однополюсные отведения, предложенные Wilson в 1934 г., регистрируют разность потенциалов между активным положительным электродом, установленным в определенных точках на поверхности грудной клетки (рис. 3.34), и отрицательным объединенным электродом Вильсона. Последний образуется при соединении через дополнительные сопротивления трех конечностей (правой руки, левой руки и левой ноги), объединенный потенциал которых близок к нулю (около 0,2 mV).
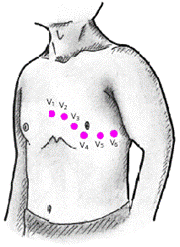
|
| Рис. 3.34. Места наложения 6 грудных электродов |
Обычно для записи ЭКГ используют 6 общепринятых позиций активных электродов на грудной клетке:
· отведение V1 — в IV межреберье по правому краю грудины;
· отведение V2 — в IV межреберье по левому краю грудины;
· отведение V3 — между второй и четвертой позицией (см. ниже), примерно на уровне V ребра по левой парастернальной линии;
· отведение V4 — в V межреберье по левой срединно-ключичной линии.
· отведение V5 — на том же горизонтальном уровне, что и V4, по левой передней подмышечной линии;
· отведение V6 — по левой средней подмышечной линии на том же горизонтальном уровне, что и электроды отведений V4 и V5.
В отличие от стандартных и усиленных отведений от конечностей, грудные отведения регистрируют изменения ЭДС сердца преимущественно в горизонтальной плоскости. Как показано на рис. 3.35, ось каждого грудного отведения образована линией, соединяющей электрический центр сердца с местом расположения активного электрода на грудной клетке. На рисунке видно, что оси отведений V1 и V5, а также V2 и V6 оказываются приблизительно перпендикулярными друг другу.

|
| Рис. 3.35. Расположения осей 6 грудных электрокардиографических отведений в горизонтальной плоскости |
Дополнительные отведения
Диагностические возможности электрокардиографического исследования могут быть расширены при применении некоторых дополнительных отведений. Их использование особенно целесообразно в тех случаях, когда обычная программа регистрации 12 общепринятых отведений ЭКГ не позволяет достаточно надежно диагностировать ту или иную электрокардиографическую патологию или требует уточнения некоторых количественных параметров выявленных изменений.
Методика регистрации дополнительных грудных отведений отличается от методики записи 6 общепринятых грудных отведений лишь локализацией активного электрода на поверхности грудной клетки. В качестве электрода, соединенного с отрицательным полюсом кардиографа, используют объединенный электрод Вильсона.
Однополюсные отведения V7–V9 используют для более точной диагностики очаговых изменений миокарда в задне-базальных отделах ЛЖ. Активные электроды устанавливают по задней подмышечной (V7), лопаточной (V8) и паравертебральной (V9) линиям на уровне горизонтали, на которой расположены электроды V4–V6 (рис. 3.36).
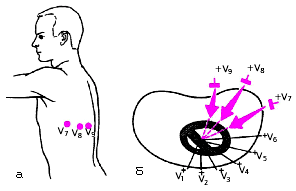
|
| Рис. 3.36. Расположение электродов дополнительных грудных отведений V7 - V9 (а) и осей этих отведений в горизонтальной плоскости (б) |
Двухполюсные отведения по Нэбу. Для записи этих отведений применяют электроды, используемые для регистрации трех стандартных отведений от конечностей. Электрод, обычно устанавливаемый на правой руке (красная маркировка провода), помещают во второе межреберье по правому краю грудины; электрод с левой ноги (зеленая маркировка) переставляют в позицию грудного отведения V4 (у верхушки сердца), а электрод, располагающийся на левой руке (желтая маркировка), помещают на том же горизонтальном уровне, что и зеленый электрод, но по задней подмышечной линии (рис. 3.37). Если переключатель отведений электрокардиографа находится в положении I стандартного отведения, регистрируют отведение «Dorsalis» (D). Перемещая переключатель на II и III стандартные отведения, записывают, соответственно, отведения «Anterior» (A) и «Inferior» (I). Отведения по Нэбу применяются для диагностики очаговых изменений миокарда задней стенки (отведение D), переднебоковой стенки (отведение А) и нижних отделов передней стенки (отведение I).

|
| Рис. 3.37. Расположение электродов и осей дополнительных грудных отведений по Нэбу |
Отведения V3R–V6R, активные электроды которых помещают на правой половине грудной клетки (рис. 3.38), используют для диагностики гипертрофии правых отделов сердца и очаговых изменений ПЖ.

|
| Рис. 3.38. Расположение электродов дополнительных грудных отведений V3R - V6R |
Техника регистрации электрокардиограммы
Для получения качественной записи ЭКГ необходимо строго придерживаться некоторых общих правил ее регистрации.
Условия проведения исследования. ЭКГ регистрируют в специальном помещении, удаленном от возможных источников электрических помех: физиотерапевтических и рентгеновских кабинетов, электромоторов, распределительных электрощитов и т. д. Кушетка должна находиться на расстоянии не менее 1,5–2 м от проводов электросети. Целесообразно экранировать кушетку, подложив под пациента одеяло со вшитой металлической сеткой, которая должна быть заземлена.
Исследование проводится после 10–15-минутного отдыха и не ранее, чем через 2 ч после приема пищи. Запись ЭКГ проводится обычно в положении больного лежа на спине, что позволяет добиться максимального расслабления мышц (рис. 3.39). Предварительно фиксируют фамилию, имя и отчество пациента, его возраст, дату и время исследования, номер истории болезни и диагноз.
|
| Рис. 3.39. Регистрация ЭКГ в 12 отведениях на многоканальном электрокардиографе |
Наложение электродов. На внутреннюю поверхность голеней и предплечий в нижней их трети с помощью резиновых лент или специальных пластмассовых зажимов накладывают 4 пластинчатых электрода (рис. 3.40, а), а на грудь устанавливают один или несколько (при многоканальной записи) грудных электродов, используя резиновую грушу-присоску или приклеивающиеся одноразовые грудные электроды (рис. 3.40, б). Для улучшения контакта электродов с кожей и уменьшения помех и наводных токов в местах наложения электродов необходимо предварительно обезжирить кожу спиртом и покрыть электроды слоем специальной токопроводящей пасты, которая позволяет максимально снизить межэлектродное сопротивление.

|
| Рис. 3.40. Наложение электродов на конечности (а) и грудь пациента (б) во время регистрации ЭКГ в 12 отведениях |
При наложении электродов не следует применять марлевые прокладки между электродом и кожей, смоченные раствором 5–10% раствора хлорида натрия, которые обычно в процессе исследования быстро высыхают, что резко увеличивает электрическое сопротивление кожи и возможность появления помех при регистрации ЭКГ.
Подключение проводов к электродам. К каждому электроду, установленному на конечностях или на поверхности грудной клетки, присоединяют провод, идущий от электрокардиографа и маркированный определенным цветом. Общепринятой является следующая маркировка входных проводов: правая рука — красный цвет; левая рука — желтый цвет; левая нога — зеленый цвет; правая нога (заземление пациента) — черный цвет; грудной электрод — белый цвет.
При наличии 6-канального электрокардиографа, позволяющего одновременно регистрировать ЭКГ в 6 грудных отведениях, к электроду V1 подключают провод, имеющий красную маркировку наконечника; к электроду V2 — желтую, V3 — зеленую, V4 — коричневую, V5 — черную и V6 — синюю или фиолетовую. Маркировка остальных проводов та же, что и в одноканальных электрокардиографах.
Выбор усиления электрокардиографа. Прежде чем начинать запись ЭКГ, на всех каналах электрокардиографа необходимо установить одинаковое усиление электрического сигнала. Для этого в каждом электрокардиографе предусмотрена возможность подачи на гальванометр стандартного калибровочного напряжения, равного 1 mV (рис. 3.41).
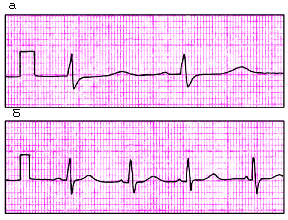
|
| Рис. 3.41. ЭКГ, зарегистрированная со скоростью 50 мм/с (а) и 25 мм/с (б). В начале каждой записи ЭКГ показан контрольный милливольт |
Обычно усиление каждого канала подбирается таким образом, чтобы напряжение 1 mV вызывало отклонение гальванометра и регистрирующей системы, равное 10 мм. Для этого в положении переключателя отведений «0» регулируют усиление электрокардиографа и регистрируют калибровочный милливольт. При необходимости можно изменить усиление: уменьшить при слишком большой амплитуде зубцов ЭКГ (1 mV = 5 мм) или увеличить при малой их амплитуде (1 mV = 15 или 20 мм).
В современных электрокардиографах предусмотрена автоматическая калибровка усиления.
Запись электрокардиограммы. Запись ЭКГ осуществляют при спокойном дыхании. Вначале записывают ЭКГ в стандартных отведениях (I, II, III), затем в усиленных отведениях от конечностей (aVR, aVL и aVF) и грудных отведениях (V1–V6). В каждом отведении записывают не менее 4 сердечных циклов. ЭКГ регистрируют, как правило, при скорости движения бумаги 50 мм /с. Меньшую скорость (25 мм /с) используют при необходимости более длительной записи ЭКГ, например для диагностики нарушений ритма.
| 3.2.2. Анализ электрокардиограммы |

|

|
| Рис. 3.42. Оценка регулярности сердечного ритма и частоты сердечных сокращений. а - правильный ритм, б, в - неправильные ритмы |
Число сердечных сокращений (ЧСС) При правильном ритме ЧСС определяют по таблицам
(см. табл. 3.1) или подсчитывают по формуле: ЧСС = 60/R - R.
Таблица 3.1
Число сердечных сокращений (ЧСС) в зависимости от длительности интервала R–R
| Длительность интервала R-R, с | ЧСС в мин | Длительность интервала R-R, с | ЧСС в мин |
| 1,50 | 40 | 0,85 | 70 |
| 1,40 | 43 | 0,80 | 75 |
| 1,30 | 46 | 0,75 | 80 |
| 1,25 | 48 | 0,70 | 86 |
| 1,20 | 50 | 0,65 | 82 |
| 1,15 | 52 | 0,60 | 100 |
| 1,10 | 54 | 0,55 | 109 |
| 1,05 | 57 | 0,50 | 120 |
| 1,00 | 60 | 0,45 | 133 |
| 0,95 | 63 | 0,40 | 150 |
| 0,90 | 66 | 0,35 | 172 |
При неправильном ритме подсчитывают число комплексов QRS, зарегистрированных за какой-то определенный отрезок времени (например за 3 с). Умножая этот результат в данном случае на 20 (60 с : 3 с = 20), подсчитывают ЧСС. При неправильном ритме можно ограничиться также определением минимального и максимального ЧСС. Минимальное ЧСС определяется по продолжительности наибольшего интервала R–R, а максимальное по наименьшему интервалу R–R.
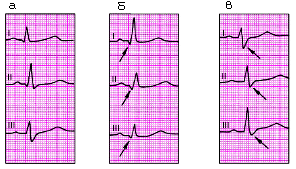
Для определения источника возбуждения, или так называемого водителя ритма, необходимо оценить ход возбуждения по предсердиям и установить отношение зубцов R к желудочковым комплексам QRS (рис. 3.43).

|
| Рис. 3.43. ЭКГ при синусовом и несинусовых ритмах. а - синусовый ритм, б - нижнепредсердный ритм, в, г - ритмы из АВ-соединения, д - желудочковый (идиовентрикулярный) ритм |
При этом следует ориентироваться на следующие признаки:
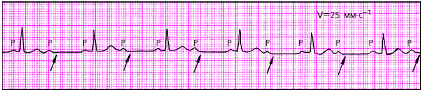
1. Синусовый ритм (рис. 3.43, а): а) зубцы РII положительны и предшествуют каждому желудочковому комплексу QRS; б) форма всех зубцов Р в одном и том же отведении одинакова.
2. Предсердные ритмы (из нижних отделов) (рис. 3.43, б):
а) зубцы PII и P III отрицательны;
б) за каждым зубцом Р следуют неизмененные комплексы QRS.
3. Ритмы из АВ-соединения (рис. 3.43, в, г):
а) если эктопический импульс одновременно достигает предсердий и желудочков, на ЭКГ отсутствуют зубцы Р, которые сливаются с обычными неизмененными комплексами QRS;
б) если эктопический импульс вначале достигает желудочков и только потом — предсердий, на ЭКГ регистрируются отрицательные РII и РIII, которые располагаются после обычных неизмененных комплексов QRS.
4. Желудочковый (идиовентрикулярный) ритм (рис. 3.43, д):
а) все комплексы QRS расширены и деформированы;
б) закономерная связь комплексов QRS и зубцов Р отсутствует;
в) число сердечных сокращений не превышает 40–60 уд. в мин.
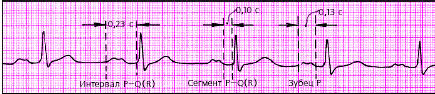
Оценка функции проводимости. Для предварительной оценки функции проводимости (рис. 3.44) необходимо измерить:
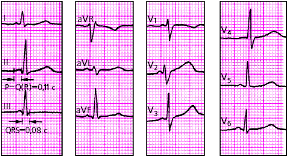
1. длительность зубца Р, которая характеризует скорость проведения электрического импульса по предсердиям (в норме не более 0,1 с);
2. длительность интервалов P-Q(R) во II стандартном отведении, отражающую общую скорость проведения по предсердиям, АВ-соединению и системе Гиса (в норме от 0,12 до 0,2 с);
3. длительность желудочковых комплексов QRS (проведение возбуждения по желудочкам), которая в норме составляет от 0,08 до 0,09 с.
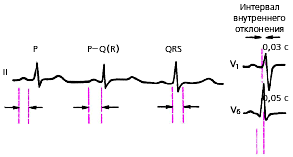
|
| Рис. 3.44. Оценка функции проводимости по ЭКГ. P =< 0,1 c; P-Q (R) =< 0,2 c; QRS < 0,1 c Объяснения в тексте. |
Увеличение длительности указанных зубцов и интервалов указывает на замедление проведения в соответствующем отделе проводящей системы сердца.
После этого измеряют интервал внутреннего отклонения в грудных отведениях V1 и V6, косвенно характеризующий скорость распространения волны возбуждения от эндокарда до эпикарда соответственно правого (не более 0,03 с) и левого желудочков (не более 0,05 с). Интервал внутреннего отклонения измеряется от начала комплекса QRS в данном отведении до вершины зубца R.
Определение положения электрической оси сердца
Повороты сердца вокруг переднезадней оси сопровождаются отклонением электрической оси сердца (среднего результирующего вектора Α QRS) во фронтальной плоскости и существенным изменением конфигурации комплекса QRS в стандартных и усиленных однополюсных отведениях от конечностей.
Различают следующие варианты положения электрической оси сердца (3.45):
· нормальное положение, когда угол α составляет от +30° до +69°;
· вертикальное положение — угол α от +70° до +90°;
· горизонтальное — угол α от 0° до +29°;
· отклонение оси вправо — угол α от +91° до ± 180°;
· отклонение оси влево — угол α от 0° до -90°.
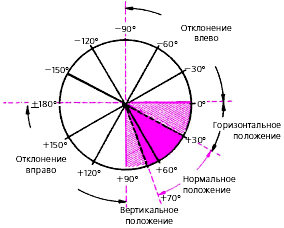
|
| Рис. 3.45. Различные варианты положения электрической оси сердца |
Для точного определения положения электрической оси сердца графическим методом достаточно вычислить алгебраическую сумму амплитуд зубцов комплекса QRS в любых двух отведениях от конечностей, оси которых расположены во фронтальной плоскости. Обычно для этой цели используют I и III стандартные отведения. Положительная или отрицательная величина алгебраической суммы зубцов комплекса QRS в произвольно выбранном масштабе откладывается на положительную или отрицательную часть оси соответствующего отведения в шестиосевой системе координат Bayley. Обычно для этой цели используют диаграммы и таблицы, приведенные в специальных руководствах по электрокардиографии.
Более простым, хотя и менее точным способом оценки положения электрической оси сердца является визуальное определение угла α. Метод основан на двух принципах:
Максимальное положительное (или отрицательное) значение алгебраической суммы зубцов комплекса QRS регистрируется в том электрокардиографическом отведении, ось которого приблизительно совпадает с расположением электрической оси сердца, и средний результирующий вектор QRS откладывается на положительную (или, соответственно, отрицательную) часть оси этого отведения.
Комплекс типа RS, где алгебраическая сумма зубцов равна нулю (R = S или R = Q + S), записывается в том отведении, ось которого перпендикулярна электрической оси сердца.
В табл. 3.2. приведены отведения, в которых в зависимости от положения электрической оси сердца имеется максимальная положительная, максимальная отрицательная алгебраическая сумма зубцов комплекса QRS и алгебраическая сумма зубцов, равная нулю.
Таблица 3.2
Конфигурация комплекса QRS в зависимости от положения электрической оси сердца
| Угол α | Алгебраическая сумма зубцов R и S(S+Q) | Комплекс QRS типа RS | |
| Максимальная+ | Максимальная- | ||
| +30° | I и II | aVR | III |
| +60° | II | aVR | aVL |
| +90° | aVF | aVL и aVR | I |
| +120 ° | III | aVL | aVR |
| +150° | III | aVL | II |
| ±180° | aVR | I | aVF |
| 0° | I | aVR | aVF |
| –30° | aVL | III | II |
| –60° | aVL | III | aVR |
| –90° | aVL и aVR | aVF | I |
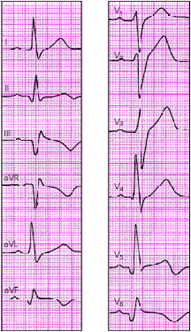
На рис. 3.46–3.53 в качестве примера приведены ЭКГ при различном положении электрической оси сердца.
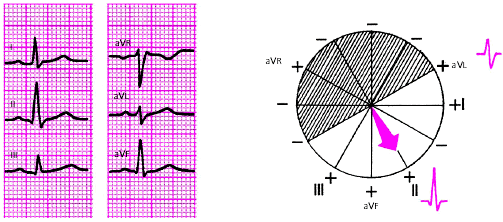
|
| Рис. 3.46. Нормальное положение электрической оси сердца. Угол альфа + 60 град. |

|
| Рис. 3.47. Нормальное положение электрической оси сердца. Угол альфа + 30 град. |

|
| Рис. 3.48. Вертикальное положение электрической оси сердца. Угол альфа + 90 град. |

|
| Рис. 3.49. Горизонтальное положение электрической оси сердца. Угол альфа = 0 град. |
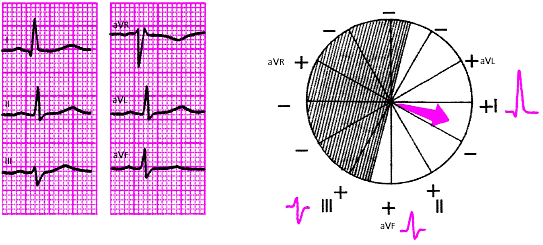
|
| Рис. 3.50. Горизонтальное положение электрической оси сердца. Угол альфа + 15 град. |

|
| Рис. 3.51. Отклонение электрической оси сердца влево. Угол альфа - 30 град. |

|
| Рис. 3.52. Резкое отклонение электрической оси сердца влево. Угол альфа - 60 град. |
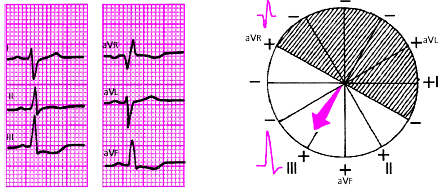
|
| Рис. 3.53. Отклонение электрической оси сердца вправо. Угол альфа + 120 град. |
Из таблицы и рисунков видно, что:
· При нормальном положении электрической оси сердца (угол α от +30° до +69°) амплитуда RII >= RI > RIII, а в отведениях III или/и aVL зубцы R и S примерно равны друг другу.
· При горизонтальном положении электрической оси сердца (угол α от 0° до +29°) амплитуда RI >= RII > RIII, а в отведениях aVF или/и III регистрируется комплекс типа RS.
· При вертикальном положении электрической оси сердца (угол α от +70° до +90°) амплитуда RII >= RIII > RI, а в отведениях I или/и aVL записывается комплекс типа RS.
· При отклонении электрической оси сердца влево (угол α от 0° до — 90°) максимальная положительная сумма зубцов регистрируется в отведениях I или/и aVL (или aVL и aVR), в отведениях aVF, aVR, I или II записывается комплекс типа RS, и имеется глубокий зубец S в отведениях III или/и aVF.
· При отклонении электрической оси сердца вправо (уголα от 91° до ±180°) максимальный зубец R фиксируется в отведениях aVF или/и III (или aVR), комплекс типа RS — в отведениях I или/и II (или aVR), а глубокий зубец S — в отведениях aVL или/и I.
Определение поворотов сердца вокруг продольной оси
Повороты сердца вокруг продольной оси, условно проведенной через верхушку и основание сердца, определяются по конфигурации комплекса QRS в грудных отведениях, оси которых расположены в горизонтальной плоскости. Для этого обычно необходимо установить локализацию переходной зоны, а также оценить форму комплекса QRS в отведении V6.
При нормальном положении сердца в горизонтальной плоскости (рис. 3.54, а) переходная зона расположена чаще всего в отведении V3. В этом отведении регистрируются одинаковые по амплитуде зубцы R и S. В отведении V6 желудочковый комплекс обычно имеет форму qR или qRs.
При повороте сердца вокруг продольной оси по часовой стрелке (если следить за вращением сердца снизу со стороны верхушки) переходная зона смещается несколько влево, в область отведения V4–V5, а в отведении V6 комплекс принимает форму RS (рис. 3.54, б).
При повороте сердца вокруг продольной оси против часовой стрелки переходная зона может сместиться вправо к отведению V2. В отведениях V6, V5 регистрируется углубленный (но не патологический) зубец Q, а комплекс QRS принимает вид qR (рис. 3.54, в).
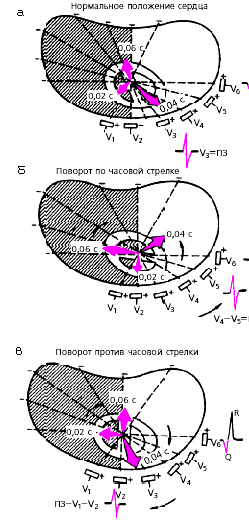
|
| Рис. 3.54. Форма желудочкового комплекса QRS в грудных отведениях при поворотах сердца вокруг продольной оси (модификация схемы А.З. Чернова и М.И. Кечкера, 1979). ПЗ - переходная зона |
 Запомните
Повороты сердца вокруг продольной оси по часовой стрелке нередко сочетаются с вертикальным положением электрической оси сердца или отклонением оси сердца вправо (рис. 3.55), а повороты против часовой стрелки — с горизонтальным положением или отклонением электрической оси влево (рис. 3.56). Запомните
Повороты сердца вокруг продольной оси по часовой стрелке нередко сочетаются с вертикальным положением электрической оси сердца или отклонением оси сердца вправо (рис. 3.55), а повороты против часовой стрелки — с горизонтальным положением или отклонением электрической оси влево (рис. 3.56).
|
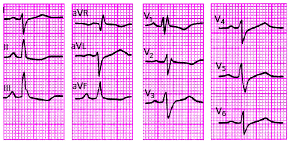
|
| Рис. 3.55. Сочетание поворота сердца вокруг продольной оси по часовой стрелке с поворотом электрической оси сердца вправо (угол альфа + 120 град.) |
|
| Рис. 3.56. Сочетание поворота сердца вокруг продольной оси против часовой стрелки с горизонтальным положением электрической оси сердца (угол альфа + 15 град.) |
Определение поворотов сердца вокруг поперечной оси
Повороты сердца вокруг поперечной оси принято связывать с отклонением верхушки сердца вперед или назад по отношению к ее обычному положению. При повороте сердца вокруг поперечной оси верхушкой вперед (рис. 3.57, б) желудочковый комплекс QRS в стандартных отведениях приобретает форму qRI, qRII, qRIII. Наоборот, при повороте сердца вокруг поперечной оси верхушкой назад желудочковый комплекс в стандартных отведениях имеет форму RSI, RSII, RSIII (рис. 3.57, в).
|
| Рис. 3.57. Форма ЭКГ в трех стандартных отведениях а - в норме и при поворотах сердца вокруг поперечной оси, б - верхушкой вперед, в - верхушкой назад |
Анализ предсердного зубца Р
Анализ зубца Р включает: 1) измерение амплитуды зубца Р (в норме не более 2,5 мм); 2) измерение длительности зубца Р (в норме не более 0,1 с); 3) определение полярности зубца Р в отведениях I, II, III; 4) определение формы зубца Р.
При нормальном направлении движения волны возбуждения по предсердиям (сверху вниз и несколько влево) зубцы Р в отведениях I, II и III положительные.
При направлении движения волны возбуждения по предсердиям снизу вверх (если водитель ритма расположен в нижних отделах предсердий или в верхней части АВ-узла) зубцы Р в этих отведениях отрицательные;
Расщепленный с двумя вершинами зубец Р в отведениях I, aVL, V5, V6 характерен для выраженной гипертрофии левого предсердия, например у больных с митральными пороками сердца. Заостренные высокоамплитудные зубцы Р в отведениях II, III, aVF (P–рulmonale) появляются при гипертрофии правого предсердия, например у больных с легочным сердцем (см. ниже).
Анализ желудочкового комплекса QRST
Анализ комплекса QRS включает:
1. Оценку соотношения зубцов Q, R, S в 12 отведениях, которое позволяет определить повороты сердца вокруг трех осей.
2. Измерение амплитуды и продолжительности зубца Q. Для так называемого патологического зубца Q характерно увеличение его продолжительности более 0,03 с и амплитуды более 1/4 амплитуды зубца R в этом же отведении.
3. Оценку зубцов R с измерением их амплитуды, продолжительности интервала внутреннего отклонения (в отведениях V1 и V6), и определением возможного расщепления зубца R или появления второго дополнительного зубца R (r ) в том же отведении.
4. Оценку зубцов S с измерением их амплитуды, а также определением возможного уширения, зазубренности или расщепления зубца S.
Анализ сегмента RS-T. Анализируя состояние сегмента RS-T, необходимо:
1. измерить положительное (+) или отрицательное (–) отклонение точки соединения (j) от изоэлектрической линии;
2. измерить величину возможного смещения сегмента RS-T на расстоянии 0,08 с вправо от точки соединения j;
3. определить форму возможного смещения сегмента RS-T: горизонтальное, косонисходящее или косовосходящее смещение.
При анализе зубца Т следует: 1) определить полярность зубца Т; 2) оценить форму зубца Т; 3) измерить амплитуду зубца Т.
В норме в большинстве отведений, кроме V1, V2 и aVR, зубец Т положительный, асимметричный (имеет пологое восходящее и несколько более крутое нисходящее колено). В отведении aVR зубец Т всегда отрицательный, в отведениях V1 – V2, III и aVF может быть положительным, двухфазным или слабо отрицательным.
Анализ интервала Q-T. Включает его измерение от начала комплекса QRS (зубца Q или R) до конца зубца Т и сравнение с должной величиной этого показателя, рассчитанной по формуле Базетта:
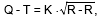
|
где К — коэффициент, равный 0,37 для мужчин и 0,40 для женщин; R-R — длительность одного сердечного цикла.
Электрокардиографическое заключение
В электрокардиографическом заключении указывают:
1. основной водитель ритма: синусовый или несинусовый (какой именно) ритм;
2. регулярность ритма сердца: правильный или неправильный ритм;
3. число сердечных сокращений (ЧСС);
4. положение электрической оси сердца;
5. наличие четырех электрокардиографических синдромов:
а) нарушений ритма сердца;
б) нарушений проводимости;
в) гипертрофии миокарда желудочков или/и предсердий, а также острых их перегрузок;
г) повреждений миокарда (ишемии, дистрофии, некрозов, рубцов и т. п.).
| 3.2.3. Электрокардиограмма при нарушениях ритма сердца |

|
|
В табл. 3.3. приведены электрокардиографические признаки первой группы аритмий, обусловленных нарушениями образования импульса. Перед тем как пользоваться этой таблицей, вспомните значение нескольких терминов, используемых при описании нарушений ритма и проводимости.
Экстрасистолия (ЭС) — преждевременное возбуждение всего сердца или какого-либо его отдела.
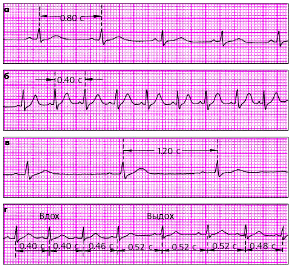
Интервал сцепления — расстояние от предшествующего экстрасистоле очередного цикла P-QRST основного ритма до экстрасистолы (рис. 3.58).
Компенсаторная пауза — расстояние от экстрасистолы до следующего за ней цикла P-QRST основного ритма. Неполная компенсаторная пауза — это пауза, возникающая после предсердной экстрасистолы или экстрасистолы из АВ-соединения, длительность которой чуть больше обычного интервала P-P (R-R) основного ритма (рис. 3.58, а).
Неполная компенсаторная пауза включает время, необходимое для того, чтобы эктопический импульс достиг СА-узла и «разрядил» его, а также время, которое требуется для подготовки в нем очередного синусового импульса. Полная компенсаторная пауза — пауза, возникающая после желудочковой экстрасистолы, длительность которой равна удвоенному интервалу R-R основного ритма (рис. 3.58, б).

|
| Рис. 3.58. Измерение интервала сцепления и длительности компенсаторной паузы при а - предсердной и б - желудочковой экстрасистолии |
Ранние экстрасистолы — ЭС с очень малым интервалом сцепления, когда начальная часть экстрасистолы наслаивается на зубец Т предшествующего ЭС очередного комплекса QRST.
Групповая (залповая) экстрасистолия — наличие на ЭКГ трех и более ЭС подряд.
Монотопная экстрасистолия — ЭС, исходящие из одного эктопического источника.
Политопная экстрасистолия — ЭС, исходящие из разных эктопических очагов.
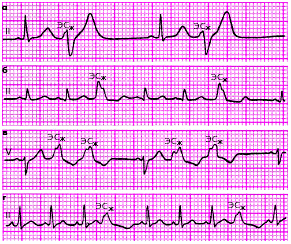
Аллоритмия — правильное чередование ЭС и нормальных (например синусовых) комплексов P-QRST (бигеминия, тригеминия, квадригеминия и т. п.) (рис. 3.59).
|
| Рис. 3.59. Различные варианты желудочковой аллоритмии. а - бигеминия, б, в - тригеминия, г - квадригеминия |
Блокированные предсердные ЭС — экстрасистолы, исходящие из предсердий, которые представлены на ЭКГ только зубцом Р, после которого отсутствует экстрасистолический желудочковый комплекс QRST'.
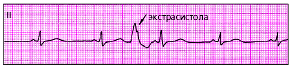
Вставочная (интерполированная) экстрасистола — ЭС, которая как бы вставлена между двумя обычными желудочковыми комплексами QRS без какой бы то ни было компенсаторной паузы (рис. 3.60).
|
| Рис. 3.60. ЭКГ при вставочной (интерполированной) желудочковой экстрасистоле. Компенсаторная пауза отсутствует |
Угрожающие желудочковые экстрасистолы (ЖЭ) — экстрасистолы, которые нередко являются предвестниками более тяжелых нарушений ритма (пароксизмальной желудочковой тахикардии, фибрилляции или трепетания желудочков). К угрожающим желудочковым экстрасистолам (ЖЭ) относятся: 1) частые; 2) политопные; 3) парные (групповые) и 4) ранние ЖЭ.
Атриовентрикулярная диссоциация (АВ-диссоциация) — полная (или почти полная) разобщенность в деятельности предсердий и желудочков, возникающая при желудочковой пароксизмальной тахикардии в результате увеличения рефрактерности АВ-соединения и невозможности проведения к желудочкам синусовых импульсов.
Дискордантность — разнонаправленность, например, алгебраической суммы зубцов комплекса QRS и сегмента RS-T (или/и зубца Т). Конкордантность — однонаправленность, например, алгебраической суммы зубцов комплекса QRS и сегмента RS-T (зубца Т).
|
| Рис. 3.61. Номотопные нарушения ритма. а - ЧСС - 75 в мин, б - синусовая тахикардия (ЧСС - 150 в мин), синусовая брадикардия (ЧСС - 50 в мин), г - синусовая (дыхательная) аритмия |
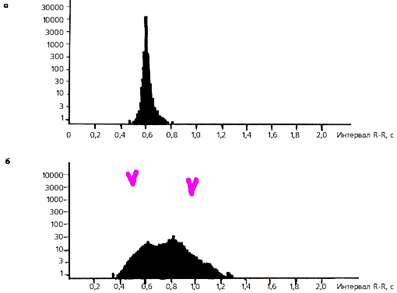
На рис. 3.62–3.78 приведены примеры электрокардиограмм при нарушениях ритма сердца. Возможности диагностики нарушений ритма сердца с помощью метода длительного мониторирования ЭКГ по Холтеру описаны ниже.

|
| Рис. 3.62 . ЭКГ больных с медленными (замещающими) выскальзывающими эктопическими комплексами. а, б - выскальзывающие комплексы из АВ-соединения, в - выскальзывающий комплекс из желудочка |
|
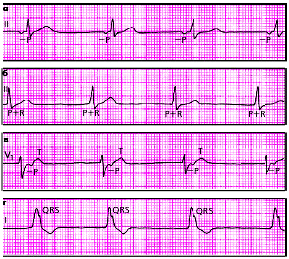
| Рис. 3.63. ЭКГ больных с медленными (замещающими) выскальзывающими ритмами. а - предсердный ритм, б - ритм из АВ-соединения с одновременным возбуждением предсердий и желудочков, в - ритм из АВ-соединения с возбуждением желудочков, предшествующим возбуждению предсердий, г - желудочковый (идиовентрикулярный) ритм |
|
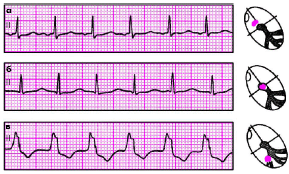
| Рис. 3.64. Ускоренные эктопические ритмы, или непароксизмальные тахикардии а - ускоренный предсердный ритм, б - ускоренный ритм из АВ-соединения с одновременным возбуждением желудочков и предсердий, в - желудочковый (идиовентрикулярный) ускоренный ритм |

|
| Рис. 3.65. ЭКГ больного с миграцией суправентрикулярного водителя ритма |

|
| Рис. 3.66. Предсердная экстрасистола (ЭС) |
|
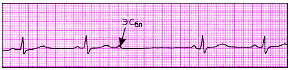
| Рис. 3.67. Блокированная предсердная экстрасистола (ЭСбл) |
|
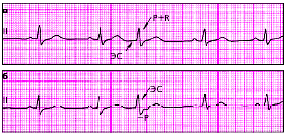
| Рис. 3.68. Экстрасистолы из АВ-соединения с одновременным возбуждением предсердий и желудочков (а) и более ранним возбуждением желудочков (б) |

|
| Рис. 3.69. Желудочковая экстрасистола (ЖЭ) |
|
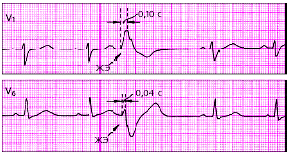
| Рис. 3.70. Левожелудочковая экстрасистола. Интервал внутреннего отклонения увеличен в отведении V1 до 0,10 с |

|
| Рис. 3.71. Правожелудочковая экстрасистола. Интервал внутреннего отклонения увеличен в отведении V6 до 0,10 с |
|
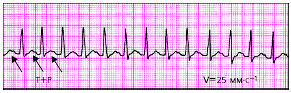
| Рис. 3.72. Предсердная пароксизмальная тахикардия. Зубцы Р наслаиваются на зубцы Т |
|
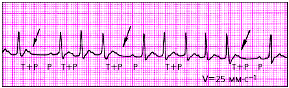
| Рис. 3.73. Предсердная пароксизмальная тахикардия с преходящей АВ-блокадой II степени и выпадением отдельных комплексов QRS |
|
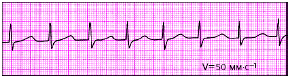
| Рис. 3.74. Пароксизмальная тахикардий из АВ-соединения с одновременным возбуждением предсердий и желудочков |
|
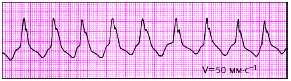
| Рис. 3.75. Пароксизмальная желудочковая тахикардия |
|
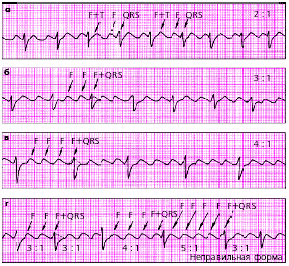
| Рис. 3.76. ЭКГ при трепетании предсердий. а - правильная форма с функциональной АВ-блокадой (2:1), б - правильная форма (3:1), в - правильная форма (4:1), г - неправильная форма с изменением степени АВ-блокады (3:1, 4:1, 5:1) |
|
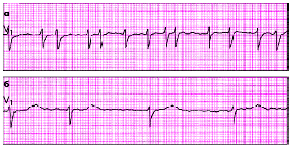
| Рис. 3.77. ЭКГ при тахисистолической (а) и брадисистолической (б) формах мерцания (фибрилляции) предсердий |

|
| Рис. 3.78. ЭКГ при трепетании (а) и фибрилляции (б) желудочков |
| 3.2.4. Электрокардиограмма при нарушениях проводимости |

|

|
На рис. 3.79–3.103 приведены примеры наиболее часто встречающихся нарушений проводимости.

|
| Рис. 3.79 . Неполная синоатриальная блокада (а) и выскальзывающий комплекс на фоне синоатриальной блокады (б) |

|
| Рис. 3.80. Межпредсердная (внутрипредсердная) блокада I степени. Заметно постоянное расщепление зубца Р |
|
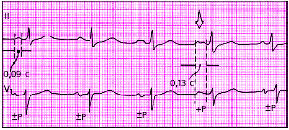
| Рис. 3.81. Межпредсердная (внутрипредсердная) блокада II степени. Стрелкой обозначен момент возникновения максимальной блокады проведения (расщепление зубца РII и исчезновение второй отрицательной фазы зубца РVI) |
|
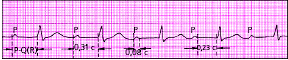
| Рис. 3.82. АВ-блокада I степени (узловая форма) |
|
| Рис. 3.83. АВ-блокада I степени (предсердная форма) |
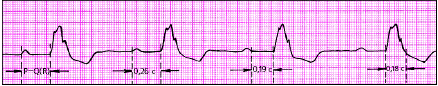
|
| Рис. 3.84. АВ-блокада I степени (дистальная, трехпучковая форма) |
|
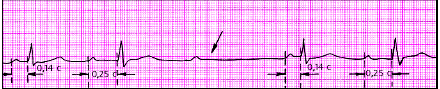
| Рис. 3.85. АВ-блокада II степени (тип I Мобитца, 3:2). Стрелкой указано выпадение желудочкового комплекса |

|
| Рис. 3.86. АВ-блокада II степени (тип II Мобитца) с наличием постоянного нормального (а) и увеличенного (б) интервала PQ |
|
| Рис. 3.87. АВ-блокада II степени типа 2:1 |
|
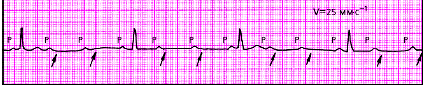
| Рис. 3.88. Прогрессирующая АВ-блокада II степени типа 3:1 |

|
| Рис. 3.89. ЭКГ при проксимальной (а) и дистальной (б) формах АВ-блокады III степени |

|
| Рис. 3.90. Синдром Фредерика (сочетание мерцания предсердий и полной АВ-блокады) |
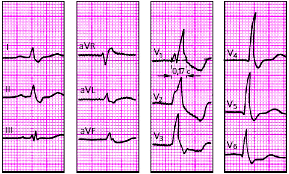
|
| Рис. 3.91. ЭКГ при полной блокаде правой ножки пучка Гиса. Объяснения в тексте |

|
| Рис. 3.92. ЭКГ при неполной блокаде правой ножки пучка Гиса. Объяснения в тексте |
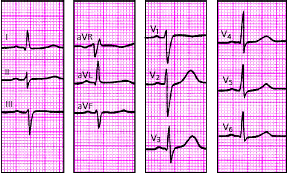
|
| Рис. 3.93. ЭКГ при блокаде левой передней ветви пучка Гиса. Объяснения в тексте |
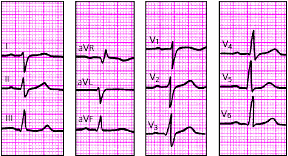
|
| Рис. 3.94. ЭКГ при блокаде левой задней ветви пучка Гиса. Объяснения в тексте |
|
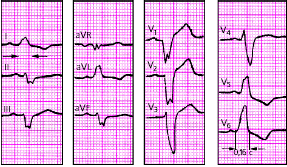
| Рис. 3.95. ЭКГ при полной блокаде левой ножки пучка Гиса. Объяснения в тексте |
|
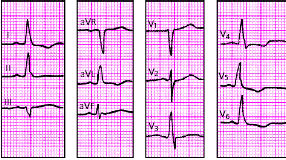
| Рис. 3.96. ЭКГ при неполной блокаде левой ножки пучка Гиса. Объяснения в тексте |
|
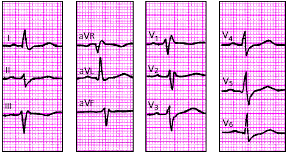
| Рис. 3.97. ЭКГ при сочетании неполной блокады правой ножки пучка Гиса и блокады левой передней ветви пучка Гиса. Объяснения в тексте |
|
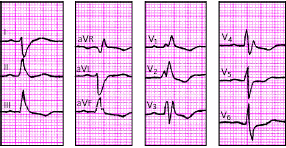
| Рис. 3.98. ЭКГ при сочетании блокады правой ножки пучка Гиса и блокады левой задней ветви пучка Гиса. Объяснения в тексте |

|
| Рис. 3.99. ЭКГ при неполной трехпучковой блокаде в сочетании с АВ-блокадой I степени. Объяснения в тексте |

|
| Рис. 3.100. ЭКг при неполной трехпучковой блокаде в сочетании с АВ-блокадой II степени (4:3) |

|
| Рис. 3.101. ЭКГ при полной трехпучковой блокаде |

|
| Рис. 3.102. ЭКГ при синдроме WPW |
|
| Рис. 3.103. ЭКГ при синдроме укороченного интервала P-Q(R) (синдроме CLC) |
На рис. 3.79–3.103 приведены примеры наиболее часто встречающихся нарушений проводимости.

|
| Рис. 3.79 . Неполная синоатриальная блокада (а) и выскальзывающий комплекс на фоне синоатриальной блокады (б) |

|
| Рис. 3.80. Межпредсердная (внутрипредсердная) блокада I степени. Заметно постоянное расщепление зубца Р |

|
| Рис. 3.81. Межпредсердная (внутрипредсердная) блокада II степени. Стрелкой обозначен момент возникновения максимальной блокады проведения (расщепление зубца РII и исчезновение второй отрицательной фазы зубца РVI) |

|
| Рис. 3.82. АВ-блокада I степени (узловая форма) |

|
| Рис. 3.83. АВ-блокада I степени (предсердная форма) |

|
| Рис. 3.84. АВ-блокада I степени (дистальная, трехпучковая форма) |

|
| Рис. 3.85. АВ-блокада II степени (тип I Мобитца, 3:2). Стрелкой указано выпадение желудочкового комплекса |

|
| Рис. 3.86. АВ-блокада II степени (тип II Мобитца) с наличием постоянного нормального (а) и увеличенного (б) интервала PQ |

|
| Рис. 3.87. АВ-блокада II степени типа 2:1 |

|
| Рис. 3.88. Прогрессирующая АВ-блокада II степени типа 3:1 |

|
| Рис. 3.89. ЭКГ при проксимальной (а) и дистальной (б) формах АВ-блокады III степени |

|
| Рис. 3.90. Синдром Фредерика (сочетание мерцания предсердий и полной АВ-блокады) |

|
| Рис. 3.91. ЭКГ при полной блокаде правой ножки пучка Гиса. Объяснения в тексте |

|
| Рис. 3.92. ЭКГ при неполной блокаде правой ножки пучка Гиса. Объяснения в тексте |

|
| Рис. 3.93. ЭКГ при блокаде левой передней ветви пучка Гиса. Объяснения в тексте |

|
| Рис. 3.94. ЭКГ при блокаде левой задней ветви пучка Гиса. Объяснения в тексте |

|
| Рис. 3.95. ЭКГ при полной блокаде левой ножки пучка Гиса. Объяснения в тексте |

|
| Рис. 3.96. ЭКГ при неполной блокаде левой ножки пучка Гиса. Объяснения в тексте |

|
| Рис. 3.97. ЭКГ при сочетании неполной блокады правой ножки пучка Гиса и блокады левой передней ветви пучка Гиса. Объяснения в тексте |

|
| Рис. 3.98. ЭКГ при сочетании блокады правой ножки пучка Гиса и блокады левой задней ветви пучка Гиса. Объяснения в тексте |

|
| Рис. 3.99. ЭКГ при неполной трехпучковой блокаде в сочетании с АВ-блокадой I степени. Объяснения в тексте |

|
| Рис. 3.100. ЭКг при неполной трехпучковой блокаде в сочетании с АВ-блокадой II степени (4:3) |

|
| Рис. 3.101. ЭКГ при полной трехпучковой блокаде |

|
| Рис. 3.102. ЭКГ при синдроме WPW |

| |||||||||||||||||||
| Рис. 3.103. ЭКГ при синдроме укороченного интервала P-Q(R) (синдроме CLC) | |||||||||||||||||||
| |||||||||||||||||||
Разнообразные электрокардиографические изменения, выявляемые при компенсаторной гипертрофии любого отдела сердца, обусловлены:
1. увеличением электрической активности гипертрофированного отдела сердца;
2. замедлением проведения по нему электрического импульса;
3. ишемическими, дистрофическими, метаболическими и склеротическими изменениями в гипертрофированной сердечной мышце.
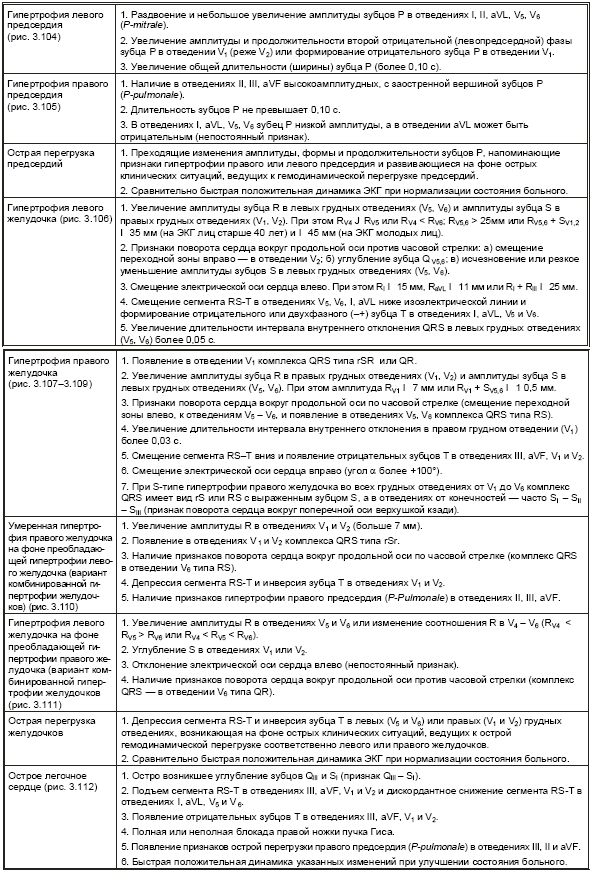
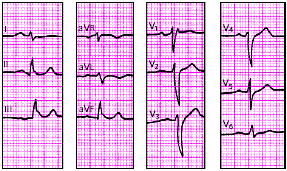
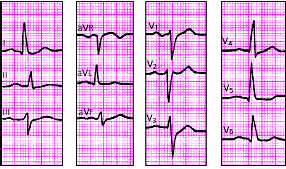
В табл. 3.5. представлены основные электрокардиографические признаки, а на рис. 3.104–3.112 — типичные электрокардиограммы при гипертрофии различных отделов сердца.
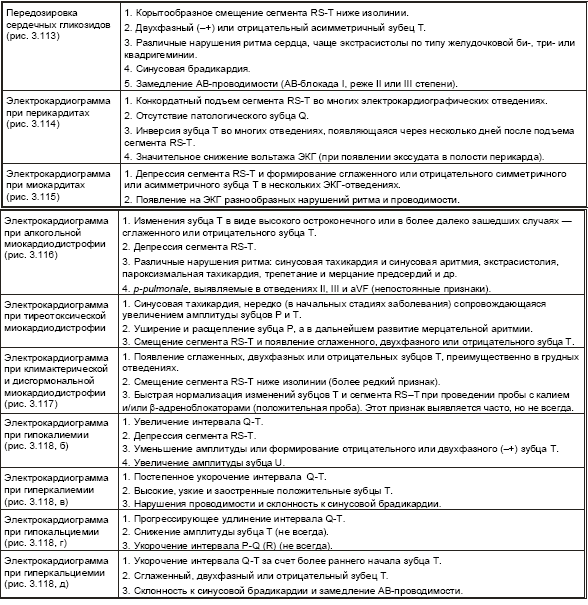
Таблица 3.5
Электрокардиографические признаки гиертрофии предсердий и желудочков
| |||||||||||||||||||
| |||||||||||||||||||
В табл. 3.6. представлены электрокардиографические признаки воспалительных, дистрофических и метаболических поражений сердца, а также электролитных нарушений.
Таблица 3.6
Электрокардиографические признаки воспалительных, дистрофических и метаболических поражений сердца, а также элкетролитных нарушений
|
| |||||||||||||||||||||||||||||
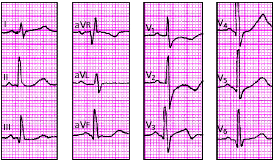
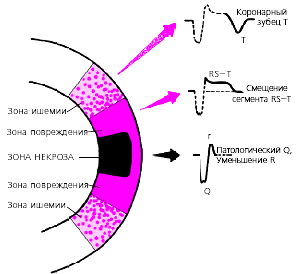
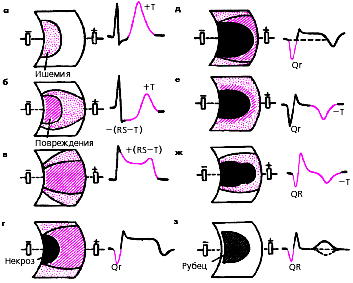
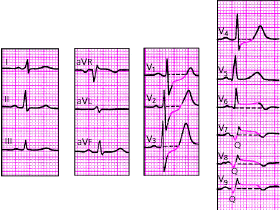
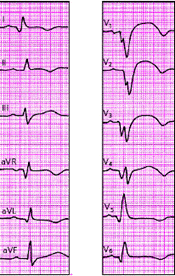
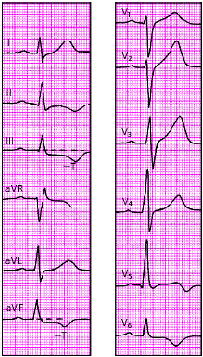
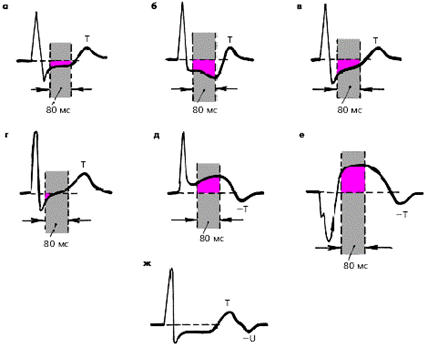
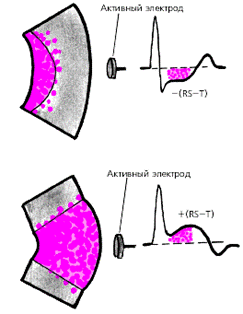
Крупноочаговый инфаркт миокарда (ИМ) развивается при остром нарушении коронарного кровообращения, обусловленном тромбозом или (реже) выраженным и длительным спазмом коронарной артерии. Согласно представлениям Bayley, такое нарушение кровообращения в сердечной мышце приводит к формированию трех зон патологических изменений: вокруг участка некроза располагаются зоны ишемического повреждения и ишемии (рис. 3.119). Поэтому на ЭКГ, зарегистрированной при остром крупноочаговом инфаркте миокарда, фиксируются не только патологический зубец Q или комплекс QS (некроз), но и смещение сегмента RS-T выше или ниже изолинии (ишемическое повреждение), а также остроконечные и симметричные коронарные зубцы Т (ишемия).
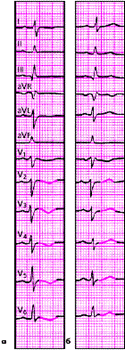
ЭКГ изменяется в зависимости от времени, прошедшего от начала формирования инфаркта миокарда, в течении которого различают: 1) острую стадию — от нескольких часов до 14–16 суток от начала ангинозного приступа; 2) подострую стадию, длящуюся примерно от 15–20 суток от начала инфаркта до 1,5–2 месяцев; 3) рубцовую стадию. Динамика ЭКГ в зависимости от стадии инфаркта представлена на рис. 3.120. Острая стадия характеризуется быстрым, в течение 1–2 суток, формированием патологического зубца Q или комплекса QS, смещением сегмента RS-T выше изолинии и сливающегося с ним вначале положительного, а затем отрицательного, зубца Т. Через несколько дней сегмент RS-T несколько приближается к изолинии. На 2–3й неделе заболевания сегмент RS-T становится изоэлектричным, а отрицательный коронарный зубец Т резко углубляется и становится симметричным, заостренным (повторная инверсия зубца Т). В подострой стадии ИМ регистрируется патологический зубец Q или комплекс QS (некроз) и отрицательный коронарный зубец Т (ишемия), амплитуда которого, начиная с 20–25–х суток инфаркта миокарда, постепенно уменьшается. Сегмент RS-T расположен на изолинии. Рубцовая стадия ИМ характеризуется сохранением в течение ряда лет, нередко в течение всей жизни больного, патологического зубца Q или комплекса QS и наличием слабоотрицательного, сглаженного или положительного зубца Т.
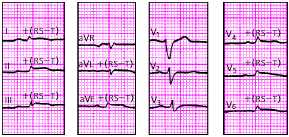
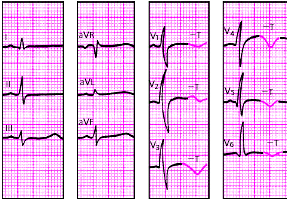
Изменения ЭКГ при острых инфарктах миокарда различной локализации представлены в табл. 3.7. Прямыми признаками острой стадии инфаркта являются патологический зубец Q (или комплекс QS), элевация (подъем) сегмента RS-T и отрицательный (коронарный) зубец Т. В «противоположных» отведениях нередко встречаются так называемые реципрокные изменения ЭКГ: депрессия сегмента RS-T ниже изолинии и положительный остроконечный и симметричный (коронарный) зубец Т. Иногда наблюдается некоторое увеличение амплитуды зубца R.
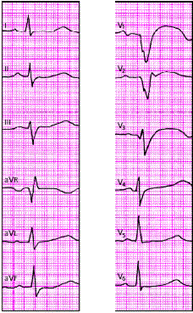
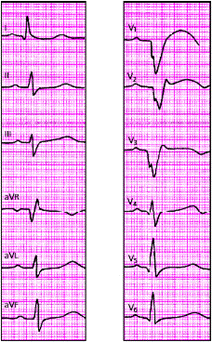
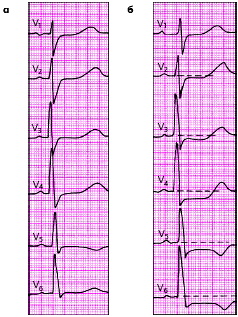
На рис. 3.121–3.128 приведены ЭКГ больных с острым ИМ различной локализации. Следует помнить, что трансмуральный ИМ той или иной локализации диагностируется в тех случаях, когда в двух или более отведениях, расположенных над областью инфаркта, регистрируется комплекс QS, а крупноочаговый инфаркт — при наличии патологического зубца Q.
При постинфарктной аневризме (рис. 3.129) ЭКГ характеризуется обычно наличием комплекса QS и подъема сегмента RS-T выше изолинии в нескольких отведениях, причем ЭКГ не претерпевает изменений в зависимости от стадий инфаркта миокарда («застывшая» ЭКГ).
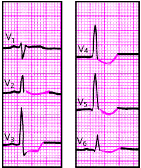
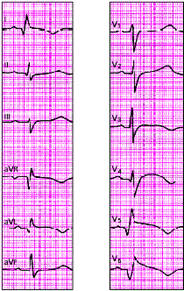
Наконец, электрокардиографическими признаками мелкоочагового ИМ («не-Q-инфаркта миокарда») являются смещение сегмента RS-T выше или ниже изолинии и/или разнообразные остро появившиеся патологические изменения зубца Т (чаще отрицательный коронарный зубец Т). Эти патологические изменения ЭКГ наблюдаются на протяжении 3–5 недель от начала инфаркта (рис. 3.130 и 3.131).
При субэндокардиальном ИМ комплекс QRS также может быть не изменен, патологический Q отсутствует (рис. 3.132). В первые сутки такого инфаркта появляется смещение сегмента RS-T ниже изолинии на 2–3 мм в двух и более отведениях, а также отрицательный зубец Т. Сегмент RS-T нормализуется обычно в течение 1–2 недель, а зубец Т остается отрицательным, проделывая ту же динамику, что и при крупноочаговом инфаркте.
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
При хронической ишемической болезни сердца в сердечной мышце выявляются участки ишемии, ишемического повреждения и, в ряде случаев, рубцовых изменений миокарда, сочетание которых приводит к разнообразным изменениям ЭКГ, зарегистрированной в покое (изменение комплекса QRS, сегмента RS-T и зубца Т, нарушения ритма и проводимости и т. п.), большинство из которых неспецифичны. Относительно достоверным указанием на наличие ИБС является патологический зубец Q или комплекс QS, свидетельствующие о перенесенном в прошлом инфаркте миокарда. Однако и в этих случаях необходимо исключить связь патологического Q (QS) с выраженной гипертрофией желудочков, гипертрофической кардиомиопатией, блокадой ножек пучка Гиса, синдромом WPW и другими электрокардиографическими синдромами.
Нередко, особенно у молодых больных с ишемической болезнью сердца, ЭКГ, зарегистрированная в покое, мало отличается от таковой здоровых людей. В этих случаях для электрокардиографической диагностики ИБС используют функциональные нагрузочные пробы. Чаще других применяют пробу с дозированной физической нагрузкой на велоэргометре или тредмиле, дипиридамоловую пробу, чреспищеводную электростимуляцию предсердий и суточное мониторирование ЭКГ по Холтеру.
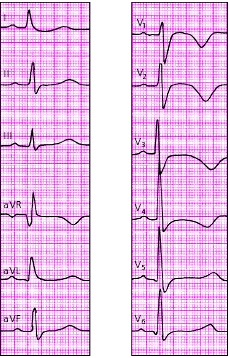
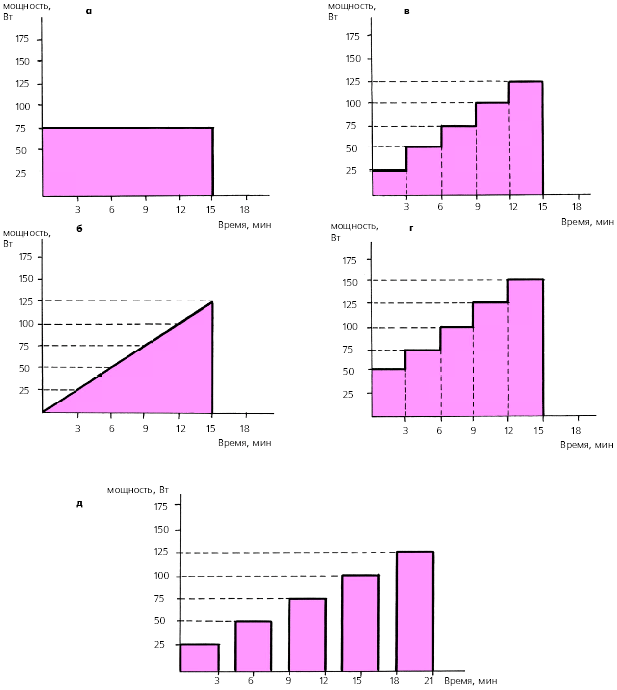
Проба с физической нагрузкой
Проба с дозированной физической нагрузкой применяется с целью выявления скрытой коронарной недостаточности, преходящих нарушений ритма сердца и для установления индивидуальной толерантности больных к физической нагрузке.
Физическая нагрузка, как известно, оказывает разнообразное действие на сердечно-сосудистую и дыхательную системы, вызывая, в частности, тахикардию, умеренное повышение артериального давления, увеличение работы сердца и, соответственно, потребности миокарда в кислороде. У здорового человека это приводит к адекватному расширению коронарных сосудов и увеличению сократимости миокарда. В условиях лимитированного коронарного кровообращения у больных ишемической болезнью сердца увеличение потребности миокарда в кислороде приводит у острой коронарной недостаточности, сопровождающейся приступом стенокардии и изменениями на ЭКГ.
Существует несколько методов проведения пробы с физической нагрузкой, среди которых наибольшее распространение в клинической практике получили пробы с дозированной физической нагрузкой на велоэргометре или тредмиле (бегущая дорожка). Наиболее доступной является велоэргометрия. Используемый для этой цели велоэргометр (рис. 3.133) позволяет строго дозировать физическую нагрузку и оценивать величину выполненной внешней работы в ваттах (Вт) или килограммометрах (кГм). Для проведения пробы необходим также электрокардиограф (желательно многоканальный), сфигмоманометр для измерения уровня АД и фонендоскоп. Кабинет функциональной диагностики, где проводится исследование, должен быть оснащен дефибриллятором и набором средств для оказания неотложной помощи.
Велоэргометрическую пробу проводят обычно в первой половине дня натощак или через 2–3 ч после еды. Желательно, чтобы за сутки до проведения исследования пациент не принимал лекарственных препаратов, оказывающих влияние на результаты пробы с физической нагрузкой: нитратов пролонгированного действия, блокаторов β-адренорецепторов, антагонистов кальция, ингибиторов АПФ, сердечных гликозидов, мочегонных средств, некоторых противоаритмических препаратов. ЭКГ регистрируют в 12 общепринятых отведениях (рис. 3.134). Для удобства проведения исследования электроды от верхних конечностей помещают на грудную клетку в подключичных областях или ниже углов лопаток, а электроды от нижних конечностей — в области поясницы.
Применяются различные схемы проведения велоэргометрической пробы (рис. 3.135). Чаще всего нагрузку повышают ступенеобразно каждые 3 мин, начиная с мощности 25 или 50 Вт (150–300 кГм/мин). Такое ступенеобразное повышение величины нагрузки на 25 Вт можно осуществлять как непрерывно в течение 15–18 мин, так и с 3-минутными перерывами для отдыха после каждой ступени нагрузки (у менее тренированных лиц или больных с тяжелыми заболеваниями сердца и резко сниженной толерантностью к физической нагрузке). Наиболее физиологичной считается непрерывная ступенеобразно возрастающая нагрузка (рис. 3.135, в, г).
Велоэргометрическую пробу проводят под постоянным контролем ЭКГ на экране осциллоскопа, уровня АД и состояния больного. Запись ЭКГ и измерение АД проводят до начала исследования, в конце каждой минуты пробы, а также на 30-й секунде, 1-й, 2-й, 3-й, 5-й, 7-й и 10-й минутах отдыха. При необходимости регистрация ЭКГ в период отдыха может быть продолжена. Тредмил представляет собой движущуюся дорожку, которая может устанавливаться под различным углом наклона. Скорость движения дорожки и угол ее наклона регулируется в зависимости от задаваемой мощности нагрузки и протокола исследования (табл. 3.8). Таблица 3.8 Изменение скорости и угла подъема движущейся дорожки (протокол R. Bruce)
Примечание: Угол подъема дорожки принято оценивать в процентах: например, подъем конца дорожки на 5 см соответствует углу подъема 5% (2,5о) и т. д.
Пациент, находящийся на движущейся дорожке, шагает или бежит по ней (рис. 3.136). Развиваемая при этом мощность и величина выполненной работы оцениваются по таблицам или автоматически.
Контроль за динамикой ЭКГ, АД и ЧСС осуществляется таким же способом, как и при проведении велоэргометрической пробы.
Противопоказаниями против проведения велоэргометрии и тредмил-теста являются: 1. Острый ИМ (или подозрение на ИМ). 2. Нестабильная стенокардия (НС). 3. Сердечная недостаточность II–III стадии. 4. Дыхательная недостаточность II–III степени. 5. Острое нарушение мозгового кровообращения или хроническая дисциркуляторная недостаточность II-III степени. 6. Острые инфекционные заболевания, сопровождающиеся лихорадкой. 7. Острый тромбофлебит. Существуют также относительные противопоказания: 1. Выраженная артериальная гипертензия (АД выше 200/100 мм рт. ст.). 2. Тяжелые нарушения ритма и проводимости (АВ-блокада II–III степени, мерцательная аритмия, пароксизмальные тахикардии). 3. Тахикардия неясного генез (ЧСС выше 100 уд. в мин). 4. Стеноз устья аорты (клапанный, подклапанный). 5. Аневризмы сердца и сосудов. 6. Частые синкопальные состояния в анамнезе. 7. Неврологические и психические заболевания. 8. Заболевания опорно-двигательного аппарата и др. Следует отметить, что решение вопроса о возможности проведения велоэргометрической пробы должно быть строго индивидуальным и учитывать общее состояние больного, его гемодинамические показатели, целесообразность исследования, а также условия его проведения. Например, в настоящее время в некоторых специализированных кардиологических стационарах допускается проведение нагрузочных проб у больных инфарктом миокарда с целью ранней физической реабилитации этих больных (обычно начиная со 2-й недели заболевания). В ряде случаев велоэргометрические тесты могут проводиться у больных нестабильной стенокардией с целью уточнения диагноза и прогноза заболевания и т. п. Подобные исследования у больных ИМ и НС могут осуществляться только в специально оснащенных блоках интенсивной терапии или кардиореанимационных отделениях при участии врачей-реаниматологов. Интерпретация результатов При проведении пробы с дозированной физической нагрузкой у больных ИБС врач преследует обычно две основные цели: 1) определение толерантности пациента к физической нагрузке; 2) выявление клинических и электрокардиографических признаков ишемии миокарда, обусловленной коронарной недостаточностью, с целью диагностики ишемической болезни сердца. Толерантность к нагрузке оценивают преимущественно по показателю максимальной (пороговой) мощности работы, выполненной пациентом. Используют и другие показатели: общий объем выполненной работы, длительность нагрузки, время возникновения боли в области сердца и депрессии сегмента RS-T и другие. Различают: 1) высокую толерантность, когда максимальная мощность нагрузки в момент ее прекращения равна 150 Вт (900 кГм/мин) и выше; 2) среднюю толерантность, когда максимальная мощность нагрузки равна 100–125 Вт (600–750 кГм/мин); 3) низкую толерантность, когда максимальная мощность нагрузки не превышает 25–75 Вт (150–450 кГм/мин). Индивидуальная толерантность к физической нагрузке зависит от многих факторов, в том числе от величины коронарного резерва, т. е. индивидуальной способности к адекватному увеличению коронарного кровотока при физической нагрузке, от сократительной способности миокарда, физической тренированности обследуемого, от индивидуальной реакции сердечно-сосудистой системы на нагрузку в виде подъема или снижения артериального давления и т. д. Таблица 3.9 Максимальная частота сердечных сокращений
Таблица 3.10 Субмаксимальная частота сердечных сокращений
Критериями прекращения велоэргометрической пробыявляются: 1. Достижение пациентом максимальной или субмаксимальной возрастной ЧСС (см. табл. 3.9 и 3.10). 2. Горизонтальное или косонисходящее снижение (депрессия) сегмента RS-T на 1,0 мм и более от исходного уровня при условии, если такое снижение сохраняется на протяжении не менее 80 мс от точки соединения ( j ) (рис. 3.137 а, б). 3. Медленное косовосходящее снижение (депрессия) сегмента RS-T на 1,0 мм и более от исходного уровня при условии, если такое снижение сохраняется на протяжении не менее 80 мс от точки соединения (j) (рис. 3.137 в) 4. Подъем сегмента RS-T на 1,0 мм и более от исходного уровня на протяжении 80 мс от точки соединения (рис. 3.137 д, е). 5. Приступ стенокардии. 6. Снижение систолического АД (САД) на 20 мм рт. ст. 7. Подъем САД более 220 мм рт. ст. и/или диастолического АД (ДАД) более 110 мм рт. ст. м выше. 8. Возникновение приступа удушья или выраженной одышки. 9. Появление угрожающих нарушений ритма (частая ЖЭ, политопная ЖЭ, залповая ЖЭ, пароксизм суправентрикулярной или желудочковой тахикардии, пароксизм мерцательной аритмии) . 10. Возникновение АВ-блокады или блокады ножек пучка Гиса. 11. Изменение комплекса QRS: углубление и увеличение продолжительности ранее существовавших зубцов Q, переход патологического зубца Q в комплекс QS. 12. Появление резкой общей слабости. 13. Возникновение выраженного головокружения, головной боли, тошноты, нарушений координации движений. 14. Отказ больного от дальнейшего исследования.
Следует подчеркнуть, что изменения зубца Т, нередко возникающие при выполнении физической нагрузки, не являются критериями прекращения нагрузочной пробы. В табл. 3.9. приведены величины максимальной частоты сердечных сокращений в зависимости от пола и возраста, по достижении которой следует прекратить пробу с нагрузкой у здоровых людей. У больных с установленным диагнозом ишемической болезни сердца часто ограничиваются достижением так называемой субмаксимальнной частоты сердечных сокращений, составляющей 75% или 80% от максимальной, так как дальнейшее увеличение нагрузки опасно из-за возможности возникновения осложнений. В табл. 3.10 приведены величины субмаксимальной (75% от максимальной) ЧСС в зависимости от пола и возраста. Важно помнить, что снижение толерантности к физической нагрузке возможно не только у больных ишемической болезнью сердца, но и у пациентов с другими органическими и функциональными заболеваниями сердечно-сосудистой системы и даже у малотренированных здоровых людей. Иными словами, снижение толерантности не является специфичным признаком наличия ишемической болезни сердца. Диагностика преходящей ишемии миокарда, индуцированной нагрузочным тестом.При проведении функциональных нагрузочных тестов с целью объективного подтверждения ишемии миокарда могут быть получены следующие результаты (Д. М. Аронов с соавт., 1995): 1. положительная проба; 2. отрицательная проба; 3. сомнительная проба; 4. неинформативная (незавершенная) проба. Положительная проба. Наиболее достоверными объективными диагностическими критериями ишемии миокарда являются следующие 3 электрокардиографических признака: 1. Горизонтальное или косонисходящее снижение (депрессия) сегмента RS-T на 1,0 мм и более от исходного уровня при условии, если такое снижение сохраняется на протяжении не менее 80 мс от точки соединения (j) (рис. 3.137 а, б). 2. Медленное косовосходящее снижение (депрессия) сегмента RS-T на 1,0 мм и более от исходного уровня при условии, если такое снижение сохраняется на протяжении не менее 80 мс от точки соединения (j) (рис. 3.137 в). 3. Подъем сегмента RS-T на 1,0 мм и более от исходного уровня на протяжении 80 мс от точки соединения (рис. 3.137 д, е). Ишемические смещения сегмента RS-T ниже изоэлектрической линии связывают обычно с развитием субэндокардиальной ишемии миокарда. Ишемический подъем сегмента RS-T может свидетельствовать о трансмуральной ишемии миокарда, распространяющейся на все слои стенки ЛЖ, включая и субэпикардиальные ее отделы (рис. 3.138). Подъем сегмента RS-T может развиться, например, при спазме КА, индуцированном физической нагрузкой, а также при выраженном стенозировании КА или хронической аневризме ЛЖ, сопровождающихся критическим снижением коронарного кровотока. В этих последних случаях подъем сегмента RS-T часто сочетается с признаками нарушения сегментарной сократимости ЛЖ (дискинезия, акинезия или гипокинезия отдельных сегментов).
Отрицательная проба диагностируется в тех случаях, когда пациент при проведении исследования достиг заданной возрастной ЧСС, однако клинические и электрокардиографические признаки ишемии миокарда отсутствуют. Сомнительная проба диагностируется в следующих случаях: 1. если в процессе исследования развился типичный для стенокардии или атипичный болевой синдром в грудной клетке, не сопровождающийся объективными ишемическими признаками на ЭКГ; 2. если наблюдается горизонтальное, косонисходящее или медленно восходящее смещение сегмента RS-T менее 1,0 мм от исходного уровня; 3. если во время исследования обнаружены нарушения ритма и проводимости (частая или политопная экстрасистолия, преходящие нарушения атриовентрикулярной или внутрижелудочковой проводимости, появление пароксизмов суправентрикулярной или желудочковой тахикардии); 4. если на высоте нагрузки произошло падение АД на 20 мм рт. ст. и более от исходного уровня. Неинформативной (незавершенной) называют такую пробу, которая не была доведена до заданной возрастной ЧСС и не сопровождалась появлением описанных выше клинических или электрокардиографических признаков ишемии или дисфункции миокарда. Следует подчеркнуть, что различные изменения морфологии зубца Т, в том числе отрицательные зубцы Т, нередко наблюдаются во время нагрузки у больных без поражения КА и даже у здоровых людей и не могут, таким образом, служить критерием ишемии. Чувствительность проб с дозированной физической нагрузкой, проводимых с целью диагностики ишемической болезни сердца колеблется от 62% до 80%, специфичность — от 83% до 96% (Б. А. Сидоренко с соавт., 1996). Ложноположительные результатыпробы с физической нагрузкой могут выявляться у 17% больных и здоровых лиц без поражения КА, причем у женщин частота ложноположительных результатов пробы значительно выше, чем у мужчин (Д. М. Аронов с соавт., 1995). Наиболее частыми причинами ложноположительных результатов пробы являются: 1. Нейроциркуляторная дистония (преимущественно нарушения симпатической иннервации, влияющие на процесс реполяризации). 2. Заболевания, сопровождающиеся выраженной гипертрофией миокарда ЛЖ. 3. Пролапс митрального клапана. 4. Заболевания и синдромы, сопровождающиеся значительными нарушениями электролитного баланса. 5. Синдромы CLC и WPW. 6. Блокады ножек пучка Гиса. 7. Анемии различного генеза (гипоксия миокарда). 8. Хронические заболевания легких, сопровождающиеся выраженной дыхательной недостаточностью (гипоксия миокарда). 9. Прием некоторых лекарственных препаратов (сердечных гликозидов, мочегонных, эстрогенов и др.). Частота ложноотрицательных результатов пробы с дозированной физической нагрузкой у больных ИБС достигает 20-38%. На рис. 3.139 представлена ЭКГ, зарегистрированная у больного ИБС с типичной положительной велоэргометрической пробой.
Дипиридамоловый тест Проба с дипиридамолом (курантилом) применяется с целью выявления коронарной недостаточности, особенно в тех случаях, когда по разным причинам невозможно проведение пробы с дозированной физической нагрузкой. Внутривенное относительно быстрое введение больших доз дипиридамола, являющегося мощным вазодилататором, приводит к значительному расширению артериол в зонах непораженных коронарных артерий, тогда как артериолы в бассейне стенозированных коронарных сосудов расширяются в значительно меньшей степени. Это приводит к патологическому перераспределению крови в различных участках сердечной мышцы: усиливается кровоснабжение интактных участков миокарда и уменьшается коронарный кровоток по стенозированным коронарным артериям (феномен «межкоронарного обкрадывания»). В результате возникают участки ишемии сердечной мышцы, локализация которых в целом хорошо соответствует бассейнам кровоснабжения пораженных коронарных сосудов. Перед проведением теста следует отменить прием лекарственных препаратов и пищевых продуктов, содержащих ксантиновые производные (эуфиллин, теофиллин, кофе, крепкий чай и т. п.). Дипиридамол вводят внутривенно в дозе 0,75 мг на 1 кг массы тела, что составляет обычно 10–12 мл 0,5% раствора. Чаще всего расчетную дозу препарата делят на 3 равные части, которые вводят в 3 этапа. В течение первых трех минут вводят первую треть дозы, затем в течение следующих 3–5 мин — вторую треть. Если к этому времени не появятся клинические или/и электрокардиографические признаки ишемии миокарда, на протяжении следующих 3–5 мин вводят последнюю треть дозы. Дипиридамоловую пробу осуществляют под постоянным ЭКГ-контролем. При отсутствии признаков ишемии миокарда ЭКГ регистрируют еще 10, 15 и 20 мин после окончания введения препарата. Исследование завершают внутривенным введением 10 мл 2,4% раствора эуфиллина, который является физиологическим антагонистом дипиридамола. Критерии положительного дипиридамолового теста те же, что и при проведении пробы с дозированной физической нагрузкой: ишемическая депрессия или элевация сегмента RS-T на 1,0 мм и больше от исходного уровня. Введение дипиридамола может сопровождаться небольшой тахикардией, снижением АД, головной болью, тяжестью в нижних конечностях. Чувствительность дипиридамолового теста составляет 60–75%, специфичность – 70–90%. Проба с изопротеренолом Изопротеренол (изадрин, изупрел) обладает, как известно, выраженным b-адреностимулирующим действием. При введении препарата увеличивается ЧСС, повышается АД, значительно увеличивается работа сердца и, соответственно, потребность миокарда в кислороде. В условиях лимитированного коронарного кровоснабжения это приводит к возникновению преходящей ишемии миокарда. Изопротеренол в дозе 0,5 мг вводят внутривенно капельно в 200 мл изотонического раствора натрия хлорида. В течение первой минуты препарат вводят со скоростью 10—20 капель в мин. В течение последующих 2–3 мин скорость введения изопротеренола повышают, доводя ЧСС до 130–150 в мин, после чего введение препарата прекращают. Для диагностики преходящей ишемии миокарда используют те же критерии, что и при проведении проб с дозированной физической нагрузкой и дипиридамолового теста. Чувствительность пробы с изопротеренолом составляет 60–70%, специфичность — 70–90%. Проба используется в основном для диагностики ИБС у больных, у которых выполнение интенсивной физической нагрузки по разным причинам невозможно. Проба с эргометрином Проба с эргометрином, являющегося стимулятором a-адренорецепторов, используется в основном для подтверждения спастического механизма коронарной недостаточности, в частности, у больных ИБС, у которых во время коронароангиографии не обнаруживается стенозирование КА, а клиническая картина заставляет заподозрить вазоспастическую форму стенокардии (стенокардия Принцметала). Проба с эргометрином опасна развитием тяжелых осложнений (ИМ, внезапная смерть, желудочковые аритмии), в связи с чем она используется для диагностики ИБС только в специализированных научно-исследовательских учреждениях (Д. М. Аронов с соавт., 1996). Использование длительного мониторирования ЭКГ по Холтеру и чреспищеводной электростимуляции сердца для диагностики ишемической болезни сердца описано ниже. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Длительное мониторирование ЭКГ по Холтеру
В последние годы широкое распространение в клинической практике получило длительное мониторирование ЭКГ по Холтеру. Метод применяется в основном для диагностики преходящих нарушений ритма сердца, выявления ишемических изменений ЭКГ у больных ИБС, а также для оценки вариабельности сердечного ритма. Существенным преимуществом метода является возможность длительной (в течение 1–2 суток) регистрации ЭКГ в привычных для пациента условиях.
Прибор для длительного мониторирования ЭКГ по Холтеру состоит из системы отведений, специального устройства, регистрирующего ЭКГ на магнитную ленту, и стационарного электрокардиоанализатора (рис. 3.140). Миниатюрное регистрирующее устройство и электроды укрепляются на теле пациента. Обычно используют от двух до четырех прекардиальных биполярных отведений, соответствующих, например, стандартным позициям грудных электродов V1 и V5 (рис. 3.141). Запись ЭКГ проводится на магнитной ленте при очень малой скорости ее движения (25–100 мм х мин–1). При проведении исследования пациент ведет дневник, в который вносятся данные о характере выполняемой пациентом нагрузки и о субъективных неприятных ощущениях больного (боли в области сердца, одышка, перебои, сердцебиения и др.) с указанием точного времени их возникновения.
После окончания исследования кассету с магнитной записью ЭКГ помещают в электрокардиоанализатор, который в автоматическом режиме осуществляет анализ сердечного ритма и изменений конечной части желудочкового комплекса, в частности, сегмента RS-T. Одновременно производится автоматическая распечатка эпизодов суточной ЭКГ, квалифицированных прибором как нарушения ритма или изменения процесса реполяризации желудочков. В современных системах для длительного мониторирования ЭКГ по Холтеру предусмотрено представление данных на специальной бумажной ленте в сжатом компактном виде, что позволяет получить наглядное представление о наиболее существенных эпизодах нарушений ритма сердца и смещений сегмента RS-T. Информация может быть представлена также в цифровом виде и в виде гистограмм, отражающих распределение в течение суток различных частот сердечного ритма, длительности интервала Q-T и/или эпизодов аритмий (рис. 3.142).
Оценка вариабельности сердечного ритма. На рис. 3.143 представлены гистограммы вариабельности сердечного ритма (HRV — heart rate variability), полученные у больных нейроциркулярной дистонией при компьютерном анализе интервалов R-R, зарегистрированных в течение суток. Анализ HRV является важным объективным методом оценки вегетативной нервной регуляции сердца, что имеет важное практическое значение не только у пациентов с нейроциркулярной дистонией, но и у лиц, перенесших ИМ, больных с недостаточностью кровообращения, кардиомиопатиями и другими заболеваниями сердца.
Выявление аритмий. Использование длительного мониторирования ЭКГ по Холтеру является частью обязательной программы обследования больных с нарушениями ритма сердца или с подозрением на наличие таких нарушений. Наибольшее значение этот метод имеет у пациентов с пароксизмальными аритмиями. Метод позволяет: 1. Установить факт возникновения пароксизмальных нарушений ритма сердца и определить их характер и продолжительность, поскольку у многих больных сохраняются относительно короткие эпизоды пароксизмов аритмий, которые в течение длительного времени не удается зафиксировать с помощью классического ЭКГ-исследования. 2. Изучить корреляцию между пароксизмами нарушений ритма и субъективными и объективными клиническими проявлениями болезни (перебои в работе сердца, сердцебиения, эпизоды потери сознания, немотивированной слабости, головокружений и т. п.). 3. Составить ориентировочное представление об основных электрофизиологических механизмах пароксизмальных нарушений ритма сердца, так как всегда имеется возможность зарегистрировать начало и конец приступа аритмий. 4. Объективно оценить эффективность проводимой противоаритмической терапии. На рис. 3.142, а, б показаны записи коротких эпизодов желудочковой пароксизмальной тахикардии и частой ЖЭ. На рис. 3.144 приведен пример использования длительного ЭКГ-мониторирования по Холтеру для диагностики различных нарушений ритма у больного ИБС. Вверху показан график изменений частоты сердечных сокращений, зарегистрированной в течение суток (рис. 3.144, а). Хорошо видны два относительно непродолжительных эпизода повышения ЧСС до 160 и 150 ударов в мин, сопровождавшиеся ощущением сердцебиения, общей слабости, головокружения и болями в области сердца. На рис. 3.144, б представлена ЭКГ, зарегистрированная во время одного из таких эпизодов, характер изменений которой позволил диагностировать наличие у больного пароксизмальной мерцательной тахиаритмии.
На рис. 3.145 представлены результаты анализа холтеровского мониторирования ЭКГ у больного с периодически возникающими эпизодами резкой слабости и головокружения. При оценке суточной ЭКГ и сопоставлении с клиническими данными удалось связать эти эпизоды с преходящей синоаурикулярной блокадой II степени типа Мобитц с последовательным выпадением 3–4 комплексов P-QRST.
На рис. 3.146 представлены фрагменты ЭКГ, зарегистрированной у больного ИБС с постинфарктным кардиосклерозом во время одного из эпизодов кратковременной потери сознания. На нескольких фрагментах видно последовательное возникновения атриовентрикулярной блокады I степени, затем II степени и, наконец, III степени (полной). Эпизод синкопального состояния расценен как проявление синдрома Морганьи-Адамса-Стокса.
Длительное мониторирование ЭКГ по Холтеру у больных ИБС используется для регистрации преходящих изменений реполяризации желудочков и нарушений ритма сердца. У большинства больных ИБС метод холтеровского мониторирования ЭКГ позволяет получить дополнительные объективные подтверждения временной преходящей ишемии миокарда в виде депрессии или/и элевации сегмента RS-T, часто сопровождающихся изменениями ЧСС и АД. Важно, что непрерывная запись ЭКГ проводится в условиях обычной для данного пациента активности. В большинстве случаев это дает возможность изучить взаимосвязь эпизодов ишемических изменений ЭКГ с разнообразными клиническими проявлениями болезни, в том числе и атипичными. Чувствительность и специфичность диагностики ИБС с помощью метода суточного мониторирования ЭКГ по Холтеру зависит прежде всего от выбранных критериев ишемических изменений конечной части желудочкового комплекса. Обычно используются те же объективные критерии преходящей ишемии миокарда, что и при проведении нагрузочных тестов, а именно: смещение сегмента RS-T ниже или выше изоэлектрической линии на 1,0 мм и более при условии сохранения этого смещения на протяжении 80 мс от точки соединения (j). Продолжительность диагностически значимого ишемического смещения сегмента RS-T при этом должна превышать 1 мин. Еще более надежным и высокоспецифичным признаком ишемии миокарда является горизонтальная или косонисходящая депрессия сегмента RS-T на 2 мм и более, выявляемая на протяжении 80 мс от начала сегмента. В этих случаях диагноз ИБС практически не вызывает сомнений даже при отсутствии в этот момент приступа стенокардии. Длительное мониторирование ЭКГ по Холтеру является незаменимым методом исследования для выявления эпизодов так называемой бессимптомной ишемии миокарда, которые обнаруживаются у большинства больных ИБС и не сопровождаются приступами стенокардии. Кроме того, следует помнить, что у некоторых больных с верифицированной ИБС смещение сегмента RS-T во время повседневной жизненной активности всегда возникает бессимптомно. Согласно результатам некоторых исследований преобладание у пациентов с документированной ИБС бессимптомных эпизодов ишемии миокарда является весьма неблагоприятным прогностическим признаком, свидетельствующим о высоком риске острых повторных нарушений коронарного кровотока (нестабильной стенокардии, острого инфаркта миокарда, внезапной смерти). Особенно большое значение метод холтеровского ЭКГ-мониторирования имеет в диагностике так называемой вариантной стенокардии Принцметала (вазоспастической стенокардии), в основе которой лежит спазм и кратковременное повышение тонуса коронарной артерии. Прекращение или резкое уменьшение коронарного кровотока обычно приводит к глубокой, часто трансмуральной, ишемии миокарда, падению сократимости сердечной мышцы, асинергии сокращений и значительной электрической нестабильности миокарда, проявляющейся нарушениями ритма и проводимости. На ЭКГ во время приступов вариантной стенокардии Принцметалла чаще наблюдается внезапный подъем сегмента RS-T выше изолинии (трансмуральная ишемия), хотя в отдельных случаях может встречаться и его депрессия (субэндокардиальная ишемия) (рис. 3.147). Важно, что эти изменения сегмента RS-T, так же как и приступы стенокардии, развиваются в покое, чаще ночью, и не сопровождаются (по крайней мере, в начале приступа) увеличением ЧСС более, чем на 5 ударов в минуту. Это принципиально отличает вазоспастическую стенокардию от приступов стенокардии напряжения, обусловленных повышением потребности миокарда в кислороде. Мало того, приступ вазоспастической стенокардии и ЭКГ-признаки ишемии миокарда могут исчезнуть, несмотря на увеличение ЧСС, обусловленное рефлекторной реакцией на боль, пробуждение и/или прием нитроглицерина (феномен «прохождения через боль»).
Непрерывная запись ЭКГ позволяет выявить еще один важный отличительный признак стенокардии Принцметалла: смещение сегмента RS-T в начале приступа происходит очень быстро, скачкообразно и так же быстро исчезает после окончания спастической реакции. Для стенокардии напряжения, наоборот, характерно плавное постепенное смещение сегмента RS-T при повышении потребности миокарда в кислороде (увеличении ЧСС) и столь же медленное возвращение его к исходному уровню после купирования приступа. Следует упомянуть еще об одной области применения холтеровского ЭКГ-мониторирования, результаты которого могут использоваться для оценки эффективности антиангинальной терапии у больных ИБС. При этом учитывают количество и общую продолжительность зарегистрированных эпизодов ишемии миокарда, соотношение числа болевых и безболевых эпизодов ишемии, число нарушений ритма и проводимости, возникающих в течение суток, а также суточные колебания ЧСС и другие признаки. Особое внимание следует обращать на наличие пароксизмов бессимптомной ишемии миокарда, поскольку известно, что у некоторых больных, прошедших курс лечения, наблюдается уменьшение или даже исчезновение приступов стенокардии, но сохраняются признаки безболевой ишемии сердечной мышцы. Повторные исследования с помощью холтеровского мониторирования ЭКГ особенно целесообразны при назначении и подборе дозы блокаторов b-адренорецепторов, влияющих, как известно, на ЧСС и проводимость, поскольку индивидуальную реакцию на эти препараты трудно предсказать и не всегда легко выявить с помощью традиционного клинического и электрокардиографического методов исследования. Чреспищеводная электрическая стимуляция сердца Чреспищеводная электрическая стимуляция сердца (ЧПЭС) — неинвазивный метод исследования, который используется для диагностики скрытой коронарной недостаточности у больных ИБС, изучения характера и электрофизиологических механизмов нарушений ритма сердца, а также для купирования пароксизмальных наджелудочковых тахиаритмий. Сущность метода заключается в регулируемом увеличении числа сердечных сокращений (ЧСС) путем навязывания искусственного ритма электрической стимуляцией предсердий. Для этого используется гибкий биполярный электрод-катетер, который вводится через нос или рот в пищевод на глубину примерно 45 см и устанавливается на уровне предсердий. Электрод позволяет регистрировать внутрипищеводную ЭКГ, поэтому при его установке ориентируются на появление максимальной амплитуды зубца Р пищеводной ЭКГ. Ниже приведена техника ЧПЭС, используемой для выявления скрытой коронарной недостаточности. Регулируемое увеличение ЧСС значительно повышает работу сердца и потребность миокарда в кислороде, что в условиях лимитированного коронарного кровотока у больных ИБС может приводить к развитию приступа стенокардии и/или появлению на поверхностной ЭКГ ишемических изменений. После регистрации исходной ЭКГ в 12 отведениях начинают чреспищеводную электрическую стимуляцию сердца. По достижении стабильной ЧСС в 100 уд/мин ступенеобразно (через каждые 1–2 минуты) увеличивают темп навязываемых сердечных сокращений на 15–20 уд/мин. При хорошей переносимости пробы и отсутствии ишемических изменений на ЭКГ достигают ЧСС 160 уд/мин, удерживая такой темп сердечных сокращений в течение 10 мин, после чего отключают электрокардиостимулятор, восстанавливая исходный синусовый ритм. Естественно, чреспищеводная электростимуляция сердца может быть прекращена «досрочно» при появлении клинических или/и электрокардиографических признаков возникновения ишемии миокарда. Пробу с ЧПЭС проводят под постоянным контролем ЭКГ на экране осциллоскопа, уровня АД и состояния пациента. ЭКГ регистрируют в конце каждой минуты исследования. Оценку результатов исследования проводят по тем же принципам, что и при проведении теста с дозированной физической нагрузкой. Если при 10-минутном навязывании ритма с частотой 160 сокращений в минуту отсутствуют клинические и/или электрокардиографические признаки преходящей ишемии миокарда, проба считается отрицательной. Следует подчеркнуть, что чувствительность метода чреспищеводной электростимуляции сердца для диагностики ИБС ниже, чем теста с дозированной физической нагрузкой, поскольку степень увеличения потребности миокарда в кислороде при искусственном навязывании ритма сердечных сокращений существенно меньше, чем при выполнении физической нагрузки. Применение метода ЧПЭС для диагностики ИБС показано в основном в тех случаях, когда проба с дозированной физической нагрузкой не может быть проведена в связи с заболеваниями опорно-двигательного аппарата, выраженной сердечной или дыхательной недостаточностью, наличием тромбофлебита или облитерирующего атеросклероза артерий нижних конечностей, а также у малотренированных больных, у которых невозможно достижение максимальной или субмаксимальной ЧСС при выполнении физической нагрузки. ЧПЭС противопоказана при заболеваниях пищевода, а также при наличии мерцательной аритмии, атриовентрикулярной блокады II–III степени, блокады левой ножки пучка Гиса и синдрома WPW. Электрография пучка Гиса Регистрация электрограммы пучка Гиса относится к числу высокоинформативных инвазивных методов электрофизиологического исследования, который используется для уточнения локализации атриовентрикулярной блокады, характера пароксизмальных тахиаритмий, источника и механизмов эктопических нарушений ритма и т. п. Метод позволяет измерить скорость проведения электрического импульса по различным участкам проводящей системы сердца. Для записи электрограммы пучка Гиса в правые отделы сердца вводят биполярный катетер-электрод, который устанавливают на уровне медиальной створки трехстворчатого клапана (рис. 3.148). При этом один электрод находится в предсердии, а другой в правом желудочке. Оба электрода соприкасаются с той частью перегородки, в которой находится общий ствол пучка Гиса. После фильтрации и усиления сигнал от электродов подается на регистрирующее устройство, с помощью которого осуществляется запись электрограммы пучка Гиса. Одновременно регистрируют стандартные отведения ЭКГ.
На рис 3.149 представлена нормальная электрограмма пучка Гиса (HBE), которая состоит из трех групп осцилляций, каждая из которых соответствует активации определенного отдела проводящей системы (рис. 3.150): 1) группа осцилляций А, отражающих деполяризацию нижней части предсердий; 2) группа осцилляций H, обусловленных активацией общего ствола пучка Гиса; 3) группа осцилляций V, вызванных деполяризацией миокарда желудочков.
Сопоставление электрограммы пучка Гиса с зубцом Р стандартной ЭКГ позволяет количественно оценить ряд временных интервалов: Интервал Р-А (от начала зубца Р ЭКГ до начала группы осцилляций А на НВЕ) отражает время проведения электрического импульса по предсердиям. Интервал А-Н (от начала осцилляций А до начала осцилляций Н) соответствует времени проведения по АВ-соединению. Интервал Н (продолжительность осцилляций группы Н) отражает время проведения по общему стволу пучка Гиса. Интервал Н-V (от начала осцилляций Н до первых отклонений желудочкового комплекса) соответствует проведению импульса по пучку Гиса, его ветвям и волокнам Пуркинье. В табл. 3.11 представлены нормальные значения указанных интервалов. Таблица 3.11 Нормальные значения интервалов электрограммы
Использование метода электрографии пучка Гиса позволяет уточнить локализацию атриовентрикулярной блокады. В зависимости от уровня блокирования электрического импульса в атриовентрикулярной системе М. С. Кушаковский и Н. Б. Журавлева выделяют 5 типов АВ-блокад (табл. 3.12). Таблица 3.12 Топографическая классификация АВ-блокад (по М. С. Кушаковскому и Н. Б. Журавлевой)
Характерно, что каждый из этих типов может достигать различной степени блокирования электрического импульса (от I до III степени) и, наоборот, каждой из трех степеней блокады может соответствовать разный уровень нарушения проводимости. Так, при АВ-блокаде I степени в половине случаев наблюдается узловая форма блокады, проявляющаяся увеличением интервала А-Н электрограммы пучка Гиса больше 120 мс, тогда как интервалы Р-А и Н-V имеют нормальную продолжительность (рис. 3.151, а). Часто встречается также трехпучковая АВ-блокада I степени, для которой характерно увеличение H-V-интервала больше 55 мс (рис. 3.151, б). При стволовом типе АВ-блокады I степени наблюдается увеличение продолжительности группы осцилляций Н (Н1, Н2) больше 20 мс, а при комбинированной блокаде — удлинение интервалов А-Н и H-V.
Такая же картина может наблюдаться при АВ-блокаде II степени, проявляющейся периодическим выпадением желудочкового комплекса. Наиболее часто встречающийся узловой тип блокады характеризуется увеличением интервала А-Н электрограммы пучка Гиса (рис. 3.152, а), тогда как при редко встречающейся стволовой АВ-блокаде II степени наблюдается увеличение продолжительности группы осцилляций Н (Н1, Н2) (рис. 3.152, б).
Полная АВ-блокада III степени чаще носит характер трехпучковой блокады, хотя блокирование электрического импульса может происходить и на уровне АВ-соединения (узловой тип) и общего ствола пучка Гиса (стволовой тип). Таким образом, уточнение локализации атриовентрикулярной блокады I–III степени с помощью электрографии пучка Гиса позволяет лучше понять конкретные механизмы, вызвавшие нарушение проводимости, и оценить прогноз заболевания. Однако следует помнить, что эта важная информация, получаемая с помощью сложного инвазивного метода исследования, не должна являться самоцелью. Проведение этого дополнительного исследования может быть оправдано только в том случае, если решается вопрос показаний к оперативному вмешательству, например у больных с постинфарктным кардиосклерозом и хронической аневризмой левого желудочка, осложненными прогрессирующей сердечной недостаточностью и/или тяжелыми нарушениями ритма и проводимости, требующими хирургической коррекции.
 Мы поможем в написании ваших работ! |