Преобразование тепловой энергии продуктов сгорания в механическую работу.
Для совершения полезной работы должно происходить расширение газа, в данном случае продуктов сгорания. В тепловых двигателях расширение происходит в их рабочих органах: в соплах, сопловых аппаратах, рабочих цилиндрах, на лопатках турбин и т.д. Учитывая скоротечность реакции горения по сравнению с длительностью процессов расширения, принимаем, что зона химических реакций ограничена камерой сгорания, а при расширении изменяются только теплофизические параметры газовой смеси, т.е. за пределами камеры сгорания Iхим= const. Причем само расширение газа происходит при постоянной энтропии - ( изоэнтропно). Совершаемая при этом единицей массы рабочего тела работа, определится разностью энергосодержаний газовых смесей после и до процесса расширения. Это положение следует из первого закона термодинамики:
∑Li=∆I =Qр.
∑Li– суммарная работа, совершаемая при расширении рабочего тела.
Полное энергосодержание потоков газа характеризуется энтальпией торможения, учитывающей кинетическую энергию его движения.термохимических превращений, определяемых как горение топлива.
Горение топлива – это быстрая реакция окисления, в ходе которой его химическая энергия превращается в основном в тепловую, а само топливо – главным образом в газообразные продукты. ВРД, предназначены для работы в атмосфере Земли и поэтому в качестве окислителя используют кислород, содержащийся в атмосферном воздухе. Наиболее распространенными на Земле горючими элементами являются водород и углерод, причем как в виде индивидуальных веществ, так и в виде весьма разнообразных совместных химических соединений.
|
|
|
Количество кислорода, теоретически необходимое для полного окисления горючих элементов, можно определить по уравнениям реакций окисления. Так, для углерода и водорода:
уравнения реакций C+O2 → CO2, H2 + 0,5 О2 → Н2О;
молекулярные массы 12,01+32 →44,01 2,16 + 0,5(32) →18,16
Для первой реакции на 1 кг углерода идет 32: 12,01 =2,66 кг кислорода, а для второй на 1 кг водорода – 16 : 2,016 =7,94 кг кислорода, что примерно в три раза больше.
Количественные соотношения, в которых вещества реагируют друг с другом без остатка, называются стехиометрическими. Они характеризуются стехиометрическим коэффициентом 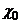 = ( кг окислителя) / (кг горючего). При таком отношении реагирующих веществ полностью взаимно удовлетворяются их свободные валентности, и образуется устойчивое химическое соединение, например вода или углекислый газ.
= ( кг окислителя) / (кг горючего). При таком отношении реагирующих веществ полностью взаимно удовлетворяются их свободные валентности, и образуется устойчивое химическое соединение, например вода или углекислый газ.
Чтобы определить, количество кислорода потребное для полного сгорания 1 кг топлива сложного состава, нужно знать его элементный состав, т. е. содержание в нем горючих элементов ([С], [Н] и т. д.), а также кислорода [О], если он содержится в горючем веществе:
|
|
|
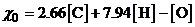 .
.
Например, для сгорания 1 кг углеводородного реактивного топлива, состоящего из 0,86 кг углерода и 0,14 кг водорода, необходимо кислорода
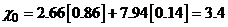 кг.
кг.
В воздушно-реактивных и поршневых двигателях для сжигания топлива используется атмосферный воздух, 1 кг которого содержит 0.231 кг кислорода. Следовательно, потребное количество воздуха (lо) для полного сгорания 1 кг топлива
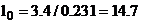 кг
кг
Чем больше водорода в углеводородном топливе, тем больше кислорода нужно для полного сгорания топлива и тем меньшим будет плотность продуктов сгорании.
Реальный состав горючей смеси в двигателях обычно отличается от стехиометрического. Его принято выражать коэффициентом избытка воздуха 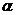 , представляющим собой отношение действительной массы воздуха в смеси к стехиометрической:
, представляющим собой отношение действительной массы воздуха в смеси к стехиометрической:
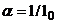
где l – действительное количество воздуха, приходящееся на 1 кг топлива.
При 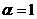 (стехиометрическая смесь) обеспечивается полное сгорание топлива без остатка избыточного окислителя. При
(стехиометрическая смесь) обеспечивается полное сгорание топлива без остатка избыточного окислителя. При 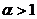 (бедная смесь) после полного окисления горючего остается избыток окислителя. При
(бедная смесь) после полного окисления горючего остается избыток окислителя. При 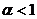 (богатая смесь) из-за недостатка окислителя происходит неполное сгорание топлива. В реальных процессах горения топлив для достижения наибольшего энерговыделения, или для получения приемлемой температуры продуктов сгорания довольно часто задается значение
(богатая смесь) из-за недостатка окислителя происходит неполное сгорание топлива. В реальных процессах горения топлив для достижения наибольшего энерговыделения, или для получения приемлемой температуры продуктов сгорания довольно часто задается значение 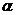 , отличное от единицы.
, отличное от единицы.
|
|
|
Эффективность горения определяется рядом показателей:
- теплотой сгорания топлив;
- температурой продуктов сгорания;
- молекулярным весом и составом продуктов сгорания;
- теплоемкостью продуктов сгорания и показателем адиабаты;
- скоростью и полнотой сгорания;
- коррозионной активностью продуктов сгорания
Теплота сгорания топлив – это количество тепловой энергии, выделяемое при полном сгорании 1 кг топлива. Единицей теплоты сгорания является килоджоуль на килограмм (кДж/кг).
Теплота сгорания топлива зависит от его химического состава, т. е. от элементного состава и от прочности связей в молекулах топлива и продуктов окисления.
Из элементов, входящих в состав углеводородного топлива, наибольшей теплотой сгорания обладает водород – 143000 кДж/кг, теплота сгорания углерода – 32500 кДж/кг. Углеводородные топлива занимают соответственно промежуточные по теплоте сгорания значения, причем, чем больше водорода содержится в топливе, тем выше теплота его сгорания.
|
|
|
Различают высшую и низшую теплоту сгорания. Высшей теплотой сгорания называют все тепло, выделяющееся при сгорании 1 кг топлива. На практике часть продуктов сгорания, например вода, покидает двигатель в газообразном состоянии и достигает стандартной температуры уже вне его. В этом случае часть тепловой энергии выделяющееся при конденсации паров воды из продуктов сгорания не участвует в полезной работе, что учитывается значением низшей теплоты сгорания. При прочих равных условиях большее значение теплоты сгорания обеспечивает большую дальность полета ВС.
Для оценки качества преобразования теплоты сгорания в полезную работу удобно воспользоваться произведением R2T2, как мерой работоспособности продуктов сгорания.
Дата добавления: 2021-01-20; просмотров: 109; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
