Энтальпия топлива и продуктов сгорания.
Лекция 2 Горение топлива
ПРОЦЕССЫ ВОСПЛАМЕНЕНИЯ И ГОРЕНИЯ ТОПЛИВА
2.1 Сущность горения
2.2 Воспламенение
2.3 Виды горения и механизм распространения пламени.
2.4 Теплота сгорания топлива.
2.5 Энтальпия топлива и продуктов сгорания.
2.6 Преобразование тепловой энергии продуктов сгорания в механическую работу
2.7
2.8 ПОТРЕБНОЕ КОЛИЧЕСТВО ОКИСЛИТЕЛЯ
2.9 Стехиометрический коэффициент элементов
2.10 Стехиометрический коэффициент сложных горючих
2.11 Коэффициент избытка окислителя
2.1 Сущность горения
Горение представляет собой физико-химическийпроцесс, при котором превращение реагирующих веществ сопровождается изменением их химического, а в ряде случаев и агрегатного строения и частичным переходом химической энергии межатомных или межмолекулярных связей в тепловую форму. Для протекания такой реакции необходимо наличие двух групп веществ: горючего и окислителя. По химической сути горение представляет окислительную реакцию, при которой внешние электроны атомов элемента-горючего переходят к атомам элемента-окислителя. Сущность окисления заключается в переходе валентных (внешних) электронов от атомов горючего элемента к атомам элемента-окислителя. Приобретая в результате этого положительный заряд, атомы горючего притягиваются к отрицательно заряженным атомам элемента-окислителя. Реакция данного типа способна протекать с прогрессирующим самоускорением обусловленным накоплением выделяющегося тепла или в следствии образования активных промежуточных продуктов. Она будет протекать вплоть до образования устойчивых при данных условиях химических соединений таких как, например, вода или углекислый газ. Непрерывное протекание реакции горения требует интенсивного тепломассобмена реагирующих веществ.Такие условия имеются только в газовойсреде, их нет в жидких и твердых телах. Т.е. жидкое и твердое топливо сначала должно газифицироваться посредством испарения.сублимации или разложения и лишь после этого возможно горение.
|
|
|
2.2 Воспламенение
Воспламенение является начальной стадией горения, в течение которой энергия, подводимая к системе от внешнего источника, приводит к резкому ускорению химической реакции из-за прогрессивного накопления тепла (тепловое воспламенение.) или активных промежуточных веществ (цепное воспламенение). Возможны два предельных режима теплового воспламенения: самовоспламенение и зажигание.
Самовоспламенение обычно приводит к объемному горению, которое начинается в центре объема и распространяется к периферии. Характеризуется быстрым химическим превращением веществ и соответствующим тепловыделением.
|
|
|
 Зажигание. Происходит в результате нагревания вещества от высокотемпературного источника тепла - накаленного тела, пламени, электрической. искры и др. При достаточной мощности источника воспламенения подводимое тепло не успевает равномерно распределиться по всему объему, что приводит к разогреву близлежащего слоя веществадо температуры начала реакции. Начало реакции сопровождается дальнейшим ростом температуры и выделением тепла, что в свою очередь инициирует разогрев и воспламенение все более удаленных слоевс образованием волны горения... При этом реакциягорения может развиваться как по тепловому, так и по цепному механизму.
Зажигание. Происходит в результате нагревания вещества от высокотемпературного источника тепла - накаленного тела, пламени, электрической. искры и др. При достаточной мощности источника воспламенения подводимое тепло не успевает равномерно распределиться по всему объему, что приводит к разогреву близлежащего слоя веществадо температуры начала реакции. Начало реакции сопровождается дальнейшим ростом температуры и выделением тепла, что в свою очередь инициирует разогрев и воспламенение все более удаленных слоевс образованием волны горения... При этом реакциягорения может развиваться как по тепловому, так и по цепному механизму.
2.3 Виды горения и механизм распространения пламени.
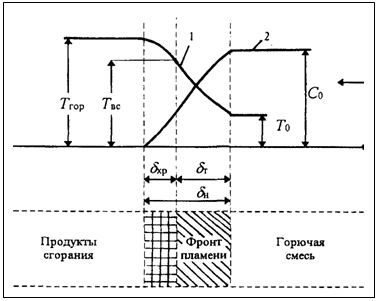
. Горение, как физико-химическое превращение вещества, происходит в ограниченном пространстве (фронте пламени) с определенной скоростью (рис. 2.1).
Рис. 2.1. Схема фронта пламени при ламинарном горении однородных смесей.
1 — изменение температуры;
2 — изменение концентрации исходных продуктов;
Твс— температура воспламенения;
Тгор — температура горения;
δхр — ширина зоны химической реакции;
δт — ширина зоны топлива;
|
|
|
δп, — ширина зоны пламени; Un— нормальная скорость распространения пламени.
Различают диффузионное и кинетическое горение.
Диффузионное горение имеет место тогда, когда скорость подачи реагирующих веществ в зону горения значительно ниже скорости химического превращения топлива. В этом случае скорость процесса определяется преимущественно гидродинамическими факторами и зависит от свойств топлива.
Кинетическое горение имеет место, когда скорость процесса горения в основном зависит от химических свойств топлива в зоне горения, а гидродинамические факторы подготовки топлива играют меньшую роль.
По механизму распространения зоны реакции различают:
нормальное распространение пламени (тихое);
цепное, путем умножения очагов само воспламенения:;
детонационное горение (взрывное).
Нормальное распространение фронта пламени является основным и практике применения топлив в ДВС. Скорость нормального распространения пламени составляет 0,4-0,5 м/с[ ]. Механизм нормального распространения пламени обусловлен передачей теплоты и активных промежуточных продуктов реакции из зоны горения в свежую горючую смесь.
Цепной механизм распространения пламени осуществляется в результате диффузии активных продуктов из зоны реакции в свежую смесь. Распространение зоны горения путем умножения очагов самовоспламе нения можно представить как самовоспламенение частично прореагировавшей горючей смеси нагретыми продуктами сгорания в процессе турбулентного перемешивания.
|
|
|
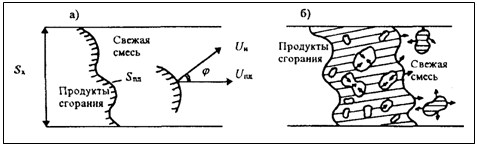 Рис. 2.2. Схема фронта пламени при турбулентном горении однородных смесей, а) малая интенсивность турбулентности;
Рис. 2.2. Схема фронта пламени при турбулентном горении однородных смесей, а) малая интенсивность турбулентности;
б) большая интенсивность турбулентности.
Турбулентность значительно увеличивает скорость горения, особенно в диффузионной области развития процесса.. Степень и интенсивность турбулентности улучшают качество распыливания, повышают скорость испарения топлива и смешения его паров с воздухом. Скорость горения может достигать значений 10-50 м/с.
Детонационное распространение пламенипроисходит при воспламенении горючей смеси вследствие сжатия ее в ударной волне. Ударная волнапроходя по горючей смеси, вызывает ее нагрев. Степень нагрева ее зависит от скорости ударной волны, температуры и давления. Если степень сжатия достаточна для воспламенения смеси, то возникает детонационная волна Детонационная волна представляет собой совместное распространение механической ударной волны с фронтом пламени. Скорость распространения детонационных волн определяется скоростью звука в данной среде и составляет от 1200 до 3500 м/с.
Теплота сгорания топлива.
Высшая и низшая теплотворность
Теплотой сгорания (теплотворностью) называется количество тепла, выделяемое при полном сгорании 1 кг топлива и охлаждении продуктов сгорания до исходной температуры (обычно 20°С). Ее определяют опытным путем, сжигая в калориметре в среде сжатого кислорода навескутоплива. Выделенную теплоту рассчитывают по нагреву воды в калориметрическом сосуде. При данном способе определения теплотворной способности топлива учитывается теплота конденсации паров воды и такая теплотворная способность называется высшей. При работе реальных двигателей пары воды вместе с другими продуктами сгорания выбрасываются в атмосферу в газообразном состоянии и если и конденсируются, то уже вне двигателя, естественно не совершая при этом никакой работы. Поэтому для характеристики топлива применяют низшую теплоту сгорания, которая меньше высшей на теплоту конденсации паров воды.
Выделение теплоты при горении в первую очередь связано с перестройкой химических связей между химическими элементами исходных и конечных продуктов реакции. Процесс перестройки заключается в первоначальном разрушении относительно слабых химических связей в молекулах горючего и окислителя и последующим образованием молекул окислов, являющихся более устойчивыми веществами и обладающих значительно более прочными связями. Разрушение химических связей является энергозатратным процессом и связан с поглощением тепла. В тоже время образование химических связей сопровождается выделением тепловой энергии.
Каждая химическая связь имеет свой энергетический потенциал, оцениваемый как количество энергии на единицу массы вещества.. Это может быть дж/кг или ккал/моль Энергетическая разность химических связей начальных и конечных веществ реакции, по закону сохранения энергии компенсируется ростом тепловой составляющей в общем энергобалансе системы. Это в итоге приводит к разогреву вновь образованных продуктов сгорания..
Энтальпия топлива и продуктов сгорания.
Величиной, характеризующей уровень энергосодержания рабочего тела является его полная энтальпия, имеющая химическую и теплофизическую составляющие:
I= Iхим+ IQ
Из условия сохранения энергии следует, что если в замкнутой изолированной системе при ее переходе из состояния 1 в состояние 2 происходят внутренние преобразования энергии, без совершения работы, то полное энергосодержание такой системы остается постоянной, перераспределяясь между ее исходными составляющими т.е.:
I1 = I2иI1хим+ I1Q= I2хим+ I2Q .
где I1 – полная энтальпия рабочей смеси (топлива и воздуха) перед началом горения.
I1= ∑(iхим+ iQ)=I1хим+ I1Q
Тепловая составляющая энтальпии I1Q определяется выражением:
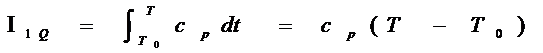
Ср – теплоемкость при постоянном давлении.
Т – текущая температура
Т0 - стандартная температура к которой приводятся теплота образования данного вещества из определенных «стандартных» веществ. Международным стандартом определено значение Т0=298,15 К0.
I2 - полная энтальпия, образовавшихся в результате химической реакции продуктов сгорания, определяемая суммой их химических энергий и теплового эквивалента эффекта реакции:
I2= ∑(iхим+ iQ)=I2хим+ I2Q .
Таким образом, из условия I1 = I2 теплота, выделившаяся в результате химической реакции горения:Qр= I2Q-I1Q= I1хим- I2хим идет на нагрев продуктов сгорания, которым и надлежит совершить работу и передать часть своей энергии посредством механического преобразователя движителю транспортного средства.
Для совершения полезной работы должно происходить расширение газа. В тепловых двигателях расширение происходит в их рабочих органах: в соплах, сопловых аппаратах, рабочих цилиндрах, на лопатках турбин и т.д. При расчете двигателей обычно принимается, что зона химических реакций ограничена камерой сгорания, а при расширении изменяются только теплофизические параметры газовой смеси, т.е. за пределами камеры сгорания Iхим = const. Причем само расширение газа происходит при постоянной энтропии - (изоэнтропно). Совершаемая при этом единицей массы рабочего тела работа, определится разностью энергосодержаний газовых смесей после и до процесса расширения. Это положение следует из первого закона термодинамики:
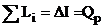 ,
,
где ∑Li – суммарная работа, совершаемая при расширении рабочего тела.
Полное энергосодержание потоков газа характеризуется энтальпией торможения, учитывающей кинетическую энергию его движения. Для газа в конце камеры сгорания (индекс 2) и на срезе сопла (индекс 3)можно записать:
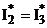 ;
; 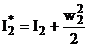 ;
; 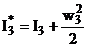
Скорость газа в самой камере сгорания w2 по отношению к скорости w3 - истечения из сопла можно принять равной нулю (w2 ≈0). Тогда:
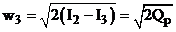
Скорость истечения газа при адиабатном процессе можно определить по известной из термодинамики зависимости:
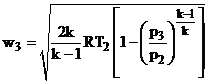
Из данного выражения следует, что скорость истечения определяется теплотой сгорания топлива, которая зависит от свойств самого топлива и режимных условий: (параметры Т, R,k) и от конструктивных возможностей двигателя: степени расширения газов (р3/р2). Для современных воздушно-реактивных двигателей степень расширения газов не превышает значения 0.025…0.033.
Дата добавления: 2021-01-20; просмотров: 617; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
