Многократный обрыв цепей на ингибиторах окисления
Лекция «Механизм антиоксидантного действия»
Схема ингибирования радикально-цепного окисления, приведена и рассмотрена в предыдущей лекции.

Ингибирование цепной вырожденно-разветвленной реакции. Если окисление протекает без инициатора, т.е. в режиме автоокисления, то оно идет савтоускорением из-за нарастающей в ходе реакции скорости инициирования(накопление гидропероксида). Темп ускорения зависит от скорости цепногоокисления, т.е. существует положительная обратная связь между процессамиавтоинициирования и цепного окисления RH. Эта связь проявляется и в ингибированном окислении органических соединений.
Если в цепной инициированной реакции, когда Vi= const, период индукции (время торможения реакции) не зависит от эффективности тормозящего действия ингибитора, а определяется его концентрацией, то при автоокислении чем эффективнее ингибитор обрывает цепи, тем он медленнее расходуется. Обусловлено это тем, что в присутствии ингибитора медленнее накапливается ROOH, а следовательно, и увеличивается период торможения. Крометого, если инициированное окисление углеводородов тормозят соединения,обрывающие цепи, то автоокисление тормозят и такие соединения, которыеразрушают гидропероксиды. Такой распад, если он не сопровождается образованием свободных радикалов, снижает концентрацию накапливающегосягидропероксида, а, следовательно, и скорость автоинициирования.
|
|
|
Для ингибированного автоокисления часто характерны критические явления, причиной которых является автокаталитический характер реакции иупоминавшаяся выше обратная связь. Поскольку гидропероксид в ходе окисления распадается, возникают два разных режима ингибированного окисления: нестационарный и квазистационарный по гидропероксиду.
Рассмотрим более детально группы ингибиторов окисления.
Фенолы и ароматические амины - эффективные ингибиторы окислительных реакций
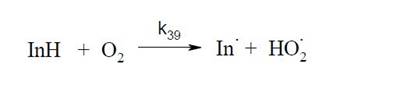
Наиболее распространенными и эффективными ингибиторами окисления являются ингибиторы окисления первой группы - фенолы и ароматические амины. Главным действующим началом антиоксидантов этой группы,обеспечивающим их способность тормозить окисление, является гидроксильная или аминогруппа группа у ароматического ядра. Энергии связей O-H и NHв фенолах и ароматических аминах относительно низкие, поэтому, образующиеся в ходе окисления радикалы RO2• насыщают свою свободную валентность путем взаимодействия с молекулой ингибитора. Врезультате на смену активным пероксирадикалам приходят малоактивные радикалы ингибитора, не способные, в общем случае, вести цепной процесс.Следствием этого является замедление или полное прекращение (если ингибитор перехватывает алкисльные радикалы R•)процесса окисления.После израсходования всего ингибитора заканчивается период индукции, и реакцияокисления развивается практически с той же скоростью, что и без ингибитора.
|
|
|
Важной особенностью электронного строения антиоксидантов фенольного типа является сопряжение π-электронов ароматической системы с р-электронами неподеленной пары электронов атома кислорода. В наибольшейстепени сопряжение проявляется, когда гидроксильная группа компланарна сплоскостью ароматического кольца. о-Алкильное замещение вызывает некоторое нарушение компланарности, что приводит к существенным изменениямфизико-химических свойств фенолов. Прочность связи О-Н (DOH) для различных фенолов можно найти в справочниках. При сравнении значений DOH длязамещенных в кольце фенолов - фенола (370 кДж⋅моль-1), 2,6-диметилфенола(354 кДж⋅моль-1), 2,6-дитретбутилфенола (343 кДж⋅моль-1) видно, что особенно сильные изменения в молекуле наблюдаются, когда орто-положения замещены объемными трет-алкильными группами. Нарушение компланарностиприводит к некоторому изменению связи О-Н и, как следствие, к снижению еепрочности.
|
|
|
Влияние природы заместителей на реакционную способность фенолов исоответствующих радикалов будет двояким: с одной стороны – увеличениеобъема о-алкильных заместителей снижает прочность О-Н связи, что увеличивает активность фенола в реакции с пероксирадикалом. С другой - экранирование реакционного центра объемными заместителями создает стерическиепрепятствия для подобных реакций.
Другой важный фактор, от которого зависят свойства фенолов, в томчисле их реакционная способность - распределение электронной плотности.Оно в значительной степени определяется электронодонорной (электроноакцепторной) способностью заместителей. Электронодонорные заместителиувеличивают антиоксидантную активность фенольных соединений, электроноакцепторные заместители снижают.
Реакция (k 34) - ключевая в ингибированном окислении, она определяет саму способность ароматических аминов и фенолов тормозить цепное окисление органических веществ. В результате этой реакции в окисляющейся системе снижается концентрация RO2• и, следовательно, скорость реакции продолжения цепи. Константы скорости большого числа фенолов и ароматических аминов с различными пероксидными радикалами лежат в интервале 104-106 л/моль.
|
|
|
В процессе ингибированного окисления органических веществ из ингибитора образуются свободные радикалы In•. Феноксильные радикалы многих фенолов сравнительно устойчивы, что позволяет изучать их свойства и определять строение образующихся из них продуктов. При больших концентрациях радикалов RO2• в системе продуктами рекомбинации являются, главным образом, соединения ROOIn - хинолидные пероксиды были выделены при ингибировании процессов окисления углеводородов 2,4,6 - триалкилфенолами. Выход хинолидных пероксидов при окислении низкомолекулярных углеводородов в присутствии пространственно - затрудненных фенолов достигает 100%.
Эффективность ингибитора в общем случае определяется величиной константы скорости реакции RO2• + InH. Однако, если отрыв атома водорода протекает слишком легко, то это может привести к прямому взаимодействию ингибитора с кислородом, что снижает его эффективность и увеличивает вероятность дополнительных реакций радикалообразования.
Многократный обрыв цепей на ингибиторах окисления
В некоторых системах одна молекула ингибитора может обрывать большое число цепей (f>>2). Это наблюдается, когда по реакции активного центра (R• или RO2•) с продуктом превращения ингибитора (In•) снова образуется исходный ингибитор или ингибитор действует каталитически, переводя активный RO2• в малоактивный радикал. Такие явления характерны для следующих систем:
1. В окисляющихся спиртах (первичных и вторичных) образуются гидроксипероксидные радикалы, обладающие восстановительным действием.В присутствии ингибиторов (ароматических аминов AmH) возникают циклические реакции обрыва цепей с участием аминильных и нитроксильных радикалов:
>C(OH)OO• + HАm → >C(OH)OOH + Am•
>C(OH)OO• + Am• → AmH + O2 + >C=О
>C(OH)OO• + Am• → >C(OH)O• + AmO•
>C(OH)OO• + AmO• → AmOH + O2 + O=C<
>C(OH)OO• + AmOH → >C(OH)OOH + AmO•
Аналогичные реакции протекают при введении ароматических аминов в окисляющиеся алифатические амины, пероксидные радикалы которых также обладают восстановительным действием.
2. Хиноны (Q) и иминохиноны тормозят окисление спиртов, вступая с пероксидными радикалами в циклические реакции:
>C(OH)OO• + Q → >C=О + O2 + •QH
>C(OH)OO• + •QH → >C(OH)OOH + Q
Многократный обрыв на хинонах наблюдается и в процессах окисления органических веществ, в которых цепи ведут радикалы HO2•. Они восстанавливают хинон в семихинонный радикал (например, при окислении циклогексадиена, полипропилена и др.)
3. Соли металлов переменной валентности при окислении спиртов и аминов:
>C(YH)OO• + Mn+ → >C(YH)OO- + Mn+1,
>C(YH)OO• + Mn+1 → >C=Y + O2 + H+ + Mn+,
где Y = N, O.
4. Стабильные нитроксильные радикалы (>NO•) многократно обрываютцепи при окислении полимеров, что лежит в основе высокой эффективности стерически затрудненных аминов как светостабилизаторов. Известны три механизма циклического обрыва цепей с участием нитроксильных радикалов:
Первый:
>NO• + R• → >NOR
>NOR + RO2• → ROOH + >NO• + Олефин
Второй:
>NOR (NO•+ R•) → >NOH + Олефин
>NOН + RO2• → >NO• + ROH
Третий:
R(OOH)2 → H2O2 + ROOH
H2O2 + RO2• → ROOH + HO2•
>NO• + HO2• → >NOH + O2
>NOH + RO2• → >NO• + ROOH
5. Многократный обрыв цепей с участием стабильного нитроксильногорадикала обеспечивает трехкомпонентная система: нитроксильный радикал + пероксид водорода + кислота (НА). Важную роль в этом механизме выполняет кислота. Механизм действия следующий (RH - углеводород):
>NO• + НA ↔ >NOH+• + A-,
>NOH+• + RO2• → ROOH + >NO+
>NO+ + H2O2 → >NOH + O2 + H+
>NOH + RO2• → >NO• + ROOH
В этой системе нитроксил и кислота выступают как катализаторы, а H2O2 расходуется. Аналогичный циклический механизм обрыва цепей реализуется при введении смесей: спирт + нитроксил + кислота, а также системы: пероксид водорода + хинонимин + кислота.
Дата добавления: 2021-01-20; просмотров: 95; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
