Опыт 3. Получение, собирание и распознавание аммиака.
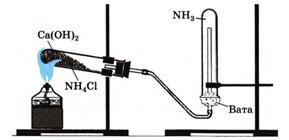
|
| Рис.4. Установка для получения и собирания аммиака |
1. Соберите прибор для получения газов и проверьте его на герметичность.
2. В фарфоровую чашку насыпьте хлорид аммония и гидроксид кальция объемом по одной ложечке для сжигания веществ.
3. Смесь перемешайте стеклянной палочкой и высыпьте в сухую пробирку.
4. Закройте ее пробкой и укрепите в лапке штатива.
ВНИМАНИЕ! Отверстие пробирки должно быть чуть ниже дна, так как образующиеся капли воды не должны стекать на дно, иначе пробирка может лопнуть.
5. На газоотводную трубку наденьте сухую пробирку для собирания аммиака.
6. Пробирку со смесью хлорида аммония и гидроксида кальция прогрейте сначала всю (2—3 движения пламени), а затем в том месте, где находится смесь.
7. Для обнаружения аммиака поднесите к отверстию перевернутой вверх дном пробирки влажную универсальную лакмусовую бумагу.
8. Прекратите нагревание смеси. Пробирку, в которой собран аммиак, снимите с газоотводной трубки. Конец газоотводной трубки сразу же закройте кусочком мокрой ваты.
9. Немедленно закройте отверстие снятой пробирки большим пальцем и опустите в сосуд с водой. Палец отнимите только под водой. Что вы наблюдаете? Почему вода поднялась в пробирке?
10. Закройте пальцем отверстие пробирки под водой и выньте ее из сосуда. Добавьте в пробирку 2—3 капли раствора фенолфталеина. Что наблюдаете?
11. Снимите ватку с газоотводной трубки и нагревайте пробирку со смесью гидроксида кальция и хлорида аммония.
|
|
|
12. Поднесите к отверстию газоотводной трубки стеклянную палочку, смоченную соляной кислотой. Что наблюдаете? Чем можно объяснить образование белого дыма (хлорида аммония)?
11. Проведите аналогичную реакцию между растворами щелочи и соли аммония при нагревании.
Вопросы и задания.
1. Что происходит при взаимодействии хлорида аммония и гидроксида кальция? Составьте уравнение реакции и дайте ее характеристику по всем изученным признакам классификации химических реакций.
2. Опишите физические свойства аммиака, непосредственно наблюдаемые в опыте.
3. Опишите не менее двух способов распознавания аммиака.
Опыт 4. Получение, собирание и распознавание оксида углерода ( IV).
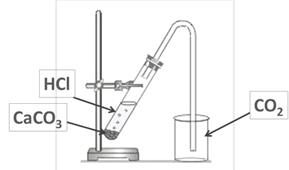
|
| Рис.5. Установка для получения и собирания оксида углерода ( IV) |
1. Соберите прибор для получения углекислого газа.
2. Поместите в сухую пробирку 1-2 кусочка мела и долейте раствор соляной кислоты так, чтобы кислота слегка покрыла поверхность мела.
3. Закройте пробирку пробкой с газоотводной трубкой, конец которой опустите в химический стакан. Что наблюдаете? Какое свойство углекислого газа лежит в основе способа собирания путем вытеснения воздуха?
|
|
|
4. Через минуту проверьте полноту заполнения химического стакана углекислым газом, для этого поднесите к отверстию стакана тлеющую лучину: если она потухнет, то сосуд заполнен углекислым газом. О каком физическом свойстве оксида углерода (IV) свидетельствует угасание лучины?
5. Пропустите выделяющийся углекислый газ в пробирку с 1-2 мл известковой воды до наступления видимых изменений. Что наблюдаете?
6. Промойте конец газоотводной трубки в стакане с водой.
7. Перенесите конец газоотводной трубки в пробирку с водой, подкрашенной раствором лакмуса.
8. Пропускайте выделяющийся оксида углерода (IV) через воду до тех пор, пока раствор лакмуса не приобретет красную окраску. Почему раствор лакмуса покраснел?
Вопросы и задания.
1. Что происходит при взаимодействии мела с соляной кислотой?
Составьте молекулярное уравнение реакции и дайте ее характеристику по всем изученным признакам классификации химических реакций.
2. Рассмотрите проведенную реакцию в свете теории электролитической диссоциации.
3. Опишите физические свойства оксида углерода (IV), непосредственно наблюдаемые в опыте.
4. Опишите не менее двух способов распознавания оксида углерода (IV).
Дата добавления: 2020-12-22; просмотров: 245; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
