Лабораторная работа №5. Определение порога коагуляции.
Теоретическая часть.
Коллоидные растворы обладают большим запасом энергии, вследствие чего они термодинамически неустойчивы. Стремление к наиболее устойчивому состоянию, т.е. к минимальной поверхностной энергии, приводит к тому, что в коллоидных растворах протекают процессы, связанные с уменьшением площади поверхности раздела между фазами. Это возможно в том случае, когда частицы под действием молекулярных сил сцепляются в агрегаты, укрупняя свои размеры. Совокупность процессов, вызывающих укрупнение коллоидных частиц, называется коагуляцией.
Одним из наиболее эффективных методов коагуляции является добавление к коллоидным растворам электролитов, содержащих ионы, противоположные по заряду частицам данного коллоида. Коагулирующее действие электролитов основано на нейтрализации поверхностного заряда мицелл и снижении электрокинетического потенциала до некоторой критической величины (обычно около  ). Минимальная концентрация электролита, вызывающая коагуляцию данной коллоидной системы, называется порогом коагуляции и выражается в миллимолях на литр коллоидного раствора.
). Минимальная концентрация электролита, вызывающая коагуляцию данной коллоидной системы, называется порогом коагуляции и выражается в миллимолях на литр коллоидного раствора.
Порог коагуляции зависит от валентности иона-коагулянта и изменяется пропорционально шестой степени валентности иона:
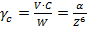 , (1)
, (1)
где  – порог коагуляции, моль/л;
– порог коагуляции, моль/л; 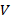 – объем электролита, вызывающего коагуляцию, мл;
– объем электролита, вызывающего коагуляцию, мл;  – концентрация электролита, моль/л;
– концентрация электролита, моль/л; 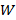 – объем золя, мл.
– объем золя, мл. 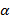 – константа, характеризующая свойства раствора;
– константа, характеризующая свойства раствора;  – валентность иона-коагулянта.
– валентность иона-коагулянта.
|
|
|
Процесс коагуляции происходит во времени, для изучения явлений коагуляции лучше пользоваться методикой, связанной с кинетикой процесса: при постоянной концентрации прибавляемого электролита измерять время, необходимое для появления видимой мути или окраски или оставлять постоянным время и определять концентрацию электролита, которая вызывает коагуляцию.
Исследование коагуляции можно проводить прямыми и косвенными методами. Прямые методы используют ультрамикроскоп, косвенные методы основаны на измерении вторичных эффектов (мутность золя, изменение окраски, вязкости и т.д.).
Коагулирующее действие различных электролитов резко различается, что сказывается на скорости коагуляции.
Согласно правилу Шульце-Гарди, при коагуляции золя электролитами коагулирующий ион всегда имеет заряд, противоположный заряду коллоидной частицы; порог коагуляции при этом тем меньше, чем выше валентность коагулирующего иона.
Особенно чувствительны к коагуляции лиофобные золи, в частности получаемый методом гидролиза положительно заряженный золь гидроксида железа:
 (2)
(2)
|
|
|
При добавке к раствору гидроксида железа электролитов, содержащих разновалентные анионы, можно наблюдать коагуляцию, проявляющуюся в помутнении раствора и разделении фаз (выпадение осадка).
Экспериментальная часть.
Цель работы: изучение явления коагуляции коллоидных растворов при добавлении к ним электролитов, содержащих ионы-коагулянты различной валентности.
Оборудование и реактивы:
1) Набор конических колб объемом 100 мл;
2) Пипетки на 25 мл;
3) Коллоидный раствор гидроксида железа (III);
4) 2М раствор хлорида натрия;
5) 0,01 М раствор хлорида кальция;
6) 0,001 М хлорида алюминия;
7) 0,01 М раствор сульфата натрия.
Порядок выполнения работы.
1. Приготовить коллоидный раствор гидроксида железа. 10 мл 2%-ного раствора хлорида железа (III) в колбе нагревают над электрической плиткой до изменения желтого цвета на красно-коричневый, образуется раствор гидроксида железа (III). При ослаблении окраски и переходе ее в желтый цвет раствор следует снова довести до кипения.
2. Влить в три колбы по 10 мл горячего раствора гидроксида железа (III). После этого в каждую колбу по каплям добавлять растворы электролитов до появления первых признаков коагуляции. Результаты заносят в таблицу 1.
|
|
|
Таблица 1. Экспериментальные данные.
| Электролит | Концентрация раствора электролита ( 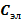 ), моль/л ), моль/л
| Объем электролита, необходимого для коагуляции ( 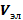 ), мл ), мл
| Объем электролита в пересчете на 0,001 моль/л раствор ( 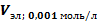 ), мл ), мл
| 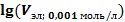
|
Хлорид натрия ( 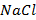 ) )
| 2 | 0,55 | 0,000275 | -3,56 |
Хлорид кальция ( 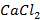 ) )
| 0,01 | 0,35 | 0,035 | -1,46 |
Хлорид алюминия ( 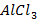 ) )
| 0,001 | 0,75 | 0,75 | -0,12 |
Сульфат натрия ( 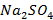 ) )
| 0,01 | 0,50 | 0,05 | -1,30 |
Визуально можно заметить только начало явной коагуляции, появление мути. Объем электролита, который потребовался, чтобы вызвать коагуляцию соответствующего золя, определяют с точностью до одной капли (объем капли равен приблизительно 0,05 мл).
3. Полученные результаты перенести на график, откладывая на оси абсцисс значения валентности ионов, а на оси ординат – десятичный логарифм величины порога коагуляции ионов.
4. Заключить вывод о сравнительной коагулирующей способности ионов различной валентности  .
.
Обработка экспериментальных данных.
1. Приготовили коллоидный раствор гидроксида железа, путем нагревания раствора хлорида железа (III). Процесс гидролиза описывается уравнением (2).
2. Коллоидный раствор разлили в четыре колбы и добавляли электролиты-коагулянты, указанные в методике эксперимента. Посчитав количество капель электролитов, пошедших на коагуляцию, и, приняв за объем одной капли 0,05 мл, нашли объемы электролитов-коагулянтов. Данные занесли в табл. 1.
|
|
|
3. Пересчитав объемы электролитов-коагулянтов в соответствии с концентрацией 0,001 моль/л, взяли десятичный логарифм данных объемов –  (см. табл. 1).
(см. табл. 1).
4. Так как значения  и
и 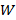 из уравнения (1) приведены к одним показателям для всех четырех коагулирующих растворов (
из уравнения (1) приведены к одним показателям для всех четырех коагулирующих растворов ( 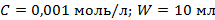 ), то значение порога коагуляции будет соответствовать десятичному логарифму объема электролита-коагулянта:
), то значение порога коагуляции будет соответствовать десятичному логарифму объема электролита-коагулянта:  .
.
5. Полученные результаты перенесли на график, откладывая на оси абсцисс значения валентности ионов, а на оси ординат – десятичный логарифм величины порога коагуляции ионов (  ). В данный график не включили только значения для сульфата натрия (
). В данный график не включили только значения для сульфата натрия ( 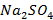 ), так как ион-коагулянт
), так как ион-коагулянт 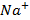 уже учтён в другом соединении – хлориде натрия (
уже учтён в другом соединении – хлориде натрия ( 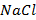 ).
).
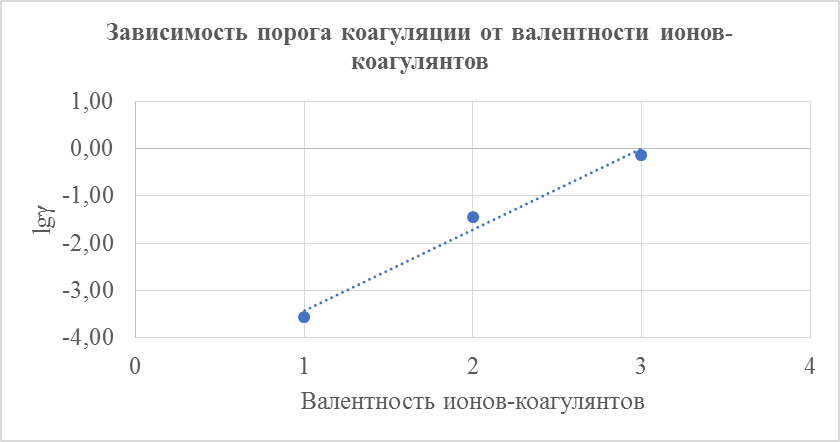
Рисунок 1. График зависимости порога коагуляции от валентности ионов-коагулянтов
Выводы.
В данной работе нам удалось установить, что коагулирующая способность электролита сильно возрастает с увеличение валентности иона (см. рис. 1). На данном графике также хорошо видно, что зависимость коагулирующей способности от валентности ионов-коагулянтов имеет прямолинейный вид.
Дата добавления: 2020-12-22; просмотров: 2420; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
