Лабораторная работа №2. Исследование адсорбции поверхностно-активных веществ одного гомологического ряда.
МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РФ
Федеральное государственное бюджетное образовательное
учреждение высшего образования
«Пермский государственный национальный
исследовательский университет»
Лабораторные работы по дисциплине «Химия поверхности раздела фаз»
Работу выполнил магистр II курса группы ХИМ-3 НМ 2019
по направлению 04.04.01 «Химия»
очной формы обучения
Вотинов Илья
Преподаватель:
канд. хим. наук,
доцент кафедры физической химии
Медведева Наталья Александровна
Пермь 2020
Оглавление
Лабораторная работа №1. Определение поверхностного натяжения методом счета капель (метод сталагмометра). 3
Лабораторная работа №2. Исследование адсорбции поверхностно-активных веществ одного гомологического ряда. 10
Лабораторная работа №3. Молекулярная адсорбция ПАВ на поверхности раздела «раствор – воздух» 17
Лабораторная работа №4. Микроскопический анализ сталей и магния. 27
Лабораторная работа №5. Определение порога коагуляции. 34
Лабораторная работа №1. Определение поверхностного натяжения методом счета капель (метод сталагмометра).
Теоретическая часть.
Поверхностное натяжение – это характеристика поверхности раздела двух фаз, находящихся в равновесии. Рассмотрим механизм возникновения поверхностного натяжения. Молекула внутри вещества окружена такими же молекулами со всех сторон, а молекула, находящаяся на поверхности, окружена «своими» молекулами только с одной стороны, а с другой находятся молекулы другой фазы. Силы, действующие на молекулу внутри вещества, взаимно уравновешиваются, а равнодействующая всех сил, действующих на молекулу, находящуюся на поверхности, равна нулю. Таким образом, молекулы на поверхности обладают дополнительной потенциальной энергией по сравнению с «объемными» молекулами. Эта энергия называется поверхностной, пропорциональная площади поверхности.
|
|
|
Рисунок 1. Механизм возникновения поверхностного натяжения.
В состоянии равновесия тело стремится сократить площадь поверхности, чтобы уменьшить поверхностную энергию. Чтобы создать поверхность раздела фаз площади 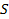 , необходимо совершить работу, равную
, необходимо совершить работу, равную
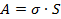 , (1)
, (1)
где 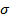 – коэффициент поверхностного натяжения.
– коэффициент поверхностного натяжения.
Таким образом, коэффициент поверхностного натяжения численно равен работе, необходимой для увеличения площади поверхности при постоянной температуре и давлении на единицу. Коэффициент поверхностного натяжения зависит от вида контактирующих фаз, температуры, и т.д.
Если участок поверхности раздела фаз ограничен некоторым контуром, то возникают силы поверхностного натяжения, приложенные к этому контуру. Их величина пропорциональна длине участка контура 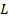 , на который они действуют:
, на который они действуют:
|
|
|
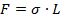 (2)
(2)
Таким образом, поверхностное натяжение имеет два физических смысла:
· Энергетический смысл: поверхностное натяжение – это есть удельная поверхностная энергия.
· Силовой смысл: сила, действующая по касательной к поверхности и стремящаяся сократить свободную поверхность до минимума при данном объеме.
Поверхностное натяжение зависит от температуры, от природы граничащих фаз, от полярности жидкости.
Одним из самых простых методов измерения поверхностного натяжения жидкостей является метод счета капель – сталагмометрический метод.
Рисунок 2. Силы, действующие на каплю в момент отрыва.
В момент отрыва капли жидкости от нижнего конца вертикальной трубки сила тяжести капли  , уравновешивается силами поверхностного натяжения
, уравновешивается силами поверхностного натяжения 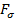 , действующими по контуру, ограничивающему поперечное сечение шейки. Результирующую этих сил можно представить в виде:
, действующими по контуру, ограничивающему поперечное сечение шейки. Результирующую этих сил можно представить в виде:
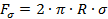 , (3)
, (3)
где 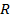 – радиус шейки, м;
– радиус шейки, м; 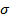 – коэффициент поверхностного натяжения, Н/м.
– коэффициент поверхностного натяжения, Н/м.
Таким образом, в момент отрыва  . Отсюда:
. Отсюда:
 (4)
(4)
Таким образом, определение коэффициента поверхностного натяжения сводится к определению силы тяжести, действующей на каплю и радиуса шейки в момент ее отрыва. Сила тяжести, действующая на каплю, определяется по объему 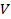 и плотности жидкости
и плотности жидкости 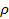 :
:
|
|
|
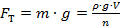 , (5)
, (5)
где 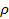 – плотность жидкости,
– плотность жидкости,  ,
, 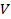 – объем жидкости,
– объем жидкости, 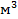 ,
, 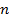 – число капель в данном объеме. Тогда подставив уравнение (5) в уравнение (4), получим расчетную формулу для коэффициента поверхностного натяжения:
– число капель в данном объеме. Тогда подставив уравнение (5) в уравнение (4), получим расчетную формулу для коэффициента поверхностного натяжения:
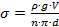 (6)
(6)
Экспериментальная часть.
Цель работы: изучить один из способов измерения поверхностного натяжения – метод счета капель.
Рисунок 3. Схема установки для определения поверхностного натяжения (1 - бюретка с краном, 2 - емкость для сбора капель).
Оборудование и реактивы:
· Сталагмометр с зажимом;
· Емкость для сбора капель;
· Штатив;
· Дистиллированная вода;
· Исследуемые жидкости.
Порядок выполнения работы.
1. Ознакомиться с техникой безопасности.
2. Измерить диаметр кончика сталагмометра. Он составил  .
.
3. Наполнить сталагмометр исследуемой жидкостью (в нашем случае, это вода при комнатной температуре).
4. Заполнить емкость (шарик сталагмометра от риски до риски) исследуемой жидкостью, подсчитав при этом количество капель. Скорость вытекания жидкости регулировать с помощью зажима, установленного на сталагмометре.
|
|
|
5. Повторить измерения 3 раза.
6. Повторить пункты 2-5 для горячей воды, холодной воды, водного раствора соли (например,  ) и олеата натрия (мыльной воды).
) и олеата натрия (мыльной воды).
7. Для приготовления 1,5 М раствора соли навеску массой 9 г развести дистиллированной водой в стакане/колбе на 150 мл.
8. Температуру воды измерить с помощью термометра. Плотность воды при данной температуре определить по таблице 2.
9. Занести полученные данные в таблицу 1.
10. Рассчитать коэффициенты поверхностного натяжения  для каждой исследованной жидкости по формуле 6.
для каждой исследованной жидкости по формуле 6.
11. Построить график зависимости коэффициента поверхностного натяжения воды 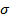 от температуры
от температуры 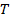 и сделать вывод о полученной зависимости.
и сделать вывод о полученной зависимости.
12. Сделать вывод о том, как влияет на коэффициент поверхностного натяжения добавление в воду соли и мыла.
Таблица 1. Результаты измерений для жидкостей
| Вода при комнатной температуре | |||||
| № | 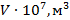
| 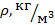
| 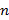
| 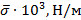
| 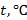
|
| 1 | 7,356 | 997,772 | 40 | 9,540 | 22,5 |
| 2 | 41 | 9,307 | |||
| 3 | 41 | 9,307 | |||
| Ср. зн. | 7,356 | 997,772 | 40,667 | 9,385 | 22,5 |
| Горячая вода | |||||
| № | 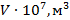
| 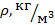
| 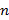
| 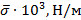
| 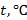
|
| 1 | 7,356 | 989,220 | 41 | 9,228 | 47,5 |
| 2 | 43 | 8,798 | |||
| 3 | 40 | 9,458 | |||
| Ср. зн. | 7,356 | 989,220 | 41,333 | 9,161 | 47,5 |
| Холодная вода | |||||
| № | 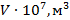
| 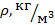
| 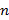
| 
| 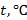
|
| 1 | 7,356 | 999,377 | 36 | 1,062 | 1 |
| 2 | 36 | 1,062 | |||
| 3 | 37 | 1,033 | |||
| Ср. зн. | 7,356 | 999,377 | 36,333 | 1,052 | 1 |
| Водный раствор соли ( | |||||
| № | 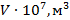
| 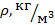
| 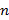
| 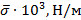
| 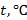
|
| 1 | 7,356 | 1063 | 41 | 9,916 | 22,5 |
| 2 | 41 | 9,916 | |||
| 3 | 41 | 9,916 | |||
| Ср. зн. | 7,356 | 1063 | 41 | 9,916 | 22,5 |
| Мыльная вода | |||||
| № | 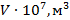
| 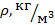
| 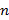
| 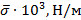
| 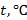
|
| 1 | 7,356 | 1012 | 68 | 5,692 | 22,5 |
| 2 | 67 | 5,777 | |||
| 3 | 66 | 5,864 | |||
| Ср. зн. | 7,356 | 1012 | 67 | 5,778 | 22,5 |
Таблица 2. Зависимость плотности дистиллированной воды от температуры.
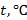
| 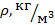
| 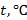
| 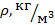
|
| 0 | 999,841 | 19 | 998,406 |
| 1 | 999,900 | 20 | 998,205 |
| 2 | 999,941 | 21 | 997,994 |
| 3 | 999,965 | 22 | 997,772 |
| 4 | 999,973 | 23 | 997,540 |
| 5 | 999,965 | 24 | 997,299 |
| 6 | 999,941 | 25 | 997,047 |
| 7 | 999,902 | 26 | 996,785 |
| 8 | 999,849 | 27 | 996,515 |
| 9 | 999,782 | 28 | 996,235 |
| 10 | 999,701 | 29 | 995,946 |
| 11 | 999,606 | 30 | 995,946 |
| 12 | 999,498 | 40 | 992,220 |
| 13 | 999,377 | 50 | 988,040 |
| 14 | 999,244 | 60 | 983,200 |
| 15 | 999,099 | 70 | 977,760 |
| 16 | 998,430 | 80 | 971,790 |
| 17 | 998,775 | 90 | 965,300 |
| 18 | 998,596 | 100 | 958,350 |
Обработка результатов эксперимента.
1. Измерив диаметры кончика и шарика сталагмометра, использовав справочные данные и посчитав капли всех жидкостей, рассчитали коэффициенты поверхностного натяжения 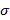 для всех исследуемых жидкостей. Полученные данные занесли в табл. 1.
для всех исследуемых жидкостей. Полученные данные занесли в табл. 1.
2. На основании полученных данных построили график зависимости коэффициента поверхностного натяжения воды 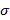 от температуры
от температуры 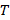 (см. рис. 4).
(см. рис. 4).
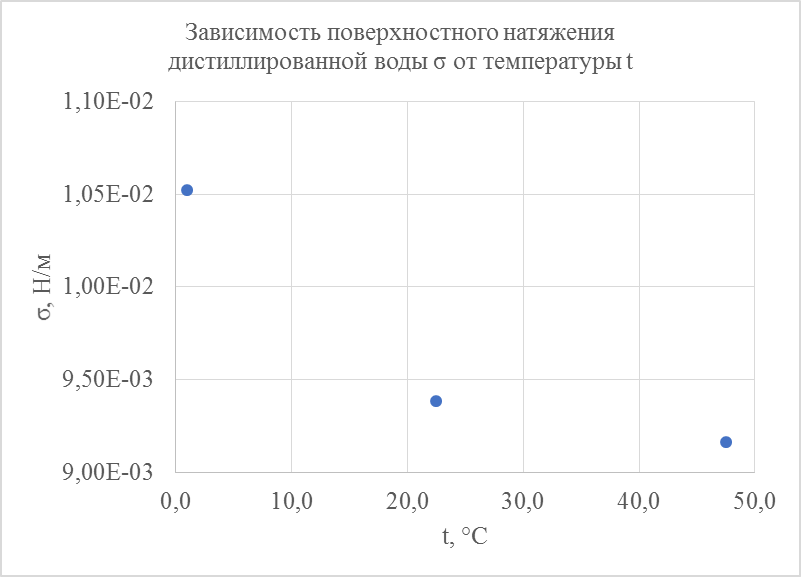
Рисунок 4. График зависимости поверхностного натяжения дистиллированной воды 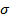 от температуры
от температуры 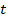
Выводы.
В данной работе нам удалось измерить поверхностные натяжения дистиллированной воды и установить их зависимости от температуры (см рис. 4). На данном графике хорошо видно, что поверхностное натяжение воды уменьшается с ростом температуры. Зависимость экспоненциальная ниспадающая.
Исходя из данных табл. 1, видно, что добавление соли хлорида натрия в воду при комнатной температуре немного повышает поверхностное натяжение ( 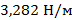 у дистиллированной воды при комнатной температуре и
у дистиллированной воды при комнатной температуре и  у
у 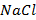 ). Добавление олеата натрия, наоборот, понижает поверхностное натяжение воды при комнатной температуре и составляет
). Добавление олеата натрия, наоборот, понижает поверхностное натяжение воды при комнатной температуре и составляет 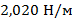 . Данные изменения связаны с особенностями межмолекулярного взаимодействия участников данных реакций.
. Данные изменения связаны с особенностями межмолекулярного взаимодействия участников данных реакций.
Лабораторная работа №2. Исследование адсорбции поверхностно-активных веществ одного гомологического ряда.
Цель работы: проверить правило Дюкло – Траубе на трех соседних членах одного гомологичного ряда ПАВ. Для этого необходимо:
· Получить изотермы поверхностного натяжения и адсорбции для водных растворов алифатических спиртов;
· Определить соотношение поверхностных активностей ПАВ в их гомологическом ряду;
· На основании полученных данных рассчитать толщину адсорбционного слоя и площадь, занимаемую одной молекулой ПАВ в насыщенном адсорбционном слое.
Приборы и реактивы: сталагмометр, бюретки, конические колбы емкостью 50 мл, пробирки, растворы алифатических спиртов, пипетки, груша.
Теоретическая часть.
Поверхностно-активные свойства ПАВ зависят от числа метиленовых групп в углеводородной цепи, природы и содержания полярных групп. Адсорбционная способность молекул ПАВ характеризуется поверхностной активностью 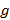 . Поверхностную активность можно найти графически по экспериментальной изотерме поверхностного натяжения
. Поверхностную активность можно найти графически по экспериментальной изотерме поверхностного натяжения  . С удлинением углеводородного радикала гомолога поверхностная активность
. С удлинением углеводородного радикала гомолога поверхностная активность 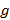 повышается.
повышается.
Дюкло и Траубе установили экспериментальное правило, согласно которому поверхностная активность жирных кислот, спиртов, аминов и других веществ в гомологических рядах на границе раствор – воздух возрастает в 3,2 раза при увеличении углеводородной цепи на каждую 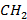 -группу:
-группу:
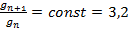 ,
,
где 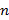 – число метиленовых групп в углеводородном радикале.
– число метиленовых групп в углеводородном радикале.
Это правило выполняется лишь для водных растворов ПАВ. Для растворов ПАВ в неполярных растворителях поверхностная активность при увеличении длины углеводородного радикала, наоборот, уменьшается (обращение правила Дюкло – Траубе).
Измерение поверхностной активности и адсорбции ПАВ позволяет определить параметры адсорбционных слоев: площадь  , занимаемую одной молекулой, и толщину поверхностного слоя
, занимаемую одной молекулой, и толщину поверхностного слоя 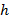 . Величины
. Величины  и
и 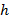 рассчитывают по экспериментально найденным значениям предельной адсорбции
рассчитывают по экспериментально найденным значениям предельной адсорбции  .
.
Предельную адсорбцию  определяют по изотермам адсорбции
определяют по изотермам адсорбции 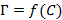 , для построения которых вычисляют несколько значений
, для построения которых вычисляют несколько значений  . Для веществ с ярко выраженными поверхностно-активными свойствами величину адсорбции
. Для веществ с ярко выраженными поверхностно-активными свойствами величину адсорбции 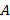 можно принять равной гиббсовской адсорбции
можно принять равной гиббсовской адсорбции 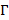 (в молях на
(в молях на  поверхности).
поверхности).
Для разбавленного раствора адсорбата связь между адсорбцией 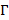 и понижением поверхностного натяжения σ выражается через фундаментальное уравнение Гиббса:
и понижением поверхностного натяжения σ выражается через фундаментальное уравнение Гиббса:
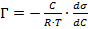 .
.
Площадь  , приходящуюся на одну молекулу в насыщенном адсорбционном слое, вычисляют по уравнению:
, приходящуюся на одну молекулу в насыщенном адсорбционном слое, вычисляют по уравнению:
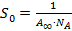 .
.
Толщину адсорбционного слоя 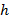 рассчитывают по формуле:
рассчитывают по формуле:
 .
.
Сопоставление вычисленных значений толщины слоя 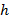 с длиной ориентированных молекул дает возможность оценить тип поверхностной пленки и определить ориентацию молекул ПАВ в адсорбционном слое.
с длиной ориентированных молекул дает возможность оценить тип поверхностной пленки и определить ориентацию молекул ПАВ в адсорбционном слое.
Экспериментальная часть.
Готовят пять водных растворов спиртов одного гомологического ряда следующих концентраций:
Концентрация раствора  , моль/л , моль/л
| 0,01 | 0,02 | 0,04 | 0,08 | 0,1 | 0,12 |
С помощью сталагмометрической установки определяют поверхностное натяжение приготовленных растворов и строят графики зависимости  . Измерение поверхностного натяжения следует проводить быстро, так как может происходить испарение спирта с поверхности раздела фаз.
. Измерение поверхностного натяжения следует проводить быстро, так как может происходить испарение спирта с поверхности раздела фаз.
Проверку правила Траубе можно провести двумя методами.
1. По угловому коэффициенту касательных, проведенных в точке  , где
, где 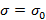 , определяют поверхностную активность (
, определяют поверхностную активность (  ) трех ПАВ (
) трех ПАВ ( 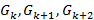 ). По правилу Траубе:
). По правилу Траубе:
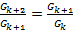 .
.
2. Проверяют применимость уравнения Шишковского к экспериментальным зависимостям  :
:
 .
.
Если график зависимости  представляет собой прямую линию, то уравнение
представляет собой прямую линию, то уравнение  справедливо в области больших концентраций. Константы
справедливо в области больших концентраций. Константы 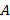 и
и 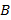 определяют по линейному участку зависимости
определяют по линейному участку зависимости  , где
, где 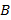 равна тангенсу угла наклона этой прямой к оси абсцисс, а константа
равна тангенсу угла наклона этой прямой к оси абсцисс, а константа 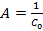 , где
, где 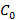 – концентрация, при которой
– концентрация, при которой 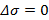 .
.
Далее необходимо убедиться в том, что уравнение Шишковского справедливо и в области малых концентраций раствора. Для этого по известным значениям констант 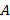 и
и 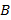 рассчитывают
рассчитывают 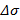 при различных
при различных  . Последнее можно считать применимым в области малых концентраций, если экспериментальные значения
. Последнее можно считать применимым в области малых концентраций, если экспериментальные значения 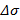 и расчетные отличаются в пределах погрешности измерений.
и расчетные отличаются в пределах погрешности измерений.
После такой проверки по константам 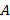 и
и 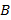 рассчитывают
рассчитывают 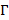 при различных концентрациях раствора.
при различных концентрациях раствора.
Для систем, к которым применимо это уравнение, 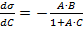 и при
и при  :
:
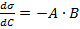 .
.
Поэтому
 ,
,
так как в одном гомологичном ряду 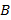 постоянна, т. е.
постоянна, т. е.  . Таким образом, правило Траубе соблюдается, если
. Таким образом, правило Траубе соблюдается, если
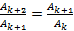 .
.
Обработка результатов эксперимента.
1. По полученным данным для каждого спирта построили изотермы поверхностного натяжения и по ним нашли поверхностную активность 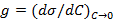 , а также значения (
, а также значения ( 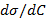 ) в нескольких точках изотерм (см. рис. 1).
) в нескольких точках изотерм (см. рис. 1). 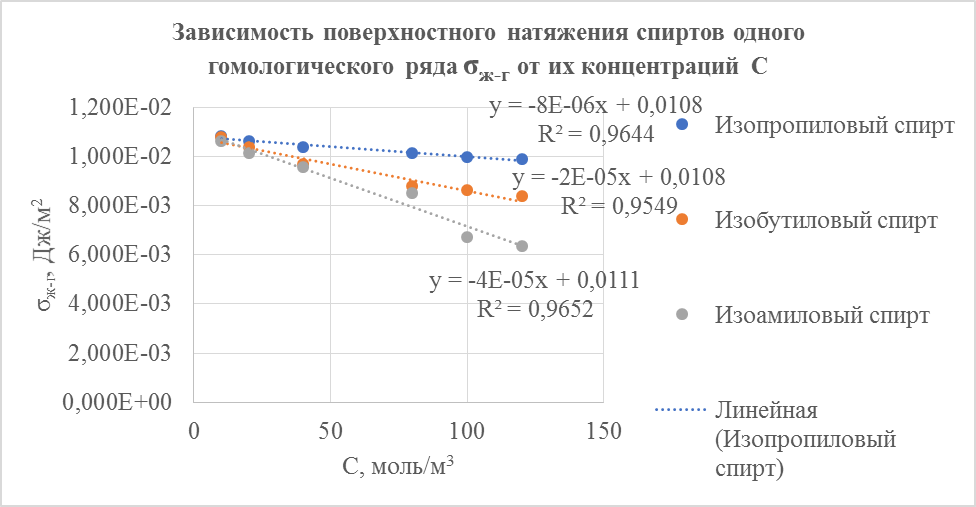
Рисунок 1. График зависимости поверхностного натяжения спиртов одного гомологического ряда σж-г от их концентраций C
2. По уравнению Гиббса вычислили значения 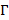 и построили изотермы адсорбции
и построили изотермы адсорбции 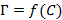 . Данные расчета
. Данные расчета 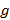 ,
, 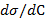 и
и 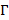 для исследуемых спиртов записали в табл. 1.
для исследуемых спиртов записали в табл. 1. 
Рисунок 2. График зависимости адсорбции спиртов одного гомологического ряда Г от их концентраций C
Таблица 1. Экспериментальные и расчетные данные по адсорбции алифатических спиртов.
| Спирт из гомологического ряда | Концентрация раствора спирта, моль/л | Среднее количество капель | Поверхностное натяжение 
| 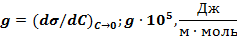
| 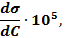
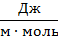
| 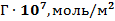
|
| Изопропиловый | 0,01 | 59,5 | 1,081 | 0,8 | - | - |
| 0,02 | 60,5 | 1,063 | -1,79 | 1,46 | ||
| 0,04 | 62 | 1,038 | -1,29 | 2,10 | ||
| 0,08 | 63,5 | 1,013 | -0,61 | 1,99 | ||
| 0,1 | 64,5 | 0,997 | -0,79 | 3,20 | ||
| 0,12 | 65 | 0,990 | -0,39 | 1,89 | ||
| Изобутиловый | 0,01 | 61,5 | 1,080 | 2 | - | - |
| 0,02 | 64 | 1,037 | -4,28 | 3,49 | ||
| 0,04 | 68,5 | 0,969 | -3,40 | 5,55 | ||
| 0,08 | 75,5 | 0,879 | -2,25 | 7,33 | ||
| 0,1 | 77 | 0,862 | -0,85 | 3,47 | ||
| 0,12 | 79 | 0,841 | -1,07 | 5,24 | ||
| Изоамиловый | 0,01 | 62,5 | 1,065 | 4 | - | - |
| 0,02 | 65,5 | 1,016 | -4,88 | 3,98 | ||
| 0,04 | 69,5 | 0,957 | -2,92 | 4,77 | ||
| 0,08 | 78 | 0,853 | -2,61 | 8,50 | ||
| 0,1 | 99 | 0,672 | -9,05 | 36,9 | ||
| 0,12 | 105 | 0,634 | -1,91 | 9,36 |
Затем рассчитали соотношения поверхностных активностей для соседних гомологов:
 ,
,
где 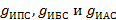 – поверхностные активности изопропилового, изобутилового и изоамилового спиртов соответственно
– поверхностные активности изопропилового, изобутилового и изоамилового спиртов соответственно
3. По изотермам 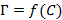 (см. рис. 2) определили значения
(см. рис. 2) определили значения 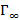 и, приняв для ПАВ
и, приняв для ПАВ  , рассчитали
, рассчитали  и
и 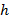 . Полученные данные занесли в таблицу №2.
. Полученные данные занесли в таблицу №2.
Таблица 2. Расчет геометрических параметров спиртов одного гомологического ряда
| Спирт из гомологического ряда | Величина предельной адсорбции 
| Площадь 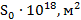 , приходящаяся на одну молекулу в насыщенном адсорбционном слое , приходящаяся на одну молекулу в насыщенном адсорбционном слое
| Толщина адсорбционного слоя 
|
| Изопропиловый | 2 | 8,31 | 1,53 |
| Изобутиловый | 5 | 3,32 | 4,57 |
| Изоамиловый | 0,2 | 83,1 | 0,217 |
Выводы.
Были получены значения поверхностных натяжений и адсорбции для изопропилового, изобутилового и изоамилового спиртов, которые относятся к одному гомологическому ряду. Также для этих веществ были посчитаны толщина адсорбционного слоя, площадь молекулы, находящуюся в данном слое.
Правило Дюкло-Траубе для данных спиртов выполняется не во всей его строгости:
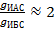 ;
; 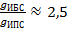 .
.
Это может быть связано с тем, что это правило может по-другому выполнятся для не-алифатических спиртов, а также ошибками измерений.
Дата добавления: 2020-12-22; просмотров: 1385; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

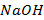 )
)