Марта 1869г.Формулировка периодического закона Д.И. Менделеева.
Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
Ещё в конце 19 века Д.И. Менделеев писал, что, по-видимому, атом состоит из других более мелких частиц, и периодический закон это подтверждает.
Современная формулировка периодического закона.
Свойства химических элементов и их соединений находятся в периодической зависимости от величины заряда ядер их атомов, выражающейся в периодической повторяемости структуры внешней валентной электронной оболочки.
Мозли закон, закон, связывающий частоту спектральных линий характеристического рентгеновского излучения химического элемента с его порядковым номером. Экспериментально установлен Г. Мозли в 1913. Согласно М. з., корень квадратный из частоты n спектральной линии характеристического излучения элемента есть линейная функция его порядкового номера Z:

где R — Ридберга постоянная , Sn —постоянная экранирования, n —главное квантовое число. На диаграмме Мозли (см. рис.) зависимость 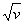 от Z представляет собой ряд прямых (К-, L-, М- и т. д. серии, соответствующие значениям n = 1, 2, 3,...).
от Z представляет собой ряд прямых (К-, L-, М- и т. д. серии, соответствующие значениям n = 1, 2, 3,...).
М. з. явился неопровержимым доказательством правильности размещения элементов в периодической системе элементов Д. И. Менделеева и содействовал выяснению физического смысла Z.
В соответствии с М. з., рентгеновские характеристические спектры не обнаруживают периодических закономерностей, присущих оптическим спектрам (см. Атомные спектры). Это указывает на то, что проявляющиеся в характеристических рентгеновских спектрах внутренние электронные оболочки атомов всех элементов имеют аналогичное строение.
|
|
|
Более поздние эксперименты выявили некоторые отклонения от линейной зависимости для переходных групп элементов, связанные с изменением порядка заполнения внешних электронных оболочек, а также для тяжёлых атомов, появляющиеся в результате релятивистских эффектов (условно объясняемых тем, что скорости внутренних сравнимы со скоростью света).
В зависимости от ряда факторов — от числа нуклонов в ядре (изотонический сдвиг), состояния внешних электронных оболочек (химический сдвиг) и пр. — положение спектральных линий на диаграмме Мозли может несколько изменяться. Изучение этих сдвигов позволяет получать детальные сведения об атоме.
Период - строка периодической системы химических элементов, последовательность атомов по возрастанию заряда ядра и заполнению электронами внешней электронной оболочки.
Группа - последовательность атомов по возрастанию заряда ядра, обладающих однотипным электронным строением.
|
|
|
Подгруппа - Делит группу на 2 части , 1 чать - Главная , 2 часть - Побочная .
Главные подгруппы - образуют элементы малых и больших периодов
Побочные подгруппы только элементы больших периодов
Это связь между положением элемента в периодической системе и электронным строением его атомов. От того, какой энергетический подуровень заполняется последним, различают 4 электронных семейства элементов: s, p, d и f:
1. s-Элементы – семейство элементов, у которых при заполнении электронных уровней электронами, последний электрон идет на внешний s-подуровень. Это первая и вторая группа главной подгруппы. На внешнем энергетическом уровне у них 1 или 2 электрона. Например, Na: 14s2 2s2 p6 3s1, валентным является один s-электрон.
2. У p-элементов последний электрон идет на p-подуровень внешнего уровня. Это элементы III - VIII групп главной подгруппы каждого периода.
3. У d-элементов сначала заполняется s-подуровень внешнего уровня, а последний электрон идет на d-подуровень предвнешнего уровня. d-Элементы находятся в побочных подгруппах п. с. (У d-элементов возможен проскок электронов с s-подуровня внешнего уровня на свободную d-орбиталь предвнешнего уровня, если это энергетически выгодно. )
|
|
|
4. У f-Элементов последний электрон идет на f-подуровень предпредвнешнего уровня. К ним относятся лантаноиды и актиноиды.
Атомный радиус. За радиус свободного атома принимают положение главного максимума плотности внешних электронных оболочек. Это так называемый орбитальный радиус . При изучении строения молекул и кристаллов атомы и ионы можно рассматривать как имеющие некий эффективный радиус, зависящий от типа химической связи. Если рассматривать только относительные величины атомных радиусов, то легко обнаружить периодичность их зависимости от номера элемента.
В периодах орбитальные атомные радиусы по мере увеличения заряда ядра Z в общем монотонно уменьшаются из-за роста степени взаимодействия внешних электронов с ядром.
В подгруппах радиусы в основном увеличиваются из-за возрастания числа электронных оболочек.
У s- и p-элементов изменение радиусов как в периодах, так и в подгруппах более ярко, чем у d- и f-элементов, поскольку d- и f-электроны внутренние. Уменьшение радиусов у d- и f-элементов в периодах называется d- и f-сжатием. Следствием f-сжатия является то, что атомные радиусы электронных аналогов d-элементов пятого и шестого периодов практически одинаковы
|
|
|
Энергией ионизации атома I называется количество энергии, необходимое для отрыва электрона от невозбужденного атома или иона.
Энергия ионизации I выражается в кДж∙моль –1 или эВ∙атом –1. Значение I в электронвольтах численно равно потенциалу ионизации, выраженному в вольтах, поскольку E = e –·I.
Э + – e – = Э +, ΔH = I 1 – первый потенциал ионизации; Э – e – = Э 2+, ΔH = I 2 – второй потенциал ионизации и т.д. I 1 < I 2 < I 3 < I 4...
Энергия ионизации определяет характер и прочность химической связи и восстановительные свойства элементов.
Энергия ионизации изменяется периодически по мере заполнения электронами оболочек атомов (рис. 2.4).
I 1 максимален у элементов с полностью заполненными валентными оболочками (у благородных газов), при переходе к следующему периоду I 1 резко понижается – он минимален у щелочных металлов.
Энергия сродства к электрону. Другой важной в химии характеристикой атома является энергия сродства к электрону – энергия, выделяющаяся при присоединении электрона к нейтральному атому. Чем больше электронное сродство, тем более сильным окислителем является данный элемент. Экспериментальное определение энергии сродства к электрону E значительно сложнее, чем определение энергии ионизации. Величины E (в эВ) для некоторых атомов приведены ниже:
| ||||||||||||||||||||||
| Таблица 2.6. Значение энергии сродства к электрону E для некоторых атомов. |
Немонотонность изменения сродства к электрону в периоде также обусловлена сравнительной устойчивостью полностью и наполовину заполненных подоболочек. Самый сильный из всех элементарных окислителей – фтор (он обладает и самым малым атомным радиусом из всех элементов VII группы).
Отметим, что в отличие от ионизации присоединение двух и более электронов энергетически затруднено, и многозарядные одноатомные отрицательные ионы в свободном состоянии не существуют.
Окислительной способностью не обладают нейтральные атомы с устойчивыми конфигурациями s 2 и s 2p 6 и переходные элементы. У остальных элементов в таблице Менделеева окислительная способность нейтральных атомов повышается слева направо и снизу вверх.
В периодах электроотрицательность растет, а в группах уменьшается с ростом Z, то есть растет от Cs к F по диагонали периодической системы. Это обстоятельство до некоторой степени определяет диагональное сходство элементов.
Дата добавления: 2020-12-22; просмотров: 92; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
