Квантовая механика – это раздел теоретической физики, составляющая квантовой теории, описывающая физические явления на самом элементарном уровне – уровне частиц.
Атомное ядро состоит из элементарных частиц - протонов и нейтронов. Протонно-нейтронная модель ядра была предложена российским физиком Д. Д. Иваненко, а впоследствии развита В. Гейзенбергом.
+Протон (р) имеет положительный заряд, равный заряду электрона, и массу покоятp=1,6726∙10-27кг 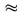 1836me, гдеme-масса электрона. Нейтрон (n)-нейтральная частица с массой покояmn= 1,6749∙10-27кг
1836me, гдеme-масса электрона. Нейтрон (n)-нейтральная частица с массой покояmn= 1,6749∙10-27кг 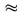 1839тe,.Массу протонов и нейтронов часто выражают в других единицах – в атомных единицах массы (а.е.м., единица массы, равная 1/12 массы атома углерода
1839тe,.Массу протонов и нейтронов часто выражают в других единицах – в атомных единицах массы (а.е.м., единица массы, равная 1/12 массы атома углерода 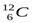 ). Массы протона и нейтрона равны приблизительно одной атомной единице массы. Протоны и нейтроны называютсянуклонами(от лат.nucleus-ядро). Общее число нуклонов в атомном ядре называетсямассовым числомА).
). Массы протона и нейтрона равны приблизительно одной атомной единице массы. Протоны и нейтроны называютсянуклонами(от лат.nucleus-ядро). Общее число нуклонов в атомном ядре называетсямассовым числомА).
Радиусы ядер возрастают с увеличением массового числа в соответствии с соотношением R = 1,4А1/310-13 см.
Ядро дейтерия (дейтрон) состоит из протона и нейтрона. Как частица, дейтрон совершенно устойчив. В то же время составная часть дейтрона, нейтрон, b-радиоактивен, т.е. неустойчив. Этот пример показывает, что понятия устойчивости и элементарности - не тождественны. В современной физике термин «Элементарные частицы» обычно употребляется для наименования большой группы мельчайших частиц материи (которые не являются атомами, или атомными ядрами).
Все элементарные частицы обладают исключительно малыми массами и размерами. У большинства из них масса порядка массы протона - 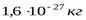 (заметно меньше лишь масса электрона
(заметно меньше лишь масса электрона 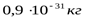 ). Микроскопические размеры и массы элементарных частиц обусловливают квантовые закономерности их поведения. Наиболее важное квантовое свойство всех элементарных частиц – способность рождаться и уничтожаться (испускаться и поглощаться) при взаимодействии с другими частицами.
). Микроскопические размеры и массы элементарных частиц обусловливают квантовые закономерности их поведения. Наиболее важное квантовое свойство всех элементарных частиц – способность рождаться и уничтожаться (испускаться и поглощаться) при взаимодействии с другими частицами.
|
|
|
+Известны четыре типа различных по своей природе взаимодействий между частицами: гравитационное, электромагнитное, ядерное, а также взаимодействие во всех процессах с участием нейтрино. Каковы особенности четырех перечисленных видов взаимодействия?
Маленькое очень массивное положительно заряженное ядро, от которого как раз и отскакивали альфа-частица в описанных опытах, расположено в центре атома Резерфорда. Вокруг ядра вращаются легкие отрицательно заряженные электроны. Большую часть пространства внутри атома заполняет пустота. В целом модель очень похожа на нашу Солнечную систему.
К великому сожалению Резерфорда, статья была встречена молчанием. Резерфорд, конечно понимал почему. Его атом был недолговечен. Электрон, вращаясь вокруг ядра, должен излучать электромагнитные волны и терять вследствие этого энергию. При этом скорость его должна была бы замедлиться, и он должен был бы упасть на ядро. Однако опыт свидетельствует, что практически все атомы в природе устойчивы.
|
|
|
Выправил ситуацию Нильс Бор.
Теория Бора
Постулаты Бора по своему характеру аналогичны законам Кеплера, которых тоже три. И те и другие являются угаданными закономерностями, полученными на основе экспериментальных фактов. Кеплеру было пожалуй даже труднее. Как, например, можно прийти к результату, что (формула)? Только после того, как Ньютон сформулировал законы механики, законы Кеплера стало возможно объяснить.
Основным недостатком модели Резерфорда было то, что электрон, движущийся по круговой орбите вокруг ядра, должен излучать электромагнитные волны, но факты говорят о том, что он не излучает. Ученые, в том числе и Резерфорд, не могли объяснить этого противоречия. Не мог этого сделать и Бор. Он просто встал на сторону фактов: раз электроны не излучают, значит так и должно быть. Так появился первый постулат. Всего как мы уже сказали их три.
Постулаты Бора
1. Электроны движутся в атоме по стационарным орбитам, при этом они не излучают и не поглощают энергии.
2. Стационарными орбитами будут те, для которых момент количества движения электрона mvr равна целому кратному
|
|
|
h=h/2pi
mrv=h/2pi*k=hk, где k=1,2,3,4…
3. При переходе с одной орбиты на другую электрон излучает или поглощает энергию в виде фотона.
Находясь на более далеких орбитах, электрон обладает большей энергией, поэтому, переходя на орбиту ближе к ядру, он излучает один фотон с энергией hv=E2-E1
Гипотеза Луи де Бройля утверждала, что частица и волна - это две стороны одной сущности. На микроуровне граница между волновыми и корпускулярными свойствами, между веществом и полем, размыта. Волновые и корпускулярные свойства не исключают, а дополняют друг друга. Свет одновременно обладает и свойствами волны, и свойствами частицы. Электроны и фотоны похожи на частицы и одновременно имеют волновые черты, что неизбежно приводит к выводу: они и не волны, и не частицы. Гипотеза де Бройля приводила к заключению:
- природа не полярна;
- не дуалистична;
- но двойственна.
Квантовая физика, по сути, отказалась от основных принципов классической механики, сформулированной некогда Галилеем, Декартом и Ньютоном. Пропасть между такими полярными в классической физике понятиями как:
- непрерывное - дискретное,
- определенное - неопределенное,
|
|
|
- однозначное - вероятностное,
- дуальное - двойственное,
- пространственное - временное,
- делимое - неделимое,
- процессуальное - случайное
существенно уменьшилась.
Таким образом, микромир плюралистичен:
- он демонстрирует не борьбу, а взаимодополнительность, комплиментарность противоположностей;
- микромир множественен, многомерен, что позволяет ему, исключая борьбу, делать свободный выбор.
- двойственность такого типа обнаруживается везде, где появляется постоянная Планка h. Квант действия h служит соединительным звеном между корпускулярным и волновым представлениями о материальных частицах, между дискретным и непрерывным представлениями о мире.
Реальные объекты, как микромира, так и макромира, обладают двойственной (двуединой) природой (как говорят в рекламах "два в одном"). Квантовая физика обнаружила комплиментарность мира, сочетания несочетаемых событий. Д. Данин в качестве синонима микромира использует метафору "кентавра", как образного представления всякого "сочетания не сочетаемого": всадник не стегает коня, а конь не норовит сбросить всадника". Такие сочетания не предполагают борьбы сторон с обязательной или желанной победой одной из разнородных ипостасей над другой. Борьба с победой или поражением одного из разнородных начал лишает смысла целое.
Квантовая механика – это раздел теоретической физики, составляющая квантовой теории, описывающая физические явления на самом элементарном уровне – уровне частиц.
Принципы квантовой механики
Состояние частицы задается двумя величинами: координатами (радиус-вектором) и импульсом. В рамках квантовой механики ставить вопрос о точном местоположении, траектории частицы не корректно. Для квантовой частицы координаты и импульс могут быть неопределёнными. Поэтому ее состояние задается двумя вероятностными функциями:
Первая характеризует неопределённые координаты частицы, вторая — неопределённые импульсы. Вместо двух указанных функций W и V в квантовой механике вводится одна, комплексная функция, называемая волновой функцией. (Комплексная функция равносильна двум функциям, т.к. состоит из двух частей: действительной и мнимой.) Достоинством такого метода является в первую очередь то, что действительная и мнимая части волновой функции являются функциями не различных переменных (х и ), а переменных одного pода: либо только координат, либо только импульсов. Итак, состояние квантовой частицы можно характеризовать волновой функцией (комплексной), в двух представлениях — либо в координатном: , либо в импульсном: . Уравнение движения свободной частицы особенно просто выглядит в импульсном представлении, т.к. импульс свободной частицы сохраняется. Это означает на квантовом языке, что функция .не зависит от времени.
Уравнение Шредингера
Уравнение же связанной частицы, на которую действуют силы, удобнее получить в координатном представлении. Нужно сказать, что в квантовой механике, строго говоря, нельзя ввести понятие силы, как нельзя ввести понятие скорости. И это ясно, если вспомнить, что по определению сила есть производная от импульса частицы по времени. Импульс же квантовой частицы является неопределённым, и его невозможно продифференцировать по времени. Поэтому взаимодействие частиц в квантовой механике характеризуют не силой, а потенциальной энергией.
Движение связанной частицы массы m будет задаваться уравнением следующего вида:
In*dFi/dt=-h^2/2m*deltaFi+U(x,y,z.t)Fi
где delta=d^2/dx^2+d^2/dy^2+d^2/dz^2 – оператор Лапласа, x.y.z. – координаты, h — постоянная Планка, деленная на 2pi.
Это уравнение называется временным уравнением Шредингера.
Если U(x,y.z,t) не зависит от времени, то решение уравнения Шредингера можно представить как:
Fi(x,y,z,t)=exp(-i/h*Et)Fi(x,y,z)
где E-полная энергия квантовой системы, а Fi(x,y,z) удовлетворяет стационарному уравнению Шредингера:
-h^2/2m*deltaFi+U(x,y,z)Fi=EFi
Уравнение Шредингера является основным уравнением движения частицы в квантовой механике. Оно не может быть выведено из других соотношений. Его следует рассматривать как исходное основное предположение, справедливость которого подтверждается тем, что все следствия из него вытекающие, подтверждаются опытами.
Волновая функция (или вектор состояния) – комплексная функция, описывающая состояние квантовомеханической системы. Её знание позволяет получить максимально полные сведения о системе, принципиально достижимые в микромире. Так с её помощью можно рассчитать все измеряемые физические характеристики системы, вероятность пребывания её в определенном месте пространства и эволюцию во времени. Волновая функция может быть найдена в результате решения волнового уравнения Шредингера.
Волновая функция ψ(x, y, z, t) ≡ ψ(x,t) точечной бесструктурной частицы является комплексной функцией координат этой частицы и времени. Простейшим примером такой функции является волновая функция свободной частицы с импульсом 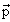 и полной энергией Е (плоская волна)
и полной энергией Е (плоская волна)
 .
.
Волновая функция системы А частиц содержит координаты всех частиц: ψ( 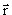 1,
1, 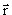 2,...,
2,..., 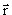 A,t).
A,t).
Квантовые числа – целые или дробные числа, определяющие возможные значения физических величин, характеризующих квантовую систему (молекулу, атом, атомное ядро, элементарную частицу). Квантовые числа отражают дискретность (квантованность) физических величин, характеризующих микросистему. Набор квантовых чисел, исчерпывающе описывающих микросистему, называют полным. Так состояние электрона в атоме водорода определяется четырьмя квантовыми числами: главным квантовым числом n (может принимать значения 1, 2, 3, …), определяющим энергию Еn электрона (Еn = -13.6/n2 эВ); орбитальным квантовым числом l = 0, 1, 2, …, n – 1, определяющим величину L орбитального момента количества движения электрона (L = [l(l + 1)]1/2); магнитным квантовым числом m < ± l , определяющим направление вектора орбитального момента; и квантовым числом ms = ± 1/2, определяющим направление вектора спина электрона.
n Главное квантовое число: n = 1, 2, … .
j Квантовое число полного углового момента. j никогда не бывает
отрицательным и может быть целым (включая ноль) или полуцелым в зависимости от свойств рассматриваемой системы. Величина полного углового момента J связана с j соотношением
J2 = 2j(j + 1). = + ,
где и векторы орбитального и спинового угловых моментов.
l Квантовое число орбитального углового момента l может принимать только целые значения: l = 0, 1, 2, … . Величина орбитального углового L момента связана с l соотношением L2 = 2l(l + 1).
m Магнитное квантовое число. Проекция полного, орбитального или спинового углового момента на выделенную ось (обычно ось z) равна m.
Для полного момента mj = j, j-1, j-2, …, - (j-1), - j. Для орбитального момента ml = l, l-1, l-2, …, -(l-1), -l.
Для спинового момента электрона, протона, нейтрона, кварка ms = ±1/2
s Квантовое число спинового углового момента s может быть либо целым, либо полуцелым. s - неизменная характеристика частицы, определяемая ее свойствами. Величина спинового момента S связана с s соотношением S2 = 2s(s + 1).
P Пространственная четность. Она равна либо +1, либо -1 и
характеризует поведение системы при зеркальном отражении. P = (-1)l.
Принцип исключения Паули утверждает, что два электрона (или два любых других фермиона) не могут иметь одинаковое квантово-механическое состояние в одном атоме или одной молекуле. Другими словами, ни одна пара электронов в атоме не может иметь одинаковые электронные квантовые числа.
Этот принцип был предложен австрийским физиком Вольфгангом Паули в 1925 году для описания поведения электронов. В 1940-м он расширил принцип до всех фермионов в своей теореме о связи спина со статистикой. Бозоны — частицы с целым числом спинов — не следуют принципу исключения. Таким образом, идентичные бозоны могут занимать одно и то же квантовое состояние (как, например, фотоны в лазерах). Принцип исключения Паули применим только к частицам с полуцелым спином.
Правило Хунда определяет последовательность заполнения состояний электронов в рамках подгруппы, то есть при одном l. Это правило гласит: прежде всего, заполняются состояния имеющие разные величины магнитного квантового числа m (m=−l,−l+1,…l−1,l), при неизменном значении проекции спина; после того, как все 2l+1 состояние по магнитному квантовому числу заполнены электронами начинается заполнение электронами, которые имеют противоположную ориентацию спина. Так, в p-состояние (l=1) может находиться всего: При этом состояния заполняются как: Рисунок 1. Другими словами правило Хунда можно сформулировать так: в большинстве случаев электроны в атоме являются неспаренными, по возможности они имеют параллельные спины. Или: минимальной энергией обладает терм с наибольшим, из возможных при заданной конфигурации электронов величиной полного спина (S). В том случае, если S задано, то максимальным полным орбитальным моментом (L). Информация взята с сайта биржи
Два принципа определяют строение электронной оболочки атома элемента: принцип Паули, который гласит: в атоме может существовать только один электрон с определенным набором квантовых чисел, что учитывает квантовые свойства возможных состояний атома;
Принципом минимума энергии: при известном суммарном количестве электронов в атоме реализуется состояние с наименьшей энергией. Данный принцип является естественным для существования устойчивого состояния атома. Так как, если состояние атома не является состоянием с наименьшей энергией, то атом может под воздействием внутренних причин перейти в состояние с минимумом энергии. Анализируя строение атома в первом приближении, пренебрегают энергией взаимодействия электронов. При этом энергию атома приравнивают к суммарной энергии электронов в поле, которое создается ядром атома. Отталкиваясь от данной известной энергии, находят распределение электронов по разным состояниям при учете принципа Паули и минимума энергии. При этом получают идеальную схему заполнения оболочек. Надо отметить, что идеальная схема заполнения может сильно отличаться от реально существующей. Исходя из принципа Паули, максимальное количество электронов (N), которое может находиться в оболочке равно: где n -- главное квантовое число, l=0,1...,n−1 (при заданном n) - орбитальное квантовое число. Энергия электрона в поле ядра растет при увеличении главного квантового числа. Минимальную энергию имеют электроны на K - оболочке (n=1), потом на L- оболочке (n=2) и далее. Что означает последовательное заполнение оболочек, начиная с K (K,L,M,...).
Дата добавления: 2020-12-22; просмотров: 84; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
