Октановое число бензина (водитель)
|
 |

 СН3- СН- СН2- С - СН3
СН3- СН- СН2- С - СН3
| ||||
| ||||
Изооктану приписано октановое число 100.
Гептану СН3-СН2-СН2-СН2-СН2-СН2-СН3, который очень легко детонирует, прописано октановое число 0. Октановое число бензина определяют сравнением его свойств со свойствами смесей изооктана и гептана. Если характеристики бензина такие же, как у смеси 75 % изооктана и 25 % гептана, говорят, что октановое число бензина равно 75.
В результате длительных исследований было обнаружено, что тетраэтилсвинец Pb(С2Н5)4 снижает способность неразветвленных углеводородов детонировать. Поэтому тетраэтилсвинец, называемый антидетонатором, добавляют в бензин. Чтобы предохранить цилиндры от нарастания на их внутренних стенках оксида свинца, в бензин добавляют также 1,2-дибромэтан BrСН2СН2Br. При этом отработанный свинец превращается в летучий тетрабромид и удаляется с выхлопными газами.
|
|
|
При попадании свинца в организм человека, даже в умеренных количествах, возникает депрессия, снижается реакция.
В некоторых странах запрещено использовать бензин, содержащий свинец.
Карбоновые кислоты
Карбоновыми кислотами называются соединения, в которых имеется карбоксильная группа - COOH .При взаимодействии карбоновых кислот со спиртами получаются сложные эфиры. Сложные эфиры глицерина и высших карбоновых кислот нормального строения называют жирами и маслами. Соли высших жирных кислот называют мылами.
По числу карбоксильных групп карбоновые кислоты бывают одно-, двух-, трех- и т.д. основными кислотами.
Свойства
Температуры кипения кислот значительно больше, чем у углеводородов, если сравнивать вещества с одинаковым числом углеродных атомов.
Важнейшей реакцией карбоновых кислот является реакция этерификации.
|
|
|
Отдельные представители карбоновых кислот
HCOOH - муравьиная кислота - самая сильная из карбоновых кислот. Наряду с общими свойствами карбоновых кислот муравьиная кислота имеет и важные индивидуальные особенности:
1) дает реакцию "серебряного зеркала":
2) при нагревании с концентрированной H2SO4 разлагается до CO:
используется для получения щавелевой кислоты :в текстильной промышленности, при силосовании кормов.
CH3-COOH - уксусная кислота. Безводная уксусная кислота ниже 16o C представляет собой прозрачные кристаллы (как лед) поэтому ее называют "ледяной уксусной кислотой". 70-80 % пищевая уксусная кислота называется "уксусной эссенцией". Уксусная кислота получается при сухой перегонке дерева. Уксусная кислота широко применяется для различных синтезов как в лабораторной практике, так и в химической промышленности: для получения этилацетата, ацетата целлюлозы. Ацетаты алюминия, хрома, железа применяют при крашении тканей, ацетат меди - для борьбы с насекомыми и вредителями растений.
Оксиды
Оксидами называют соединения элементов с кислородом, в которых кислород проявляет формальную степень окисления равную -2 (за исключением оксида фтора, где она равна +2).
|
|
|
Один и тот же химический элемент может образовывать с кислородом не один оксид, а несколько, например, у азота известны оксиды N2O, NO, N2O3, NO2, N2O4, N2O5. Во всех этих оксидах степень окисления у кислорода -2, а у азота, соответственно, +1, +2, +3, +4, +4 и +5.
Свойства основных оксидов
Прежде всего надо показать, что отвечающие им гидроксиды являются основаниями:
CaO + H2O = Ca(OH)2,
Ca(OH)2 = Ca2+ + 2OH-,
т.е. оксиды щелочных и щелочно-земельных металлов при взаимодействии с водой дают растворимые в воде основания, которые называются щелочами. Основные оксиды, реагируя с кислотными или амфотерными оксидами, дают соли:
CaO + SO3 = CaSO4,
Свойства кислотных оксидов
Отвечающие кислотным оксидам гидроксиды являются кислотами:
SO3 + H2O = H2SO4,
H2SO4 = 2H+ + SO42- .
Свойства амфотерных оксидов
Отвечающие амфотерным оксидам гидроксиды обладают амфотерными свойствами:
Zn(OH)2 = Zn2+ + 2OH-,
H2ZnO2 = 2H+ + ZnO22-.
Оксиды загрязнители окружающей среды
При сжигании 1 л бензина в двигателе внутреннего сгорания расходуется до 1,5 кг кислорода, если углеводородное горючее сгорает до CO2 и H2O. К сожалению, часть горючего при переходных режимах работы двигателя сгорает не полностью или окисляется только до CO. Автомобильный транспорт служит основным источником загрязнения воздуха больших городов и прилегающих территорий. Кроме CO в атмосферу выбрасываются продукты окисления атмосферного азота, в основном NO и NO2.
|
|
|
Твердое топливо, особенно низкосортные каменные угли и некоторые мазуты, при сжигании загрязняет атмосферу оксидами серы SOx, если не использовать химические поглотители.
Нарушение кислородного баланса связывают с уменьшением площади «легких планеты», вызванным нерациональной вырубкой лесов Сибири и Южной Америки, загрязнением мирового океана. Повышение содержания CO2 лежит в основе парникового эффекта.
Альдегиды
Альдегиды содержат функциональную группу 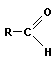 .
.
HCOH – формальдегид, муравьиный альдегид, метаналь;
CH3 COH – ацетальдегид, уксусный альдегид, этаналь.
Получение
Альдегиды получают дегидрированием первичных спиртов: окислением первичных спиртов,гидратацией ацетилена в присутствии солей двухвалентной ртути (реакция Кучерова):
Свойства
Температуры кипения альдегидов значительно меньше температур кипения спиртов.
Альдегиды с аммиачным раствором окиси серебра дают реакцию "серебряного зеркала":
Наибольшее значение в промышленности приобрели реакции поликонденсации формальдегида с мочевиной с образованием карбамидных смол и с фенолом с образованием фенолформальдегидных смол
Применение
Формальдегид также применяется для дубления кож, протравливания семян. Ацетальдегид используется для получения уксусной кислоты, уксусноэтилового эфира. Бензальдегид находит применение при синтезе красителей.
Кислоты
На основе теории электролитической диссоциации кислоту можно определить как сложное вещество, молекулы которого в растворе диссоциируют на ионы водорода и анионы кислотного остатка.
Кислоты подразделяют на бескислородные (HBr, H2S) и кислородосодержащие (HNO3). Еще кислоты делят на одно-, двух-, трехосновные, по числу атомов водорода, способных замещаться на металл.
Получение
1. Растворением некоторых активных неметаллов в воде:
Cl2 + H2O = HCl + HOCl .
2. Синтезом из простых веществ:
H2 + Cl2 = 2HCl,
H2 + S = H2S.
3. Растворением кислотных оксидов в воде:
P2O5 + 3H2O = 2H3PO4.
4. Окислением кислот:
2HNO2 + O2 = 2 HNO3.
5. Реакцией обмена - кислота + соль:
KNO3 + H2SO4→KHSO4 + HNO3.
Свойства
1. Диссоциируют на ионы растворенной в воде части кислот:
2. Взаимодействуют с металлами и металло-неметаллами:
2Al + 6HCl = 2AlCl3 + 3H2.
3. Вступают в реакцию нейтрализации:
HBr + KOH = KBr + H2O,
4. Вытесняют более слабые или более летучие кислоты из солей:
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O,
6. Подвергаются разложению при нагревании:
H2SiO3 →SiO2 + H2O.
Жиры
Главной составной частью растительных и животных жиров являются сложные эфиры глицерина и высших жирных кислот (стеариновой, пальмитиновой, олеиновой, линолевой и др.). Первый синтез жира осуществил Бертло в 1854 г. при нагревании глицерина и стеариновой кислоты:
В состав твердых жиров (или просто жиров) входят высшие предельные кислоты (стеариновая, пальметиновая и др.), а в состав жидких жиров (растительных масел) входят непредельные кислоты (олеиновая, линолевая и др.).
Жиры легко подвергаются гидролизу (омылению), при этом получают глицерин и высшие органические кислоты. Если гидролиз проводить с помощью щелочи, то получаются соли соответствующих кислот, которые называются мылами.
Лучшие сорта гидрированного жира используются для получения маргарина:
Жиры используются в пишевой промышленности, для приготовления олифы, смазочных масел, для фармацевтических целей, для изготовления линолиума и клеенок.
Мыла и моющие средства
Обычное твердое мыло представляет собой смесь натриевых солей пальметиновой и стеариновой кислот. Жидкие мыла - шампуни - это калиевые соли этих кислот. Из растительных и животных жиров гидролизом (омылением) в присутствии едкого натра получают твердые мыла: а жидкие мыла получают гидролизом жиров с помощью гидроксида калия.
В настоящее время для стирки в быту, для промывки шерсти и тканей в промышленности используют синтетические моющие средства, которые обладают в 10 раз большей моющей способностью, чем мыла, не портят тканей, не боятся жесткой и даже морской воды. Сырьем для их изготовления являются продукты переработки нефти.
Основания
Основания - это такие гидроксиды, которые в растворе диссоциируют, давая катионы металла и анионы гидроксила. Растворимые в воде основания называют щелочами. К щелочам относят гидроксиды щелочных и щелочноземельных металлов и NH4OH.
Получение
1. Растворением щелочных и щелочноземельных металлов и NH3 в воде:
Ca + 2H2O = Ca(OH)2 + H2,
2. Растворением оксидов щелочных и щелочноземельных металлов в воде:
BaO + H2O = Ba(OH)2.
3. Окислением оснований:
4Fe(OH)2 + O2 +2H2O = 4Fe(OH)3.
4. Реакцией обмена - основание + соль:
MgCl2 + Ba(OH)2 = Mg(OH)2 + BaCl2,
Na2CO3 + Ca(OH)2 = CaCO3 + 2 NaOH.
5. Электролизом растворов солей:
2KCl + 2H2O = 2 KOH + H2+ Cl2.
Свойства
1. Диссоциируют на ионы растворенной в воде части основания:
2. Взаимодействуют с металло-неметаллами и неметаллами:
Cl2 + 2KOH = KCl + KClO + H2O.
3. Вступают в реакцию нейтрализации:
Ba(OH)2 + 2HCl = BaCl2 + 2H2O.
4. Вытесняют нерастворимые или более слабые основания из солей:
CuCl2 + 2NaOH = Cu(OH)2 + 2NaCl.
5. Подвергаются разложению при нагревании:
Mg(OH)2→MgO + H2O.
Глюкоза (C6H12O6)
Получение
Впервые глюкоза была получена в 1811 г. русским химиком Г.З.Кирхгофом гидролизом крахмала. И сейчас ее получают гидролизом крахмала и целлюлозы.
Свойства
Глюкоза относится к моносахаридам - это многоатомные спирты с дополнительной альдегидной или кетонной функциональной группой. Так, у глюкозы наблюдаются многие реакции, характерные для альдегидов. Альдегидная группа легко окисляется в карбоксильную, например аммиачным раствором гидрата окиси серебра в результате получается глюконовая кислота (реакция "серебряного зеркала").
Как многоатомный спирт, глюкоза обладает следующими свойствами :при взаимодействии с уксусным ангидридом дает сложный эфир, при взаимодействии с метиловым спиртом дает простой эфир:
У глюкозы есть и специфические реакции, не встречающиеся ни альдегидов, ни у многоатомных спиртов, - это процесс расщепления глюкозы под действием микроорганизмов: спиртовое брожение:
C6H12O6 → 2CH3-CH2-OH + 2CO2,
молочнокислое брожение:
C6H12O6→2CH3-CHOH-COOH (молочная кислота).
Соли
Соли - это сложные вещества, которые диссоциируют, образуя катионы металла (или NH4+) и анионы кислотного остатка. Кислые соли при диссоциации дают дополнительно ионы H+, а основные соли - ионы гидроксила OH-. Среди солей выделяют двойные, смешанные и комплексные.
Получение
1. Взаимодействием металлов и металло-неметаллов с неметаллами:
2Na + Cl2 = 2NaCl,
2Al + 3Cl2 = 2AlCl3.
2. Взаимодействием неметаллов с другими солями:
2KI + Br2 = 2KBr + I2,
3. Вытеснением более активным металлом более пассивного из его соли:
CuSO4 + Fe = FeSO4 + Cu.
4. Взаимодействием основных, амфотерных и кислотных оксидов:
Li2O + ZnO = Li2ZnO2,
CaO + SiO2 = CaSiO3,
Al2O3 + 3SO3 = Al2(SO4)3.
5. Взаимодействием основных, амфотерных и кислотных оксидов с основными, амфотерными и кислотными гидроксидами:
2LiOH + ZnO = Li2ZnO2 + 2H2O,
Ca(OH)2 + CO2 = CaCO3 + H2O,
Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O.
6. Взаимодействием основных, амфотерных гидрооксидов с кислотами:
Al(OH)3 + KOH = K[Al(OH)4],
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O,
Zn(OH)2 + 2HBr = ZnBr2 + 2H2O.
7. Путем обменных реакций основных, амфотерных гидрооксидов, кислот и солей с солями:
Ba(OH)2 + Na2SO4 = BaSO4+ 2NaOH,
8. Термическим разложением солей:
2KClO3 = 2KCl + 3O2,
2NaNO3 = 2NaNO2 + O2
Свойства
1. Диссоциируют в растворах или расплавах:
2. Способны подвергаться гидролизу (кроме солей, образованных одновременно сильными одноосновными кислотами и щелочными металлами):
MgCl2 + H2O→Mg(OH)Cl + H+ + Cl-,
3. Могут взаимодействовать с основными и амфотерными гидроксидами, кислотами и солями, вступая в реакции обмена
Крахмал
Полисахариды можно рассматривать как продукты конденсации большого числа молекул моносахаридов друг с другом. Их состав можно выразить формулой: (C6H10O5)n, где n достигает значений нескольких десятков тысяч. Важнейшие из полисахаридов - крахмал и целлюлоза.
Крахмал - это белое вещество, состоящее из мелких зерен. Он не растворим в холодной воде, но набухает и постепенно растворяется в горячей воде, образуя студенистую массу - клейстер.
Крахмал образуется при фотосинтезе и откладывается в корнях, клубнях и семенах растений в виде "запасного углевода". В животном мире такую же роль играет гликоген, который откладывается, в основном, в печени. Крахмал не дает реакцию "серебряного зеркала".
Качественной реакцией на крахмал является его реакция с иодом - появляется интенсивное синие окрашивание.
При кислотном гидролизе из крахмала можно получить глюкозу в виде чистого кристаллического препарата или в виде патоки - сиропообразной жидкости:
Крахмал является главным источником углеводов в рационе питания человека, его потребляет в виде хлеба, картофеля, круп и т.д. Чистый крахмал применяют в пищевой промышленности при производстве кондитерских и кулинарных изделий, колбас и т.д.
Коррозия
Коррозия (от позднелат. corrosio — разъедание), разрушение твердых тел, вызванное химическими и электрохимическими процессами, развивающимися на поверхности тела при его взаимодействии с внешней средой. Особенный ущерб народному хозяйству приносит коррозия металлов. Распространенный вид — ржавление железа. В результате коррозии ежегодно теряется ок. 10% общего количества выплавляемых черных металлов. Может быть уменьшена или практически устранена нанесением защитных покрытий, напр. лакокрасочных; введением в среду ингибиторов, напр. хроматов, нитритов, арсенитов; применением коррозионностойких материалов. Коррозионному разрушению подвержены также бетон, строительный камень, дерево, другие материалы; коррозия полимеров называется деструкцией.
Ржавчина, слой частично гидратированных оксидов железа, образующийся на поверхности железа и некоторых его сплавов в результате коррозии, вызванной действием кислорода и влаги.
Целлюлоза (клетчатка)
Целлюлоза представляет собой полисахарид построенный из молекул b-глюкозы. Из клетчатки состоят стенки растительных клеток. Хлопок (вата) - почти чистая целлюлоза (98 %). В древесине примерно 50 % целлюлозы.
Целлюлоза не растворима в воде, хотя полигидроксильные соединения в воде легко растворяются. Это объясняется тем, что как вещество целлюлоза состоит из нитевидных молекул, которые соединены водородными связями гидроксильных групп. Целлюлоза не дает реакции "серебряного зеркала".
Химические свойства целлюлозы - это свойства многоатомного спирта.
Тринитрат целлюлозы известен в технике под названием "пироксилин". Из него изготовляют бездымный порох. Клетчатку применяют для получения бумаги, пороха, искусственных волокон, гидролизного спирта.
Теория Аррениуса
Электрохимия - это наука о электрических явлениях, которые сопровождают химические процессы.
Для объяснения этих особых свойств растворов электролитов в 1887 г. шведский химик С.Аррениус (1859-1927) предложил Теорию электролитической диссоциации. Ее основные положения.
1. При растворении в воде молекулы кислот, оснований и солей диссоциируют на ионы:
HCl→H+ + Cl-,
KOH→K+ + OH-,
Na2SO4→2Na+ + SO42-.
2. Диссоциация молекул на ионы у слабых электролитов является неполной. Поэтому следует ввести понятие "степень диссоциации" (a) и определять его, как долю молекул, распавшихся на ионы.
На основе теории электролитической диссоциации все свойства растворов электролитов нашли естественное объяснение и была создана первая теория кислот и оснований. Кислоты - это соединения, молекулы которых диссоциируют на катионы водорода и анионы кислотного остатка. Основания - это соединения, молекулы которых диссоциируют на катионы металла и анионы гидроксила.
К сильным электролитам относятся почти все соли, ряд неорганических кислот (HCl, HBr, HI, HNO3, H2SO4, HClO4), гидроксиды щелочных и щелочноземельных металлов (щелочи). К слабым электролитам относится соль Fe(SCN)3 - роданистое железо, большинство кислот и оснований [H2S, H2CO3, Al(OH)3, NH4OH]. К электролитам средней силы относятся HF, H3PO4, H2SO3.
Дата добавления: 2020-11-29; просмотров: 87; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
