Периодическая система химических элементов Д.И. Менделеева
Содержание
| Введение | 5 |
| Периодическая система химических элементов Д.И. Менделеева | 8 |
| Алканы | 9 |
| Химическая связь | 11 |
| Алкены | 12 |
| Классификация химических реакций | 13 |
| Полимеры (ВМС) | 14 |
| Обратимые и необратимые реакции | 16 |
| Алкины | 17 |
| Скорость химических реакций | 17 |
| Спирты | 18 |
| Теория строения органических веществ Бутлерова | 20 |
| Электролитическая диссоциация | 21 |
| Изомеры | 23 |
| Электролиз | 24 |
| Аллотропия | 25 |
| Фенол | 26 |
| Октановое число бензина | 26 |
| Карбоновые кислоты | 28 |
| Оксиды. | 29 |
| Альдегиды | 31 |
| Кислоты | 32 |
| Жиры | 3343 |
| Основания | 36 |
| Глюкоза (C6H12O6) | 37 |
| Соли | 39 |
| Коррозия | 40 |
| Целлюлоза (клетчатка) | 40 |
| Теория Аррениуса | 41 |
| Способы получения металлов на примере железа | 42 |
| Каучуки | 43 |
| Белки | 44 |
| Зачеты | 46 |
| Используемая литература | 55 |
Введение
Содержание конспектов по дисциплине «Химия» направлено на достижение следующих целей:
• формирование у обучающихся умения оценивать значимость химического знания для каждого человека;
• формирование у обучающихся целостного представления о мире и роли химии в создании современной естественно-научной картины мира; умения объяснять объекты и процессы окружающей действительности: природной, социальной, культурной, технической среды, — используя для этого химические знания;
• развитие у обучающихся умений различать факты и оценки, сравнивать оценочные выводы, видеть их связь с критериями оценок и связь критериев с определенной системой ценностей, формулировать и обосновывать собственную позицию;
|
|
|
• приобретение обучающимися опыта разнообразной деятельности, познания и самопознания; ключевых навыков, имеющих универсальное значение для различных видов деятельности (навыков решения проблем, принятия решений, поиска, анализа и обработки информации, коммуникативных навыков, навыков измерений, сотрудничества, безопасного обращения с веществами в повседневной жизни).
Освоение содержания учебной дисциплины «Химия», обеспечивает достижение студентами следующих результатов:
• личностных: чувство гордости и уважения к истории и достижениям отечественной химической науки; химически грамотное поведение в профессиональной деятельности и в быту при обращении с химическими веществами, материалами и процессами;
− готовность к продолжению образования и повышения квалификации в избранной профессиональной деятельности и объективное осознание роли химических компетенций в этом;
− умение использовать достижения современной химической науки и химических технологий для повышения собственного интеллектуального развития в выбранной профессиональной деятельности;
|
|
|
• метапредметных:
− использование различных видов познавательной деятельности и основных интеллектуальных операций (постановки задачи, формулирования гипотез, анализа и синтеза, сравнения, обобщения, систематизации, выявления причинно-следственных связей, поиска аналогов, формулирования выводов) для решения поставленной задачи, применение основных методов познания (наблюдения, научного эксперимента) для изучения различных сторон химических объектов и процессов, с которыми возникает необходимость сталкиваться в профессиональной сфере;
− использование различных источников для получения химической информации, умение оценить ее достоверность для достижения хороших результатов в профессиональной сфере;
• предметных:
− сформированность представлений о месте химии в современной научной картине мира; понимание роли химии в формировании кругозора и функциональной грамотности человека для решения практических задач;
− владение основополагающими химическими понятиями, теориями, законами и закономерностями; уверенное пользование химической терминологией и символикой;
|
|
|
− владение основными методами научного познания, используемыми в химии: наблюдением, описанием, измерением, экспериментом; умение обрабатывать, объяснять результаты проведенных опытов и делать выводы; готовность и способность применять методы познания при решении практических задач;
− сформированность умения давать количественные оценки и производить расчеты по химическим формулам и уравнениям;
− владение правилами техники безопасности при использовании химических веществ;
− сформированность собственной позиции по отношению к химической информации, получаемой из разных источников.
Периодическая система химических элементов Д.И. Менделеева
Периодическая таблица химических элементов – графическое изображение периодического закона. Каждое число в ней характеризует какую-либо особенность в строении атомов: порядковый номер элемента = заряд ядра его атома (число протонов). Число нейтронов рассчитывают: N = A – Z , где А – массовое число (масса), Z – порядковый номер.
Номер периода – число энергетических уровней (электронных слоев) в атомах элементов данного периода.
|
|
|
Период – горизонтальный ряд элементов, в пределах которого свойства изменяются последовательно (от щелочного металла до благородного газа). Периоды бывают малые (1-3) и большие (4-7).
Номер группы – число электронов на внешнем уровне и высшая степень окисления в соединениях для элементов главных подгрупп и максимальное число валентных электронов для элементов побочных подгрупп.
Группа включает сходные по свойствам элементы и делится на главную (входят элементы малых и больших периодов) и побочную (входят элементы больших периодов).
В периодах с увеличением зарядов атомных ядер элементов (слева направо) металлические (восстановительные) свойства ослабевают, а неметаллические (окислительные) усиливаются, т.к.
Возрастает число электронов на внешнем уровне атома;
Число энергетических уровней в атомах остается постоянным;
Уменьшается радиус атомов. В периодах:высшая положительная степень окисления увеличивается от +1 до +8;низшая степень окисления увеличивается от - 4 до -1;в соединениях элементов происходит усиление кислотных и ослабление основных свойств.
В группах (главных подгруппах) с увеличением зарядов атомных ядер элементов (сверху вниз) металлические свойства (восстановительные) усиливаются, неметаллические (окислительные) ослабевают, т.к.
Число электронов на внешнем уровне атомов остается одинаковым;
Увеличивается число энергетических уровней в атоме;
Увеличивается радиус атомов. В группах: высшая положительная степень окисления постоянна;низшая степень окисления не изменяется и равна (8- n ), где n – номер группы для (4 – 7 групп).основные свойства соединений усиливаются, кислотные ослабевают.
Алканы
Насыщенные соединения (предельные соединения), органические соединения, в молекулах которых атомы соединены между собой только простыми связями в «открытые» цепи. К насыщенным соединениям относятся, напр., алканы, или парафины, общей формулы СnH2n+2 (метан СН4, этан С2Н6). Насыщенные углеводороды содержатся главным образом в нефти и природном газе. Их производные получают различными синтетическими методами. МЕТАН, CH4, бесцветный газ, tкип 164 °C. Основной компонент природных (77-99%), попутных нефтяных (31-90%), рудничного и болотного газов. Горит бесцветным пламенем. С воздухом образует взрывоопасные смеси. Сырье для получения многих ценных продуктов химической промышленности — формальдегида, ацетилена, сероуглерода, хлороформа, синильной кислоты, сажи. Применяется как топливо.
Химические свойства
Хлорирование - введение в молекулы органического соединения атомов хлора, напр.:
СН4 + Сl2 →СН3Сl + НСl.
Галогенирование (особенно хлорирование и фторирование) широко применяется для получения растворителей, хладонов, полимеров и красителей.
Получение
В промышленности углеводороды можно получать перегонкой нефти в ректификационной колонне. При этом получают обычно нефтяные фракции, кипящие в определенном интервале температур (бензин - температура кипения от 40 до 200° C, керосин - температура кипения от 200 до 275° C, дизельное топливо - температура кипения от 200 до 400°C, смазочные масла - температура кипения выше 300° C, в остатке мазут).
В лабораторной практике насыщенные углеводороды можно получать:
1. Гидрированием ненасыщенных и циклических углеводородов с никелевым катализатором:
R-CH=CH2 + H2 → R-CH2-CH3
2. Синтезом Вюрца из галогенпроизводных углеводородов:
2R-Br + 2Na → 2NaBr + R-R,
3. При сплавлении солей карбоновых кислот с щелочами:
R-COONa + NaOH → R-H + Na2CO3.
Применение
Низшие алканы содержатся в природном газе и в попутном газе нефтяных месторождений. Нефть представляет собой, в основном, смесь средних и высших алканов. Газ и нефть широко используются как топливо и исходное сырье для многих химических производств. Все алканы являются ценными исходными продуктами для различных органических синтезов.
Химическая связь
Силы, удерживающие атомы в новых образованиях, получили обобщенное название «химическая связь». Важнейшие виды химической связи: ионная, ковалентная, металлическая,
Химическая связь обычно изображается черточками, соединяющими взаимодействующие атомы; каждая черта эквивалентна обобщенной паре электронов.
Ковалентная связь – наиболее общий вид химической связи, возникающий за счет обобществления электронной пары посредством обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону.
Классический пример неполярной ковалентной связи (разность электроотрицательностей равна нулю) наблюдается у гомоядерных молекул: H–H, F–F.
При образовании гетероатомной ковалентной связи электронная пара смещена к более электроотрицательному атому, что делает такую связь полярной. (HCl, H2O).
Ионная связь – частный случай ковалентной, когда образовавшаяся электронная пара полностью принадлежит более электроотрицательному атому
Каждый ион в ионном соединении притягивает такое число ионов противоположного знака, чтобы образовалась кристаллическая решетка ионного типа. В ионном кристалле нет молекул. Каждый ион окружен определенным числом ионов другого знака Ионные пары могут существовать в газообразном состоянии в виде полярных молекул (NaCl ).
Металлическая связь возникает в решетке металлов. Силы связи обусловливают высокую тепло- и электропроводность.
Алкены
Алкены (олефины) – ненасыщенные ациклические углеводороды с одной двойной связью, общая формула гомологического ряда CnH2n. Название образуется от углеводорода с наиболее длинной цепью, содержащей двойную связь, с добавлением суффикса -ен. Цифрой указывается положение двойной связи.

 этен (этилен)
этен (этилен)
Применение
Содержатся в продуктах переработки нефти и природных газов. Широко используются для синтеза полимеров и др. ценных промышленных продуктов.
Химические свойства
Реакции присоединения сопровождаются разрывом кратных связей:

| + | 
| → | 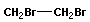
|
| 1,2-дибромэтан |
Дата добавления: 2020-11-29; просмотров: 81; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
