Пациентам с гнойным плевритом необходимо выполнять торакоцентез и дренирование плевральной полости.
АБТ – антибактериальная терапия
ВП – внебольничная пневмония
ОГДП – острая гнойная деструктивная пневмония
УЗИ – ультразвуковое исследование
MRSA – (Methicillin-resistant Staphylococcus aureus)
Метициллинрезистентный золотистый стафилококк
Кодирование по МКБ 10
J 85-J86 – Гнойные и некротические состояния нижних дыхательных путей
J85.1 – Абсцесс легкого с пневмонией
J86 – Пиоторакс (пиопневмоторакс)
J93 – Пневмоторакс
Термины и определения
Лобит – пневмония, охватывающая долю легкого.
Абсцесс легкого – полость, заполненная гноем и отграниченная от окружающих тканей, развивающаяся в легких как осложненная пневмония.
Булла легкого – воздушная полость в легком.
Пиоторакс – скопление гноя в плевральной полости.
Пиопневмоторакс – скопление гноя и воздуха в плевральной полости.
Пневмоторакс – наличие воздуха в плевральной полости.
Напряженный пневмоторакс – выраженная степень клапанного пневматорокса, при котором давление воздуха в плевральной полости значительно превышает атмосферное.
Плеврит – воспаление плевры.
Плеврит парапневмотический – плеврит, возникший в процессе развития пневмонии.
Синдром внутриплеврального напряжения – сочетание нарушений дыхания и кровообращения, обусловленных сдавлением легкого и смещением средостения в противоположную сторону; наблюдается при скоплении воздуха и (или) жидкости в плевральной полости.
|
|
|
Плевральный синус – часть плевральной полости, расположенная в месте перехода одной части пристеночной плевры в другую.
Фибринолиз – процесс растворения фибринового сгустка в результате ферментативных реакций.
Профессорско-преподавательский состав
кафедры.

Геннадий Иванович Чепурной родился 7 марта 1939 г. в Ростове-на-Дону. Окончив школу с золотой медалью в 1956 г, поступил в Ростовский медицинский институт, который окончил с отличием в 1962 г. С 1 курса был Ленинским стипендиатом. По распределению в течение четырех с половиной лет работал районным хирургом в Дубовском районе Ростовской области. В 1966 г был зачислен ординатором торакального отделения в клинику госпитальной хирургии, руководимую проф. П.П. Коваленко. В 1969 г. защитил кандидатскую диссертацию, посвященную пластическому восстановлению пищевода ори его рубцовых сужениях. Продолжив работу по этой научной тематике, он за 7 лет собрал обширный клинический материал, который лег в основу его докторской диссертации «Обоснование выбора пластики пищевода при рубцовых сужениях (экспериментально-клиническое исследование)», которую он успешно защитил в Москве в 1977 г. Педагогическая деятельность Г.И. Чепурного началась в 1969 году. Став доктором медицинских наук. Он проводил занятия со студентами 2 курса лечебного факультета на базе областной больницы, совершенствуя одновременно свои знания по торакальной, абдоминальной и сосудистой хирургии. Студенты и врачи полюбили Геннадия Ивановича за доброту, порядочность, честность и удивительную работоспособность. В 1980 ему было присвоено звание профессора. В 1982 он занял вакантное место заведующего кафедрой детской хирургии РостГМУ. В настоящее время продолжает работать в этой должности. За 30-летний период работы на кафедре он организовал службу хирургии новорожденных, открыл детское урологическое отделение, отделение ожоговой трав- мы, расширил детское ортопедотравматологическое отделение. Под его научным руководством защищены 34 кандидатские диссертации; он был научным консультантом 6 докторских диссертаций. Г.И. Чепурной опубликовал более 350 научных работ в журналах, материалах Российских и международных конгрессов, съездов и конференций; он соавтор 5 монографий, 40 патентов на изобретения. Иллюстрации во многих работах выполнены им лично. Г.И. Чепурной является членом редакционного совета журнала «Детская хирургия», в течение более 20 лет — председателем диссертационного совета университета по специальностям хирургия, детская хирургия, урология. За личный вклад в развитие отечественной детской хирургии и создание научной школы детских хирургов Юга России ГИ. Чепурной в 2006 удостоен почетного звания «Заслуженный деятель науки РФ». За большой вклад в развитие детской хирургии России и СНГ в 2016 г. Г.И. Чепурной удостоен «Премии имени С.Д. Терновского». В 2020году  награжден званием «Отличник здравоохранения».
награжден званием «Отличник здравоохранения».
|
|
|
|
|
|
Чепурной Михаил Геннадьевич,
заведующий кафедрой «Детской хирургии и ортопедии» Ростовского государственного медицинского университета. Врач высшей категории, доктор медицинских наук, профессор.
<…………………… >
<……………………………………………….>
and other…
История кафедры

Кафедра детской хирургии и ортопедии была организована в Ростовском государственном медицинском институте в 1956 году. Основателем и первым руководителем кафедры был доктор медицинских наук, профессор Ковалевич Марк Диомидович.
М.Д. Ковалевич – воспитанник Ростовского мединститута, который закончил ординатуру и защитил кандидатскую диссертацию на кафедре факультетской хирургии под руководством профессора Н.И. Напалкова. Затем он работал практическим хирургом в Кабардино-Балкарии. Там ему довелось оказывать хирургическую помощь К.Е. Ворошилову, который серьезно ранил руку на охоте с повреждением сухожилий. Операция в анатомическом и функциональном плане была выполнена безупречно, что имело существенное значение в личной карьере Ковалевича М.Д. в дальнейшем.
|
|
|
Затем М.Д. Ковалевич прошел хорошую хирургическую школу, работая доцентом на кафедре госпитальной хирургии РГМИ, возглавляемой профессором Н.А. Богоразом, а позже профессором З.И. Карташевым.
Ковалевич М.Д. был специалистом широкого профиля, и поэтому на кафедре детской хирургии и ортопедии лечение получали дети с различной патологией. Однако в работе кафедры были приоритетные направления. Много оперировалось детей с эхинококковыми кистами легких и печени. Диагностика их, а также хирургическое лечение (эхтнококкотомии) были, как правило, успешными. Разработка чрезбрюшинного доступа для удаления опухолей почек (нефросаркома) у детей, фиксация яичка к бедру при низведении его в мошонку при крипторхизме (фиксация по Каценштейну-Ковалевичу), а также разработка показаний и объема оперативного вмешательства при хроническом гематогенном остеомиелите – таков неполный перечень основных достижений кафедры. Много детей проходили лечение по поводу врожденной косолапости и врожденного вывиха бедра, которое в основном было консервативным. М.Д. Ковалевичу принадлежит монография на тему острой кишечной непроходимости. Разрабатывались методы лечения осложненных переломов в области локтевого сустава, пороков развития у новорожденных. Это было время становления детской анестезиологической и реанимационной помощи. М.Д. Ковалевич выполнял сложные оперативные вмешательства при болезни Гиршпрунга, при опухолях средостения и др. В эту пору было пролечено свыше 200 детей с ортопедическими осложнениями эпидемии полиомиелита на Дону. Под его научным руководством было защищено 5 кандидатских диссертаций.

Первыми сотрудниками кафедры были ассистент Г.П. Маклецов и А.Е. Лелюджан, которая впоследствии стала доцентом кафедры. С 1969 года кафедра расширилась, и в нее вошли бывший кружковец кафедры, защитивший кандидатскую диссертацию, Б.Б. Золотовский и Е.А. Ставская. В 1972году профессор М.Д. Ковалевич ушел на пенсию, ему было 72 года.
Место заведующего кафедрой занял профессор Петр Васильевич Завьялов. Вскоре клиника детской хирургии была переведена из помещения госпиталя для инвалидов Великой Отечественной войны в городскую больницу №8, а затем (с 1976года) базами кафедры стали городская больница №20 и Областная детская клиническая больница, где были организованы хирургические отделения (гнойное и чистое), ортопедо-травматологиеское и анестезиолого-реанимационное отделения. Количество коек возросло с 85 до 345. К этому времени значительно увеличился объем обучения на кафедре и состав сотрудников. К 1980 году состав кафедры увеличился до заведующего, 2 доцентов и 5 ассистентов.
Профессор П.В. Завьялов успешно разрабатывал методы лечения ожоговых больных и, в частности, аутодермопластику обширных ожоговых поверхностей. Им издана монография на эту тему. На кафедре в это время лечилось большое количество тяжелых больных с различными формами острой гнойной деструктивной пневмонии. В связи с этим были разработаны новые диагностические приемы, внедрена бронхоскопия, определена рациональная лечебная тактика, широко стали использоваться интраторакальные хирургические вмешательства. Дети с урологической патологией получали помощь в основном в клинике детской хирургии. И раньше, и при профессоре П.В. Завьялове большое внимание уделялось хирургической коррекции гипоспадии, использовались различные способы, но наилучшие результаты были получены при внедрении способа Ландерера. Лечение пороков развития в периоде новорожденности и грудном возрасте всегда было приоритетным направлением в работе кафедры. Профессор П.В. Завьялов большое внимание уделял разработке методов лечения ортопедических и травматологических больных, в частности, удлинению костей методом растяжения ростковой зоны, лечению ложных суставов, широко использовался аппарат Г.А. Илизарова. За период работы професора П.В. Завьялова было подготовлено и защищено 5 диссертационных работ, одна из которых докторская (Б.Б. Золотовский).
С 1982 года руководит кафедрой профессор Чепурной Геннадий Иванович. Он стал научным руководителем и консультантом 5 докторских и 28 кандидатских диссертаций, совместно с сотрудниками им издано 4 монографии, имеет 31 патент на изобретения. Сотрудниками кафедры опубликовано около 300 научных работ, из них 19 – учебно-методических разработок. Кафедра – организатор 2 Всесоюзных студенческих научных конференций по детской травматологии и ортопедии.
Открыто детское ожоговое отделение на 40 коек, детское урологическое отделение на 25 коек в Областной детской клинической больнице. Организованы новые службы в детской хирургии: хирургия новорожденных и эндохирургическая. В рамках хирургии новорожденных оказывается помощь больным с атрезией пищевода, врожденными диафрагмальными грыжами, атрезией 12-перстной кишки, тонкой и толстой кишок, лобарной эмфиземой легких, экстрофией мочевого пузыря, аноректальными пороками развития, опухолями и кистами средостения, тератодермоидными образованиями крестцово-копчиковой области. В повседневную лечебную работу вошли операции при рубцовых стенозах пищевода, ахалазии и халазии пищевода, грыжах диафрагмы и пищеводного отверстия диафрагмы, рубцовых стенозах желудка после химических ожогов, релаксации куполов диафрагмы, травмах 12-перстной кишки, опухолях надпочечников, почек, внутренних половых органов девочек, травмах сосудов, болезни Гиршпрунга, Гипоспадии. Клиника накапливает материал по эндовидеохирургической коррекции варикоцеле, диагностике заболеваний органов живота, лечению нефроптоза. Осуществляются операции: резекции легких с раздельной обработкай элементов корня легкого, консервативная дезинвагинация, аутотрансплантация селезеночной ткани при травмах селезенки и тромбоцитопенической пурпуре.
В состав сотрудников кафедры входят 14 педагогов – детских хирургов и ортопедов, среди которых 3 доктора медицинских наук, 2 доцента, 7 ассистентов со степенью кандидата медицинских наук. Кафедрой совместно с сотрудниками отделения через систему ординатуры и аспирантуры подготовлены детские хирурги и детские ортопеды, которые трудятся не только в Ростовской области, но и других городах России, а также в Нигерии, Ливане, Сирии, Гане.
Вокруг кафедры детской хирургии и ортопедии РостГМУ, обладающей огромным опытом хирургического лечения детей, формируется ядро детских хирургов Южного Федерального округа (Ставрополь, Краснодар, Волгоград, Нальчик), что позволяет решать вопросы подготовки кадров высшей квалификации.
Вопросы для самоподготовки:
1. Этиология ОГДП. Наиболее распространенные возбудители.
бактериальной деструкции легких, механизм их патогенного воздействия и
пути проникновения в легкие.
2. Клинические формы ОГДП (преддеструкция, легочноя форма, легочноплевральная форма).
3. Фазы клинического течения ОГДП (острая, подострая, хроническая).
4. Клиника ОГДП у детей. Острый гнойный лобит, мелкоочаговая
множественная ОГДП, внутридолевая ОГДП, гигантский кортикальный
абсцесс, буллы, пиоторакс, пиопневмоторакс, пневмоторакс.
5. Осложнения ОГДП (сепсис, перикардит, медиастенальная эмфизема).
6. Методы диагностики ОГДП у детей. Лучевая диагностика.Рентгенологическая картина при ОГДП.
7. Комплексная терапия при ОГДП.
8. Принципы хирургического метода лечения ОГДП. Цели местной терапии.
9. Методы лечения внутрилёгочных полостей. Бронхоскопическая санация.
„Точно так, как не знаешь ты,
откуда стало дыханье и кости
откуда в беременной утробе,
так не знаешь ты дел Бога,
создающего всё.“
— Соломон, третий еврейский царь, легендарный правитель объединённого Израильского царства -1011 - -931 до н.э. Источник: Научно-популярное издание. «Анатомия Мудрости» 120 Философов. Издательство «Таврия» 1996 г.
Предисловие
Острая деструктивная пневмония (ОДП) является одним из наиболее тяжелых гнойно-септических заболеваний детского возраста. На долю различных форм деструктивной пневмонии приходится от 10% до 15% общего количества пневмоний у детей.
Сочетание дыхательной и сердечной недостаточности на фоне выраженного интоксикационного синдрома, высокий процент хронизации процесса (от 5 до 30%) и летальности (от 2 до 13%) формируют актуальность проблемы в лечении детей с данной патологией.
В перечне необходимой комплексной терапии острой деструктивной пневмонии особое место занимает достаточно широкий спектр хирургических методов лечения, в выборе которых ведущую роль имеет форма острой деструктивной пневмонии.
Легочноплевральные формы острой деструктивной пневмонии (ЛПФ ОДП) диагностируются у 26,5-60,0% детей с деструкцией легких.
Среди многообразия клинических вариантов течения именно эта форма заслуживает наибольшего внимания по степени выраженности характерных для заболевания патологических синдромов, высокому проценту прогнозируемых осложнений, наиболее грозным из которых является сепсис.
Целью хирургического лечения при имеющихся плевральных осложнениях являются своевременная и адекватная санация плевральной полости и стойкая реэкспансия легкого.
C уважением, редакторы.
Глава 1.
Эволюция взглядов на методы диагностики и хирургического лечения острой деструктивной пневмонии у детей.
Термин «острая деструктивная пневмония» объединяет целый ряд гнойновоспалительных заболеваний легких и плевры, являющихся вариантами течения бактериальных пневмоний различной этиологии. Гнойно-воспалительные заболевания легких и плевры, представления о его генезе, вопросы его лечения известны врачам со времен развития хирургии. Скопление гноя в плевральной полости под определением «empyema thoracis», пути его устранения (вскрытие грудной клетки ножом или раскаленным железом, сверлением ребра с эвакуацией гноя) описывал еще Гиппократ.

В последующем на протяжении многих веков господствовал выжидательный, консервативный принцип. Хирургические принципы лечения эмпиемы плевры вновь стали возрождаться на рубеже 16-17 веков. Амбруаз Паре возродил вскрытие плевральной полости раскаленным железом, а Фабрициус стал применять дренирование плевральной полости через канюлю. Торакотомию, как метод лечения эмпиемы предложили в 18 веке Le Clerk (1719) и Srarp (1761).
В 1821 году R. Laennec (рис. 1, 2, 3,4) описал клиническую симптоматику и физикальные методы диагностики плеврита и выделил его как самостоятельное заболевание. Метод эвакуации гноя из плевральной полости с помощью иглы или троакара получил широкое распространение в первой половине прошлого века. Позже, почти одновременно L. Revilliod (1870) и G. Bulau (1876) разработали метод дренирования плевральной полости по принципу сифона. М.С.Субботин (1886) 16 и G. Perthes (1898) предложили способы закрытого дренирования и активной аспирации при помощи соединения принципа сифона с вакуумом и аппарата, состоящего из трех банок, расположенных на разном уровне.

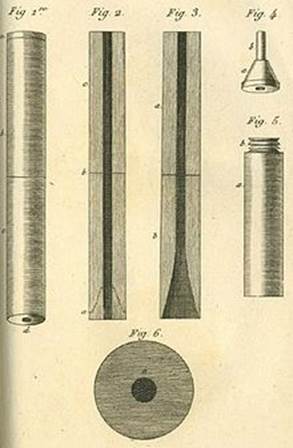
Рис. 1. описал клиническую симпто- Рис.2. Создание первого
матику и физикальные методы фонедоскопа.
диагностики плеврита.

Рис.3. R. Laennec., фонедоскоп.

Рис.4. Иллюстрация doc . R. Laennec проводит аускултацию ребенка.
Первую торакоскопию в мире при эмпиеме с развитием хронического свища 11-летней девочке провел ирландский хирург Dr. Gruise в 1866 при помощи разработанного им бинокулярного эндоскопа. Однако, в это время предпочтение отдавалось открытой торакотомии и оба метода не получили широкого применения. В первых работах о плевритах у детей, опубликованных в России, отмечалось, что в лечении преобладает консервативно - выжидательный метод и пункции (В.Е.Чернов, 1889). Пункционный метод в диагностике и лечении плевритов применял А.А.Кисель(Рис.5.), а известный детский хирург Л.П.Александров (1892)(рис.6.) использовал межреберную торакотомию без резекции ребер.

Рис. 5. Кисель Александр Андреевич Педиатр, заслуженный деятель науки РСФСР (1933). В 1883 году после окончания медицинского факультета Киевского университета в течение семи лет работал в Санкт-Петербурге: в клинике детских болезней

Рис.6. Первый приват-доцент по детской хирургии Императорского Московского Университета, главный врач детской больницы Св. Ольги, доктор медицины Л.П. Александров
Проблеме гнойных плевритов у детей большое внимание уделяли Т.П.Краснобаев, И.А.Фрейдин, В.А.Кружков. На основе сделанных ими докладов (16 съезд хирургов России (1924)) сделаны выводы о целесообразности лечения эмпием у детей повторными аспирациями, подчеркивалось, что торакотомия после аспирации имеет меньшую смертность, а в резекции ребер у детей нет необходимости. В последующем, С.Д.Терновский пропагандировал пункционное лечение и дренирование по Бюлау («Гнойный плеврит у детей и его лечение», 1937).

Рис.7. Сергей Дмитриевич Терновский — советский хирург, основоположник детской хирургии в СССР, член-корреспондент АМН СССР.(1957).
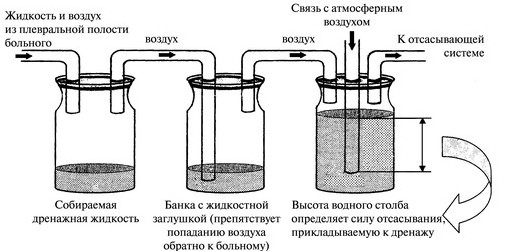
Рис.8. Схема трёхбаночной системы для аспирации плеврального содержимого.
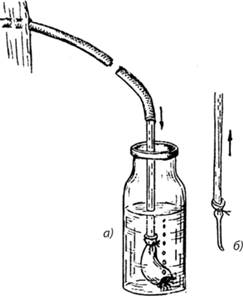
Рис.9. Пассивный клапанный Рис. 10. Схема дренирования
дренаж по Бюлау. плевральной полости по Бюлау.

Рис. 11. Аппарат для дренажа.
Однако, в виду неэффективности пассивной аспирации, многие авторы широко использовали дренирование с активной аспирацией. С.И. Спасокукоцкий («Хирургия гнойных заболеваний легких и плевры», 1938) рекомендовал дренирование с клапанным дренажом и активной аспирацией. Наиболее остро проблема эмпиемы у детей обозначилась в середине 50-х годов, когда по всему миру прокатилась волна тяжелых острых нагноений легких и плевры, сопровождающиеся высокой летальностью, достигающей 90% и более (М.Р. Рокицкий). 17 С целью более радикального устранения гнойного очага была предложена анатомичная резекция пораженных участков легкого (С.Л. Либов,1957).
Значимые успехи в диагностике осложненных форм пневмонии были достигнуты с использованием рентгеновских лучей и определением объективных данных рентгенологического исследования. До середины прошлого столетия данный метод оставался основным, как в диагностике, так и в проведении контроля за проводимым лечением. С развитием медицинских технологий в диагностике и хирургическом лечении ОДП произошли радикальные изменения. В практику были внедрены ультразвуковые методы исследования, компьютерная томография, были разработаны и внедрены малоинвазивные методы хирургического лечения.
Подробное описание метода ВТС и показания к его проведению у детей с плевральными осложнениями ОДП способствовали его широкому распространению в России в конце прошлого столетия. Параллельно с вопросами диагностики и лечения, пристальное внимание уделялось этиологии пневмоний. Еще в 1932 г. W. Wiskott предложил выделить из числа пневмоний раннего детского возраста стафилококковые пневмонии, считая, что они имеют черты самостоятельного заболевания.
Чрезвычайную тяжесть течения пневмоний стафилококковой этиологии с распадом легочной паренхимы, высокой летальностью, образованием абсцессов в легких и присоединением плевральных осложнений подчеркивали многие отечественные авторы (М.С. Маслов (1959), Ю.Ф. Домбровская (1959), С.Л. Либов (1957)).
В СССР термин «стафилококковая деструкция легких» впервые ввел С.Л. Либов (1962). Он был принят на Всесоюзном симпозиуме детских хирургов в Душанбе и быстро завоевал широкую популярность в 60-е годы нашего столетия. В последующие десятилетия многими авторами в литературе описаны сообщения о деструктивных пневмониях, вызванных грамотрицательными 18 микроорганизмами (протей, кишечная палочка, синегнойная палочка, клебсиелла) и ее ассоциаций со стафилококком, микст-инфекциях (Акинфеев1983), что в последующем привело к обоснованию нового термина «бактериальная деструкция легких». плевральных осложнений подчеркивали многие отечественные авторы
(М.С. Маслов (1959), Ю.Ф. Домбровская (1959), С.Л. Либов (1957)). В СССР термин «стафилококковая деструкция легких» впервые ввел С.Л. Либов (1962). Он был принят на Всесоюзном симпозиуме детских хирургов в Душанбе и быстро завоевал широкую популярность в 60-е годы нашего столетия. В последующие десятилетия многими авторами в литературе описаны сообщения о деструктивных пневмониях, вызванных грамотрицательными 18 микроорганизмами (протей, кишечная палочка, синегнойная палочка, клебсиелла) и ее ассоциаций со стафилококком, микст-инфекциях (Акинфеев1983), что в последующем привело к обоснованию нового термина «бактериальная деструкция легких».
По данным ВОЗ, пневмония занимает лидирующее место среди инфекционных причин смерти детей во всем мире и составляет более 15% в структуре летальности детей до 5 лет.
В перечне ключевых факторов указывается, что антибиотики крайне важны для лечения пневмонии, но далеко не все дети получают те антибиотики, которые им действительно нужны. Тяжелая пневмония называется деструктивной, когда воспалительный процесс протекает с формированием в легочной ткани тонкостенных воздушных полостей (булл) и/или абсцессов, склонных к прорыву в плевральную полость, с развитием плевральных осложнений (пневмоторакса, пиопневмоторакса, эмпиемы плевры).
Деструктивные пневмонии (ДП) у детей протекают преимущественно как одностороннее поражение одной или нескольких долей, что характерно для бронхогенного пути инфицирования.
В зарубежной литературе описаны случаи молниеносного течения деструкции с быстро прогрессирующим некрозом легочной ткани и, как правило, c летальным исходом. Такие случаи связаны с особыми генотипами Staphylococcus aureus, продуцирующими агрессивный цитотоксин PVL (лейкоцидин Пантон-Валентина), они наблюдаются крайне редко, у иммунокомпромитированных пациентов. В нашей стране ДП регистрируются у детей с упорной частотой и, к сожалению, не имеют тенденции к снижению. Анализируя эпидемиологию ДП во времени, можно заметить, что первый значительный рост случаев этого заболевания приходился на середину 50–60-х годов ХХ века. Термин «стафилококковая деструкция легких» предложен С.Л. Либовым в 1962 г., принят на Всесоюзном симпозиуме детских хирургов в Душанбе и повсеместно использовался в 70–80-е годы прошлого века. Это совпадает с распространенностью стафилококков, способных продуцировать бета-лактамазы и противостоять таким бета-лактамным антибиотикам, как пенициллин, ампициллин, цефалоспорин 1-го поколения. В дальнейшем широкое внедрение в амбулаторную клиническую практику препаратов, активных в отношении бета-лактамазопродуцирующих стафилококков (оксациллин, метициллин, цефалоспорины 2-го поколения), способствовало существенному снижению частоты стафилококковых инфекций, причем не только ДП, но и острого гематогенного остеомиелита, инфекций кожи и мягких тканей. Начиная с 70-х годов ХХ века, многие авторы все чаще указывают на снижение удельного веса стафилококка среди возбудителей деструкций легких у детей и возрастание числа микст-инфекций. Казалось бы, сегодня мы вправе ожидать снижения актуальности проблемы ДП у детей – на фоне широкой доступности любых антимикробных препаратов, повсеместно внедренной системы преемственности педиатров амбулаторного звена и детских хирургов в оказании помощи при первых признаках деструктивного характера пневмонии, c применением самых современных диагностических и хирургических технологий. Однако этого не происходит.
Серьёзную озабоченность вызывают отсутствие динамики снижения ДП в большинстве регионов РФ и даже тенденция к росту этой нозологии, более того – появление более тяжелых форм течения, сопровождающихся присоединением органной дисфункции, сепсиса, в т.ч. с летальными исходами. В Астраханском крае за последние 5 лет (2010–2014 гг.) всего было 340 случаев острых ДП у детей, в т.ч. с развитием плевральных осложнений или фиброторакса – 150 детей (44,1%). При микробиологическом исследовании в 35% случаев роста бактерий не получено. Эта цифра подтверждает невысокую диагностическую значимость классических методов культивировании бактерий при выяснении этиологии острых пневмоний и совпадает с данными других российских и зарубежных исследователей. В Москве, по данным Морозовской детской городской клинической больницы, в 2014 г. на стационарное лечение поступили 830 детей с острой пневмонией, в т.ч. с тяжелым течением – 140 детей. В этой группе 21 ребенок (21%) имел деструктивный характер пневмонии с легочноплевральными осложнениями, что потребовало проведения торакоскопической санации. Авторами из Нижнего Новгорода проанализированы 99 случаев ДП у детей разного возраста (средний возраст 5,5 лет) и показано, что лечение таких больных требует достаточно больших усилий, длительность лечения в стационаре составила от 13 до 90 койко-дней (в среднем 28,5). Возможные причины и поиск путей решения этой проблемы были всесторонне рассмотрены на Всероссийском симпозиуме Ассоциации детских хирургов «Гнойно-воспалительные заболевания легких и плевры у детей» (КраснодарСочи, 21–23 апреля 2015 г.). Обобщая представленные данные краевых и областных Детских хирургических центров, участники симпозиума пришли к заключению, что организационные меры по своевременному выявлению и оказанию хирургической помощи детям являются адекватными. Практически все центры, принимающие больных с ДП из регионов, оснащены современным оборудованием для своевременной рентгенографии, ультразвукового исследования, компьютерной томографии и др. Во многих детских хирургических центрах внедрены высокотехнологичные методы лечения: видеоторакоскопическое лечение легочноплевральных форм ДП, применение ультразвука низкой частоты при эмпиеме плевры и др. В то же время вопросы, связанные с этиологией деструктивного воспалительного процесса в легких и причин неэффективности лечения на начальных стадиях заболевания, остаются неясными. Дело в том, что в 80-х годах ХХ века появление микробиологических данных о частом сочетании стафилококковой инфекции с иной патогенной и условно-патогенной флорой (энтеробактерии, синегнойная палочка, стрептококки) привело к отказу от термина «стафилококковая деструкция легких», вместо которого сочли более правильным термин «острая деструктивная пневмония». Изменение терминологии негативно отразилось на тактике антимикробной терапии, когда стафилококк перестал быть в фокусе внимания врачей, что будет доказано в данной статье. В то же время, забегая вперед, важно отметить, что большинство исследователей по-прежнему придерживается мнения о ведущей роли стафилококка в этиологии ДП у детей, как в прежние годы, таки сейчас.
Глава 2.
Этиология.
Острая гнойная деструктивная пневмония (ОГДП) – очаговая или сливная пневмония, различной этиологии, характеризуется некрозом и гнойным расплавлением ткани легкого с присоединением плевральных осложнений.
Вирусно-микробные ассоциации, представленные вирусами гриппа и парагриппа (35-50%), стафилококками (30%), пневмококками (25%).

Рис. 12. Графическое изображение процентной вирусно-микробной ассоциации.
Часто эти пневмонии вызывают серотипы Streptococcus pneumoniae 1, 3, 9 и 14, а также S. aureus, H. influenzae типа b, S.pyogenes, K.pneumoniae, P.aeruginosa.
Наиболее распространенными патогенами, связанными с эмпиемой плевры у иммунокомпетентных детей, являются Streptococcus pneumoniae, Staphylococcus aureus и Streptococcus pyogenes (стрептококк группы A).
Метициллин-устойчивый S aureus (MRSA), впервые зарегистрированный в 1998 году, в значительной степени изменил этиологическую структуру педиатрических эмпием. Эмпиемы, вызванные H influenzae тип B, встречаются крайне редко в странах, где проводится массовая вакцинация против этого возбудителя. У иммунокомпрометированных заболевание может быть вызвано анаэробными микроорганизмами и грибами. В пунктате также можно выявить вирусы и атипичные возбудители – хламидии, микоплазмы.
При первичных абсцессах легких у детей выделяется такой же спектр патогенов, а также – Klebsiella pneumoniae. Самым частым причинным микроорганизмом при абсцессах легких у детей является Staphylococcus aureus.
При некротизирующей пневмонии ранее основным возбудителем считался S. aureus, однако в настоящее время преобладающей причиной является S. pneumoniae, особенно серотипы 1, 3 9V и 14, и были выделены M. pneumoniae, MRSA и штаммы S. aureus, продуцирующие лейкоцидин Пантон-Валентина. Серотипы 19А и3 в комбинации с высокой концентрацией IL-8 обусловливают наиболее тяжелые формы некротических пневмоний у детей.
Недавнее исследование показало, что применение нестероидных противовоспалительных средств при острых респираторных вирусных инфекциях для борьбы с пирексией у детей ведет к увеличению риска развития эмпиемы плевры (относительный риск 2,79).
Глава 3.
Эпидемиологические и клинико-патогенетические особенности пневмоний и эмпиемы плевры у детей.
Эпидемиология пневмоний у детей характеризуется тенденцией к росту заболеваемости, как в России, так и во всем мире.
Согласно данным МЗ РФ за период 2011-2015 гг. заболеваемость пневмонией среди детей 0-14 лет составила 7,47 – 9,15, среди подростков 15-17 лет – 3,69- 4,99 на 1000 детского населения.(рис. 13). Среди федеральных округов России показатель заболеваемости варьирует в пределах 4-17 случаев на 1000 детского населения. При этом более высокие цифры заболеваемости отмечаются в Дальневосточном ФО (11,9-12,0%), а наиболее низкие (ниже, чем в среднем по России) – в Южном ФО (5,9-6,3%).
Тенденция к росту заболеваемости пневмонией имеет место и среди детского населения области, причем как в возрастной группе 0-14 лет, так и в подростковой 15-17лет. Заболеваемость детей в возрасте от 0-17 лет за исследуемый промежуток времени составила 4,05-6,55 на 1000 детского населения(рис.14)
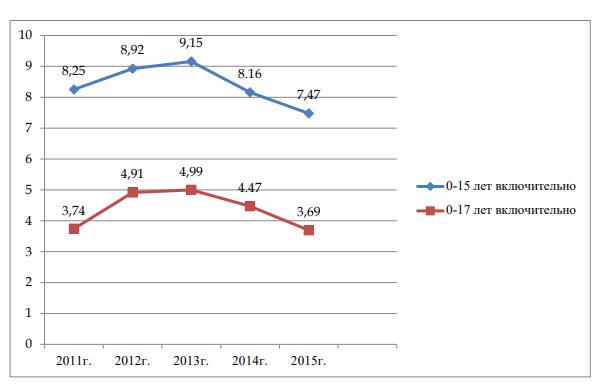
Рис. 13. Заболеваемость пневмонией детей и подростков в РФ на 1000 детского населения (Роспотребнадзор, 2015, форма 1)
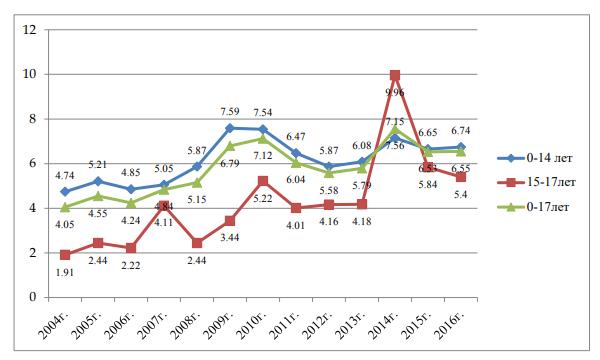
Рис. 14. Заболеваемость детского населения области пневмонией на 1000 населения (данные МИАЦ МЗ КК)
По данным ВОЗ пневмония является главной причиной детской смертности во всем мире. Согласно данным МЗ РФ болезни органов дыхания занимают 3-е место в структуре причин смерти у детей. Наиболее тяжелое течение характерно для пневмоний, протекающих с деструкцией легочной ткани. На их долю приходится 10-15% от общего 0-14 лет 15-17лет 0-17лет 20 количества пневмоний у детей . Высокий процент летальности при деструктивных пневмониях (2-13%) отмечают как отечественные, так и зарубежные (6-24%) авторы. В исходах деструктивных пневмоний хронизация процесса колеблется в пределах 5-30% . Связь St. аureus с летальными случаями пневмоний во время эпидемий острых респираторных инфекций (ОРИ) и гриппа отмечена давно. В конце 20-го и начале 21-го века увеличилось количество инфекций, вызванных внебольничными штаммами St. аureus, резистентными к метициллину (MRSA), а так же микст инфекции.
Попадая в легочную паренхиму, микроорганизмы начинают быстро размножаться, выделяя токсины и ферменты (лейкоцидины, гемолизины, экзотоксин PLT и др.), являющиеся мощнейшими стимуляторами воспаления тканей. Нейтрофилы, мигрирующие в область воспаления, создают первую линию защиты против инвазии возбудителей (вирусов и микроорганизмов). Их гранулы содержат большое количество сериновых протеаз и других агрессивных компонентов, необходимых для разрушения микроорганизмов внутри фагосом. При неконтролируемой гибели гранулоцитов молекулы с мощным антимикробным потенциалом повреждают окружающие ткани, и происходит некроз тканей. В местах внедрения микроорганизмов (чаще субплеврально) образуются мелкие очаги деструкции легочной паренхимы (мелкоочаговая множественная форма деструкции). Сливаясь друг с другом, эти полости образуют абсцесс легкого. Генез внутрилегочной формы деструкции связан с острым лобитом, характеризующимся тотальной инфильтрацией пораженной доли. В этих случаях очаг деструкции возникает в центре пораженной доли. Тонкостенные воздушные полости (буллы) образуются при разрыве альвеол или лизисе стенки бронхиол и попадания воздуха в интерстициальное 21 пространство, реже механизм возникновения булл связан с очищением деструктивных полостей (рисунки 15 и 16).
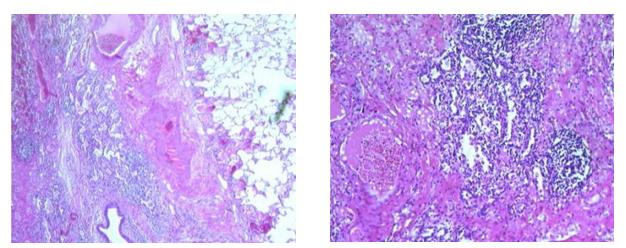 Рис.15. Гистологическая картина Рис. 16. Гистологическая картина
Рис.15. Гистологическая картина Рис. 16. Гистологическая картина
абсцесса легкого при низком абсцесса легкого при высоком
разрешении (по Michael A Ward, разрешении (по Michael A Ward,
2015) 2015).
По данным зарубежных авторов заболеваемость эмпиемой плевры колеблется от 0,4 до 6 на 1000 детей. Около 0,6% случаев детских пневмоний осложняется образованием эмпиемы плевры. Подобные статистические данные по России в доступной литературе не найдены. Легочно-плевральные формы диагностируются у 26,5-60,0% детей с ОДП.
Возникновение плевральных осложнений связано во всех случаях с инфицированностью плевральной полости и деструктивным процессом в легких. Этапы развития плеврального выпота делятся на 3 стадии: экссудативную, фибринозно-гнойную, и стадию организации. Экссудативная стадия характеризуется наличием зоны инфекции в паренхиме легких, что приводит к увеличению проницаемости кровеносных и лимфатических капилляров плевры, увеличению внутрилегочной интерстициальной жидкости, которая проходит через висцеральную плевру и накапливается в плевральной полости. В экссудате отмечается невысокий клеточный состав с преобладанием палочкоядерных лейкоцитов, а уровень 22 глюкозы и pH близки к норме. Через 2-3 суток наступает тромбоз капилляров, и проницаемость их уменьшается. Адекватная антибактериальная терапия обычно приводит к «рассасыванию» плеврального выпота, однако и она не всегда позволяет избежать перехода в следующую стадию. В 5-10% случаях плевральный выпот инфицируется. Это вызывает выработку хемокинов, цитокинов, оксидантов и протеаз посредников с образованием большого количества полиморфноядерных клеток и отложениями фибрина на костальной и висцеральной плевре, с образованием тяжей и нитей, формированием множества полостей – фибринозно-гнойная стадия. В экссудате выявляется большое количество белка и ЛДГ, а так же снижение уровня глюкозы и pH. В стадии организации экссудат становится густым, а фибрин пронизывается фибробластами. Фибриновая пленка организуется в плотную соединительную ткань на костальной и висцеральной плевре, формируются плевральные сращения, ограничивая экскурсию легких.
Клинико-диагностическая характеристика больных с легочно-плевральными формами острой деструктивной пневмонии «Под бактериальной деструкцией легких следует понимать осложнение пневмонии различной этиологии (стафилококковой, синегнойной, протейной, стрептококковой и т.д.), протекающее с образованием внутрилегочных полостей и склонное к присоединению плевральных осложнений». ОДП является одним из наиболее тяжелых гнойно-воспалительных заболеваний детского возраста. Несмотря 23 на достижения медицины в плане совершенствования антибактериальной терапии, реанимационного сопровождения и методов санации легких и плевральной полости, результаты лечения не всегда являются удовлетворительными. Причины возникновения, морфологические изменения и клинические проявления деструктивных пневмоний многообразны. По полноте отражения состояния вопроса и практической значимости в определении диагностических и лечебно-тактических решений, на наш взгляд, оптимальной является классификация, представленная М.Р. Рокицким в 1988г.
Глава 4.
Патогенез.
|
| |
| бронхогенный (первичный) | гематогенный (вторичный) |
| в основе которого лежит аэрогенный или бронхогенный путь развития воспаления в легком | путь инфицирования возникает вследствие септического процесса. |
Инфильтративно-деструктивная форма соответствует полисегментарной пневмонии, при которой возможно расплавление ткани легкого с формированием небольших абсцессов.
Гнойный лобит характеризуется тотальной гнойной инфильтрацией паренхимы доли легкого с очагом деструкции в центре.
Абсцесс легкого образуется в участке воспалительной инфильтрации из-за расплавления легочной ткани. В очаги деструкции легочной ткани проникает воздух, формируя внутрилегочные воздушные полости. Абсцесс при ОГДП не содержит капсулы, характерной для классических абсцессов легких, поэтому на ранних стадиях формирования склонны к спонтанному прорыву в бронх или плевральную полость.
Буллезная форма представлена тонкостенными воздушными полостями, способными менять форму и размеры. Небольшие по размеру воздушные полости свидетельствуют о благоприятном течении процесса и их спонтанной регрессии. При наличии клапанного механизма воздушные полости могут увеличиваться в размере и вызывать синдром внутрилегочного напряжения или вскрываться в плевральную полость, создавая напряженный пневмоторакс.
Пиопневмоторакс является результатом разрыва очага гнойной деструкции легкого.
Пневмоторакс – результат разрыва буллы.
Пиоторакс или эмпиема плевры всегда носит вторичный характер и является осложнением парапневмонического плеврита.
В развитии пиоторакса можно выделить три стадии: эксудативную стадию, гнойно-фибринозную стадию и стадию организации фибриноторакса.
Экссудативная стадия характеризуется воспалительным процессом, связанным с пневмонией, накоплением жидкости в плевральной полости с низким содержанием лейкоцитов.
Гнойно-фибринозная стадия характеризуется скоплением гноя в задних и боковых отделах плевральных полости с большим содержанием лейкоцитов и фибрина. Начинается процесс осумкования и образования множественных гнойных полостей, разделенных между собой фибринозными перегородками. Легкое коллабировано.
Стадия организации связана с интенсивным ростом фибробластов в экссудате и листках плевры, образуя соединительно-тканные наслоения с формированием фибриноторакса.
В патогенезе ОГДП можно выделить следующие патофизиологические звенья:
1. Угнетение местного иммунитета бронхолегочной ткани на фоне респираторно-вирусного заболевания, что способствует проникновению и патогенному воздействию бактерий;
2. Действие токсинов и ферментов, выделяемых микробами: гемолизина, некротоксина, летального токсина, нефротоксина, лейкоцидина, энтеротоксина, фибринолиза и др. Стафилококковые токсины, помимо гемолитических и летальных свойств, обладают цитолитическим действием, объясняющих разрущающее действие на клетки многих органов и тканей. В патогенезе грамотрицательной инфекции особое значение придается эндотоксину, который вызывает дистрофические изменения слизистых оболочек, кровоизлияния в них и накопление геморрагического экссудата в серозных полостях.
3. Следствием экзо- и эндотоксемии является расстройство легочной микроциркуляции с развитием гиперкоагуляции, тромбозом и микроэмболией бронхиальных и легочных сосудов, что нарушает кровоснабжение тканей и предрасполагает к их деструкции;
4. Бронхообструктивный процесс с нарушением вентиляционно-дренажной функции бронхов и бронхиол, обусловленный морфофункциональными изменениями по ходу дыхательных путей: отек, гиперемия и воспалительное набухание слизистой оболочки, образование экссудата;
5. Важным звеном патогенеза ОГДП является патология клеточных мембран. Легкие с их многочисленностью капиллярно-альвеолярных контактов рассматриваются как одна из наиболее обширных биологических мембран в организме. При ОГДП у детей отмечается активирование перекисного окисления липидов (ПОЛ), чрезмерное накопление продуктов которого в клетках приводит к значительным структурно-функциональным нарушениям.
Глава 5.
Эмбриогенез органов дыхательной системы человека.
Актуальным направлением морфологии является изучение закономерности развития и динамики образования структурной организации органов дыхательной системы человека.
Выяснение закономерностей организации респираторной системы позволяет лучше понимать эмбриогенез врожденных пороков развития, и вариантов строения ее структурных изменений. Исчерпывающие данные об особенностях органогенеза верхних дыхательных путей и легких способствует разработке новых и усовершенствованию существующих методов профилактики, диагностики и лечения врожденной и приобретенной патологии в пульмонологии и торакальной хирургии.
Комплексные исследования с использованием новейших методов обработки гистологических данных позволяют ближе подойти к решению актуальной медико-социальной проблемы – снижению заболеваемости и смертности от патологии органов дыхания.
В результате исследований эмбриогинеза дыхательной системы человека обнаружен трахеопищеводный зачаток у зародышей 45 мм ТКД (конец 4-й недели внутриутробного развития). Он представлен непарным почковидным образованием, который отходит под острым углом от вентральной стенки передней кишки и расположен впереди нее (рис. 26). Вся закладка дыхательного аппарата имеет неправильную колбообразную форму с суженным верхним полюсом (132 мкм зародыша 5,0 мм ТДМ и 220 мкм у зародыша ТДК 6,0мм) и расширенным нижним (380 мкм зародышей 5,0 мм ТКД и 760 мкм – у зародыша 6,0 мм ТКД), который является тем отделом, из которого в дальнейшем формируется легкие. Продольный размер закладки равен 484 и 880 мкм соотвественно).
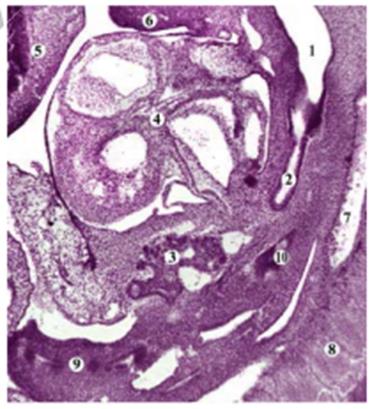

Бронхиальный зачаток в конце 4-й недели развития имеет простое гистологическое строение – основную его массу составляет мезенхима, клетки которой располагаются достаточно компактно. Внешне этот зачаток окружен спланхноплеврой, а с внутренней стороны мезенхимы определяется эпителиальная трубка, которая соединяется с просветом передней кишки. Дистальный конец этой трубки делится на два канала, которые слепо заканчиваются и имеют почти одинаковый диаметр закладки главных бронхов (рис. 27). 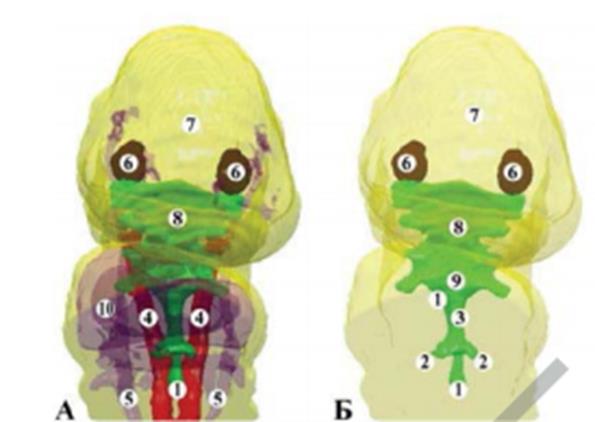
А – контуры сердца, сосудов, ротовой бухты и передней кишки;
Б – изображение только контуров структур ротовой бухты и передней кишки.
Сб. 12,5 х: 1 – передняя кишка; 2 –легочная почка; 3- зачаток пищевода; 4- дорсальная аорта; 5 –кардиальные вены; 6 –зачаток глазного яблока; 7 – голова; 8 – контуры полости ротовой бухты; 9 – зачаток глотки; 10 – сердце;
Рис. 27. – Трехмерная компьютерная реконструкция модели зародыша человека 4,5 мм ТКД. Передняя фронтальная проекция.
Выявлено, что длина зачатка трахеи равна 264 мкм (зародыш 5,0 мм ТКД) и 396 мкм (зародыш 6,0 мм ТКД), правый бронх имеет длину 180 мкм зародыша 5,0 мм ТКД и 276 мкм у зародыша 6,0 мм ТКД, левый – 206 мкм и 292 мкм соответственно. У зародышей 5,0 мм и 6,0 мм ТКД диаметр просвета трахеи равен 88 мкм и 92 мкм, главных бронхов – 60 мкм и 68 мкм соотвественно. Стенки трахеи и главных бронхов имеет почти одинаковое гистологическое строение – представлены высоким многоядерным эпителием, ядра которых овальной формы, 4,0 -6,0 мкм в диаметре, на срезах толщиной 10 мкм, образуют 3-4 , а иногда 5 рядов. Ядра расположены эксцентрично в цитоплазме – ближе к апикальному полюсу клетки, а протоплазматическая часть сосредоточена у базальной мембраны. Границы между клетками эпителия при окраске гематоксилином и эозином оказываются не четкими. К базальной мембране прилегает мезенхима закладки легких без четкой дифференциации ее клеток. Следует отметить, что в различных участках мезенхимного зачатка органа наблюдается скопления форменных элементов крови – образуя островки внутриорганного кроветворения.
При исследовании эмбриогенеза установлено, что развитие легких происходит по двум эмбриональным зачаткам – энтодермальный и мезенхимальный. Следует отметить, что энтодермальный зачаток образует эпителиальные трубки (парная закладка) (рис. 28.), а из мезенхимного – непарная , которая окружает сплошным слоем закладку трахеи и главных бронхов и переходит без четкой границы в мезенхиму кишечной трубки. Считаем , что исследователи , описавшие на ранних стадиях развития парную закладку легких, имели в виду только эндодермальную закладку. 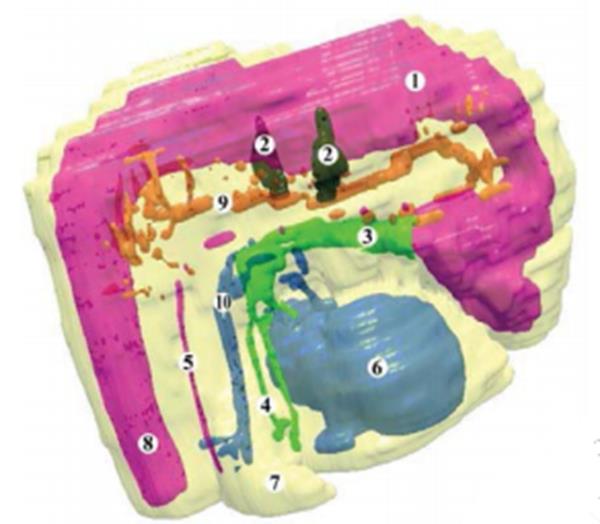
Сб. 12х: 1 – зачаток головного мозга; 2 – зрительный пузырек; 3- ротовая бухта; 4 – бронхолегочный зачаток; 5 – нотохорд; 6 –сердце; 7 – зачаток правой верхней конечности; 8 – зачаток спинного мозга; 9 – дорсальная аорта; 10 - перикардиальные вены;
Рис.28. – Трехмерная компьютерная реконструкция модели верхней половины зародыша человека 5,1 мм ТКД. Правая задне-боковая проекция.
У зародыша 7,0- 7,5 мм ТКД зачаток образует два боковых выпячивания, направленных дорсально-латерально , вдоль зачатка пищевода. Эту особенность следует считать начальной стадией формирования легких как парного органа. Обе структуры имеют удельную форму, а их направление совпадает с продольной осью тела зародыша. Верхний полюс закладки легких располагается позади сердца, средняя и нижняя части – позади очень массивной на этой стадии развития печени.
На данном этапе развития становится заметной ассиметрия в размерах зачатка правого и левого легких. Продольный размер правого легкого равен 550 мкм, поперечный 274 мкм, левого -550 мкм и 330 мкм – соотвественно. Длина закладки правого главного бронха равна 300 мкм, левого - 346 мкм, диаметр просвета обеих структур не превышает 100 мкм. Толщина слоя мезенхимы, окружающего главные бронхи, колеблется от 110 мкм (при среднем полукруге) до 220 мкм (боковом полукруге). Зачатки главных бронхов представлены высоким многоядерным эпителием, толщина которого достигает 28 мкм. Он расположен на хорошо выраженной базальной мембране. Ядра эпителиоцитов овальной формы, диаметром 4-6 мкм , на срезах толщиной 10 мкм, располагаются в 3 , а иногда в 4 ряда. Ядра занимают преимущественно апикальное положение. Границы клеток выражены нечетко. В закладке легких зародышей 8,0 мкм ТДК четко определяются боковые выпячивания (рис. 29.) Продольный размер правого легкого равен 600 мкм, поперечный 400 мкм , левого - 550 мкм, и 430 мкм соответственно.
Сб. 30х: 1- аорта; 2- брюшной ствол; 3 – верхняя брыжеечная артерия; 4- печень; 5 – желудок; 6 – двенадцатиперстная кишка; 7 – правое легкое; 8 – зачатки позвонков; 9 – сердце; 10- нижняя челюсть.
Рис.29. – Графическая реконструкция серии гистологических срезов зародыша человека 8,0 мм ТКД. Правая боковая проекция.
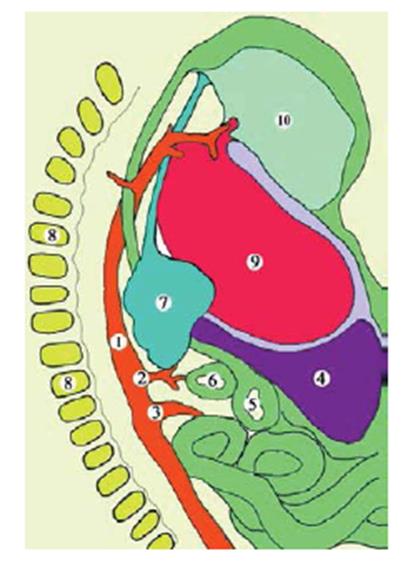
Внутри мезенхимального зачатка легких четко наблюдается закладка трахеи и главных бронхов. Закладка левого главного бронха представляет собой слепообраузующуюся трубку , длина которой равна 350 мкм, диаметр – 110 мкм. Закладка правого главного бронха на растоянии 90мкм от бифуркации трахеи дихотомически делится на ветви почти одинакого диаметра 110 и 112 мкм. Нижняя ветвь по направлениям является как бы продолжением ствола главного бронха, верхняя – направляется почти горизонтально, отклоняясь в латеральном направлении. Длина ее составляет 132 мкм. Все бронхиальные ветви на концах образуют небольшие расширения. Поскольку просвет бронхов на данной стадии развития относительно большой, закладка легких (участок боковых выпячиваний бронхолегочного зачатка) на фронтальных срезах имеет форму мешочков с толщиной стенки 66-78 мкм. Стенка трахеи и бронхов на всем протяжении имеет одинаковое строение и не отличается от таковой у эмбрионов длиной 7,0 – 7,5 мм ТКД. Тот факт, что при отсуствии внешних признаков деления зачатка легких на доли, бронхиальное дерево уже начинает ветвиться, свидетельствует о том, что энтодермальная закладка легких несколько опережает в своем развитии мезенхимальную, и поэтому играет ведущую роль в формировании легких. Кроме того, следует отметить, что начиная с 5-й недели развития, уже наблюдается ассиметрия не только в размерах закладки правой и левой легких, а также и в разветвлении бронхов.
Таким образом , источником закладки легких человека есть трахеопульманальный зачаток, который в конце 4-ой недели внтуриутробного развития представлен непарным почкообразным образованеим, отходящим под острым углом от вентральной стенки передней кишки и расположенным впереди последней. Начало 5-й недели внутриутробного развития следует считать критическим периодом развития человека, в течении которого происходят интенсивные процессы органогенеза дыхательной системы, и который является периодом возможного появления разных вариантов врожденных пороков. Источниками легочных сосудов является внутриорганные островки кроветворения и внеорганных магистральных сосудов, сообщение между которыми происходит в конце 4-ой и в начале 5-ой недели внутриутробного развития.
Носовая полость развивается из ротовой бухты. Глотка является производным передней кишки. Зачаток органов дыхания: гортань, трахея, бронхи и легкие человека развиваются из общего зачатка, который появляется на 3-ей или 4-ой неделе эмбриогенеза путем выпячивания вентральной стенки передней кишки (гортанно-трахеальный вырост или респираторный дивертикул). Респираторный дивертикул отделяется от передней кишки двумя продольными эзофаготрахеальными (трахеопищеводными) бороздами, вдающимися в просвет передней кишки в виде гребней. Эти гребни, сближаясь, соединяются, и формируется эзофаготрахеальная перегородка. В результате передняя кишка разделяется на дорсальную (пищевод) и вентральную (трахея и легочные почки) части. Респираторный дивертикул, удлиняясь в каудальном направлении, формирует по средней линии будущую трахею, которая заканчивается двумя мешковидными выпячиваниями – легочными почками. Правая легочная почка делится на три, а левая на два главных бронха, из которых формируется бронхиальное дерево легких. К концу 6-го месяца в нем насчитывается 17 ветвлений. Образование терминальных бронхиол происходит на 5-ом - 6-ом месяце внутриутробного развития. Процесс ветвления бронхиол заканчивается после рождения.
Дифференцировка легких проходит последовательно три этапа:
- Первый этап (5-15 недели) характеризуется дальнейшим ветвлением воздухоносных путей, развитием хрящей трахеи и бронхов, появлением бронхиальных артерий.
Второй этап (16-25 недели) характеризуется появлением респираторных и терминальных бронхиол, а также канальцев (прообразов альвеолярных мешочков) и подрастанием к ним капилляров.
Третий этап (26-40 недели) характеризуется массовым преобразованием канальцев в мешочки (первичные альвеолы), увеличением числа альвеолярных мешочков, дифференцировкой альвеолоцитов и появлением сурфактанта.
Синтез и секреция сурфактанта осуществляется пневмоцитами 2-го типа. Функция сурфактанта – снижение сил поверхностного натяжения альвеол и повышение эластичности легочной ткани. Сурфактант предотвращает спадение альвеол в конце выдоха. К рождению легкие заполнены жидкостью, в большом количестве содержащей хлориды, белок, некоторое количество слизи, поступающей из бронхиальных желез, и сурфактант. Количество сурфактанта в жидкости возрастает, особенно в течение последних двух недель перед рождением. После рождения, с началом функционирования органов дыхания, большая часть легочной жидкости быстро резорбируется кровеносными и лимфатическими капиллярами; небольшое количество удаляется через бронхи и трахею. Сурфактант остается в виде тонкой пленки на поверхности альвеолярного эпителия. В течение последних 2-х месяцев пренатального развития и нескольких лет постнатальной жизни число терминальных мешочков постепенно увеличивается. Зрелые альвеолы до рождения отсутствуют.На 4-5-ой неделе эмбрионального развития вокруг гортанно-трахеального выроста образуется кольцевидное утолщение мезенхимы. На 8-9 неделе внутриутробного развития эта закладка дифференцируется в хрящи и мышцы трахеи. Раньше других формируется перстневидный хрящ, затем черпаловидные, клиновидные хрящи и позже других – щитовидный хрящ (вначале как парное образование). Надгортанник образуется в толще складки слизистой оболочки, расположенной кпереди от входа в гортань. После образования скелета гортани происходит формирование ее стенок, голосовых складок, складок преддверия, желудочков гортани. Из общего мышечного сфинктера, окружающего глоточную кишку, снаружи от хрящей развиваются мышцы гортани. К середине 3 месяца все хрящи и мышцы гортани приобретают форму, как у взрослого. Энтодерма образует эпителий гортани, трахеи, бронхиального и альвеолярного дерева, а также железы. Мезенхима формирует соединительную, а также хрящевую и мышечную ткани стенок органов дыхательной системы, кровеносные и лимфатические сосуды. Плевра развивается из соматоплевры и спланхноплевры, выстилающих вторичную полость эмбриона.
Глава 6.
Топографическая анатомия дыхательной системы.
Плевра представляет собой тонкую серозную оболочку, которая покрывает каждое легкое, срастаясь с ним (висцеральная или легочная, плевра, и переходит на внутреннюю поверхность стенок грудной полости, а также отграничивает легкое от образований средостения (париетальная плевра). Таким образом, каждое легкое заключено в замкнутый серозный мешок. Между висцеральным и париетальным листками плевры образуется щелевидное капиллярное пространство — полость плевры, в которой имеется небольшое количество серозной жидкости. В зависимости от отделов грудной полости, к которым прилежит париетальная плевра, в ней различают реберную, диафрагмальную и средостенную (медиастинальную) плевру. При переходе одной части париетальной плевры в другую образуются переходные складки, которые определяют границы париетальной плевры и, следовательно, плевральной полости. Передние границы плевры, соответствующие линии перехода реберной плевры в средостенную, на правой и левой стороне расположены несимметрично, что связано с положением сердца, оттесняющим левую плевральную складку. Справа передняя граница пересекает грудино-ключичное сочленение, направляется вниз и кнутри вдоль рукоятки грудины, проходит косо справа налево, пересекая срединную линию на уровне хряща II ребра. Затем граница проходит вертикально вниз до уровня прикрепления хряща VI ребра к грудине, откуда переходит в нижнюю границу плевральной полости. Слева передняя граница начинается так же, как и справа, проходит затем по левому краю грудины до прикрепления к ней хряща IV ребра, откуда соответственно положению сердца проходит кнаружи,- пересекая четвертый межреберный промежуток, хрящ V ребра, пятый межреберный промежуток и на уровне середины хряща VI ребра переходит в нижнюю границу плевральной полости. На уровне II—IV реберных хрящей правая и левая передние плевральные складки близко подходят друг к другу и частично фиксированы при помощи соединительнотканных тяжей. Выше и ниже этого уровня образуются верхний и нижний межплевральные промежутки. Нижние границы плевральных полостей проходят по среднеключичной линии — по VII ребру, по средней подмышечной линии — по X ребру, по лопаточной линии — по XI ребру, по околопозвоночной линии — по XII ребру. Задние границы плевральных полостей соответствуют реберно-позвоночным суставам. Купол плевры выступает над ключицей в область шеи и соответствует сзади уровню остистого отростка VII шейного позвонка, а спереди проецируется на 2—3 см выше ключицы. Высота купола плевры над ключицей определяется конституциональными особенностями и может меняться при патологических процессах в верхушке легкого. Купол плевры сзади прилежит к головке и шейке I ребра, длинным мышцам шеи, нижнему шейному узлу симпатического ствола, снаружи и спереди — к лестничным мышцам, плечевому сплетению; снутри — к плечеголовному стволу (справа) и левой общей сонной артерии (слева), спереди — к позвоночной артерии и вене. Плевральные синус ы составляют часть плевральной полости и образуются в местах перехода одного отдела париетальной плевры в другой. Стенки синусов, выстланные листками париетальной плевры, близко соприкасаются и отходят друг от друга во время вдоха, когда синусы частично или полностью заполняются легкими. Они расходятся также при заполнении синусов жидкостью (кровь, экссудат и др.). Различают три плевральных синуса. Реберно-диафрагмальный синус — самый большой. Он образуется между реберной и диафрагмальной плеврой и расположен на уровне прикрепления диафрагмы в виде полукруга от хряща VI ребра до позвоночника. Глубина его неодинакова на всем протяжении. На уровне хряща VI ребра она равна 2 см, а на уровне VII—X ребра по средней подмышечной линии при максимальном выдохе — 8 см. Сзади синус доходит справа до непарной вены, слева — до аорты. Легкие не заполняют этот синус даже при максимальном вдохе. Заднемедиальный участок реберно-диафрагмального синуса расположен соответственно положению диафрагмы ниже уровня XII ребра, что следует учитывать при оперативных доступах к почке. Другие плевральные синусы — средостенно-диафрагмальный , передний и задний реберно-средостенные — значительно меньшей величины и обычно целиком заполняются легкими при вдохе. По краям ворот легких висцеральная плевра переходит в париетальную, прилежащую к органам средостения, в результате чего на плевре и легких образуются складки и вдавления. Ниже ворот легких образуется складка средостенной плевры в месте перехода ее в висцеральный листок в виде фронтально расположенной дупликатуры — легочной связки, lig. pulmonale, которая опускается до диафрагмы и ниже ворот легких соединяет париетальную и висцеральную плевры и делит плевральную полость на вентральный и дорсальный отделы. При мобилизации нижней доли легкого легочную связку обычно пересекают. Топография легких. Легкие — парные органы, занимающие большую часть грудной полости. Расположены в плевральных полостях, в основном повторяющих очертания легких. Легкие отделены друг от друга средостением. В каждом легком различают верхушку и три поверхности: наружную, или реберную, которая прилежит к ребрам и межреберным промежуткам; нижнюю, или диафрагмальную, прилежащую к диафрагме, и внутреннюю, или средостенную, прилежащую к органам средостения. Размеры правого и левого легкого неодинаковы вследствие более высокого стояния правого купола диафрагмы и положения сердца, смещенного влево. В каждом легком различают доли, разделенные глубокими щелями. В левом легком имеются две доли (верхняя и нижняя), в правом — три доли (верхняя, средняя и нижняя). Коса я щель , fissura obliqua, в левом легком отделяет верхнюю долю от нижней, а в правом — верхнюю и среднюю долю от нижней. В правом легком имеется дополнительная горизонтальна я щель , fissura horizontalis, отходящая от косой щели на наружной поверхности легкого и отделяющая среднюю долю от верхней (рис. 30).
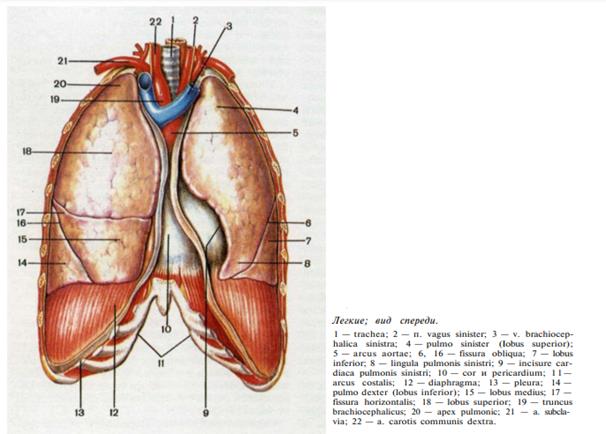
Рис. 30 . Легкие человека, вид спереди.
Скелетотопия легких.
Передние и задние границы легких и плевры почти совпадают. Передняя граница левого легкого (см. границы плевры) из-за наличия глубокой сердечной вырезки начиная от хряща IV ребра отклоняется кнаружи, к левой среднеключичной линии и, таким образом, хрящи IV и V ребер не прикрыты легочной тканью.
Нижние границы легких не совпадают с границами плевры и соответствуют справа по грудинной, а слева по около груди иной линиям хрящу VI ребра, по среднеключичной линии — верхнему краю VII ребра, по передней подмышечной линии — нижнему краю VII ребра, по средней подмышечной линии — VIII ребру, по лопаточной линии — X ребру, по околопозвоночной линии — XI ребру. При глубоком вдохе нижняя граница легких опускается по окологрудинной линии до нижнего края VII ребра, по околопозвоночной линии — до верхнего края XII ребра.
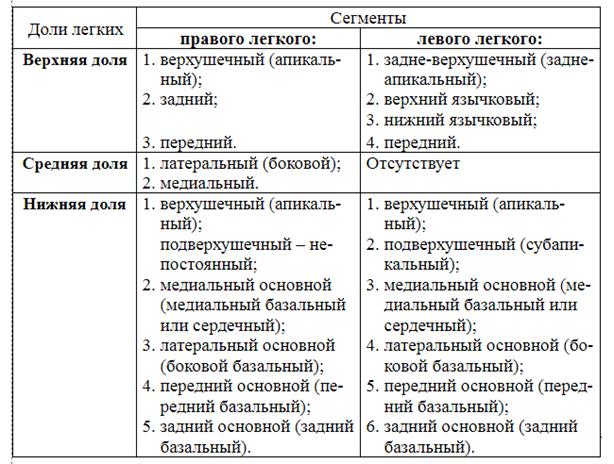
Междолевые косые щели проецируются справа и слева одинаково: по позвоночной линии соответствуют уровню остистого отростка III грудного позвонка, направляются косо вниз и вперед и пересекают VI ребро у места перехода его костной части в хрящевую. Горизонтальная междолевая щель правого легкого соответствует проекции IV ребра от средней подмышечной линии до прикрепления IV реберного хряща к грудине. Сегменты легкого. Каждая доля легкого состоит из сегментов — участков легочной ткани, вентилируемых бронхом третьего порядка (сегментарный бронх) и отделенных от соседних сегментов соединительной тканью. По форме сегменты напоминают пирамиду, вершиной обращенную к воротам легкого, а основанием — к его поверхности. На вершине сегмента находится его ножка, состоящая из сегментарного бронха, сегментарной артерии и центральной вены. Через центральные вены оттекает лишь небольшая часть крови из ткани сегмента, а основным сосудистым коллектором, собирающим кровь из прилежащих сегментов, являются межсегментарные вены. Каждое легкое состоит из 10 сегментов (рис. 31).


Рис.31. Сегменты легких (по Д.А. Жданову, с изменениями).
Сегмент легкого(бронхолегочной сегмент) – это часть доли легкого, обладающая изолированной вентиляцией (за счет бронха 3-его порядка) и кровоснабжением, отделенная от соседних сегментов соединительнотканными перегородками. Знание названий сегментов легких необходимо для описания данных дополнительных методов обследования.
Границы легких и плевры
Знание границ легких и плевры необходимо для интерпретации данных объективного обследования грудной клетки и дополнительных методов исследования.
Передняя граница правого (левого) легкого (и плевры):
1)на 2-3 см выше ключицы и 1 см кнаружи от грудинной линии (верхушка легкого);
2)сближаются до уровня 2-ого ребра (на 1 см кнаружи от передней срединной линии груди);
3)идут параллельно друг другу до уровня 4-ого ребра (на 1 см кнаружи от передней срединной линии груди);
4)справа – продолжается до 6-ого ребра, где переходит в нижнюю границу;
слева (сердечная вырезка) – идет вдоль 4-ого ребра до окологрудинной линии, затем – до 5-ого ребра (на 1 см кнутри от среднеключичной линии), затем – до 6-ого ребра по окологрудинной линии, где переходит в нижнюю границу.
Нижняя граница правого (левого) легкого:
1)вдоль 6-ого ребра (справа - от передней срединной линии, слева - от окологрудинной линии) – до среднеключичной линии;
2)по передней подмышечной линии – 7-ое ребро;
3)по средней подмышечной линии – 8-ое ребро;
4)по задней подмышечной линии – 9-ое ребро;
5)по лопаточной линии – 10-ое ребро;
6)по позвоночной линии – 11-ое ребро;
7)далее – в поперечном направлении до точки, расположенной на 1 см кнаружи от задней срединной линии на уровне остистого отростка 10-ого грудного позвонка.
Нижняя граница париетальной плевры (слева и справа):
1)по передней срединной линии – 7-ое ребро;
2)между грудинной и среднеключичной линиями – по 7-ому ребру;
3)по передней подмышечной линии – 8-ое ребро;
4)по средней подмышечной линии – 10-ое ребро;
5)по задней подмышечной линии – 11-ое ребро;
6)по лопаточной линии – 12-ое ребро;
7)по позвоночной линии – на 1-2 см ниже 12-ого ребра;
8)далее – в поперечном направлении до точки, расположенной на 1-2 см кнаружи от задней срединной линии на уровне остистого отростка 12-ого грудного позвонка.
Ворота легких, корни легких.
На внутренней поверхности легкого расположены ворота легких, через которые проходят образования корней легких: бронхи, легочные и бронхиальные артерии и вены, лимфатические сосуды, нервные сплетения.
Ворота легких представляют собой овальное или ромбовидное углубление, расположенное на внутренней (средостенной) поверхности легкого несколько выше и дорсальнее ее середины. Проекция ворот легких на грудную стенку чаще всего соответствует V—VIII грудным позвонкам сзади и II—IV ребрам спереди.
Корень легкого уплощен спереди назад, высота его составляет в среднем 5,6—6,6 см. Корень легкого покрыт средостенной плеврой в месте перехода ее в висцеральную. Кнутри от средостенной плевры крупные сосуды корня легкого покрыты задним листком перикарда и не видны при вскрытии плевральной полости. Все элементы корня легкого подплеврально покрыты отрогами внутригрудной фасции, которая формирует для них фасциальные влагалища, отграничивая околососудистую клетчатку, в которой расположены сосуды и нервные сплетения. Эта клетчатка сообщается с клетчаткой средостения, что имеет значение при распространении инфекции. Фасциальные тяжи, идущие от элементов корня легкого к перикарду, образуют перикардиальнобронхиальные и перикардиально-легочно-артериальные связки. Пересечение этих связок облегчает внеперикардиальное обнажение и обработку сосудов и бронхов при удалении легкого.
Элементы корней правого и левого легкого расположены асимметрично. В корне правого легкого самое верхнее положение занимает главный бронх, а ниже и кпереди от него расположена легочная артерия, ниже артерии — верхняя легочная вена. От правого главного бронха еще до вступления в ворота легких отходит верхнедолевой бронх, который делится на три сегментарных бронха — I, II и III. Ниже отхождения правого верхнедолевого бронха участок бронха до отхождения от него среднего долевого бронха носит название промежуточного бронха. Среднедолевой бронх распадается на два сегментарных бронха — IV и V. После отхождения с ре дне долевого бронха промежуточный бронх переходит в нижнедолевой, который проходит в ворота нижней доли у внутреннего края междолевой поверхности, где распадается на 5 сегментарных бронхов — VI, VII, VIII, IX и X. Правая легочная артерия делится на долевые и сегментарные артерии, уровни отхождения которых не всегда соответствуют уровням деления бронхов.
Легочные вены (верхняя и нижняя) формируются из межсегментарных и центральных вен. Длина внеперикардиальной части верхней легочной вены от 0,8 до 1,4 см. Нижняя легочная вена короче верхней и расположена кзади и книзу от последней. В корне левого легкого наиболее верхнее положение занимает легочная артерия, ниже и кзади от нее располагается главный бронх. Верхняя и нижняя легочные вены прилежат к передней и нижней поверхностям глазного бронха и артерии.
Левая легочная артерия в воротах легкого дугообразно обходит левый главный бронх, проходит над верхнедолевым бронхом, а затем располагается вдоль задненаружной поверхности левого нижнедолевого бронха. Левый главный бронх в воротах легкого делится на долевые — верхний и нижний — бронхи. Верхнедолевой бронх распадается на два ствола — верхний, который образует два сегментарных бронха — I—II и III, и нижний, или язычковый, ствол, который делится на IV и V сегментарные бронхи. Нижнедолевой бронх начинается ниже места отхождения верхнедолевого бронха. От него отходит сегментарный бронх к верхушечному сегменту нижней доли — VI сегмент, после чего нижнедолевой бронх продолжается в базальный бронх, который делится на сегментарные бронхи — VII (непостоянный), VIII, IX, X. По стенкам бронхов проходят и разветвля ются питающие их бронхиальные артерии (от грудной аорты или ее ветвей) и сопровождающие их вены, лимфатические сосуды. На стенках бронхов и легочных сосудов располагаются ветви легочного сплетения (см. рис. 90).
Правый главный бронх шире и короче левого; он состоит из 6—8 хрящевых полуколец и в поперечнике в среднем достигает 2 см. Левый бронх уже и длиннее правого, он состоит из 9—12 хрящевых полуколец.
Средний диаметр его 1,2 см. Ворота легких расположены ниже места бифуркации трахеи, поэтому бронхи идут косо вниз и кнаружи. Правый бронх опускается круче левого и является как бы продолжением трахеи.
На медиальной поверхности правого легкого позади его корня на всем протяжении сверху вниз тянется в виде желоба пищеводное вдавление. На медиальной поверхности левого легкого позади его корня располагается хорошо выраженная аортальная бороздка. Корень правого легкого огибает в направлении сзади наперед непарная вена, корень левого легкого — в направлении спереди назад дуга аорты.
Лимфатическая система легких сложна, она складывается из поверхностных, связанных с висцеральной плеврой и глубоких органных сетей лимфатических капилляров и внутридольковых, междольковых и бронхиальных сплетений лимфатических сосудов, из которых формируются отводящие лимфатические сосуды. По этим сосудам лимфа оттекает частично в бронхолегочные лимфатические узлы, а также в верхние и нижние трахеобронхиальные, околотрахеальные, передние и задние средостенные узлы и по ходу легочной связки в верхние диафрагмальные узлы, связанные с узлами брюшной полости.
Глава 7.
Классификация острых гнойных деструктивных пневмоний.
1. Внутрилегочные формы:
А. инфильтративная.
Б.Абсцедирующая.
В. Буллезная.
2. Легочно-плевральные формы:
А. Экссудативный плеврит.
Б. Пиоторакс (тотальный , отграниченный).
В. Пневмоторакс (напряженный, ненапряженный).
Г. Пиопневмоторакс (напряженный, ненапряженный).
3.Хронические формы:
А. Хронический абсцесс.
Б. Фибриноторакс.
В. Фиброторакс.
Г. Приобретенные кисты легкого.
Классификация бактериальных деструкций легких у детей
(по Рокицкому М.Р., 1988)
I. По этиологии:
А. Стафилококковые,
Б. Стрептококковые,
В. Синегнойные,
Г. Протейные,
Д. Смешанные.
II. По типу поражения:
1. Первичное поражение (аэрогенный путь инфицирования):
а) истинно первичное (осложнение бактериальной пневмонии);
б) условно первичное (наслоение на муковисцидоз, острую респираторную инфекцию, врожденные пороки развития легких).
2. Вторичное поражение (гематогенный путь инфицирования).
III. По форме поражения:
1.Преддеструкции :
а) острые массивные стафилококковые,
б) стрептококковые,
в) синегнойные,
г) протейные и другие пневмонии;
д) острые лобиты.
2. Легочные формы бактериальных деструкций легких:
а) мелкоочаговая множественная деструкция легких;
б) внутридолевая деструкция;
в) гигантский кортикальный («провисающий») абсцесс;
г) буллезная форма деструкции.
3. Легочно-плевральные формы бактериальных деструкций:
а) пиоторакс (ограниченный, тотальный, плащевидный; «прободающая эмпиема»);
б) пиопневмоторакс (простой, напряженный, ограниченный, тотальный);
в) пневмоторакс (простой, напряженный, ограниченный, тотальный).
4. Хронические формы и исходы бактериальных деструкций легких:
а) вторичные кисты легких (неосложненные, осложненные нагноением, острым вздутием, прорывом в плевральную полость);
б) хронический абсцесс легкого;
в) фиброторакс;
г) хроническая эмпиема плевры (ограниченная, тотальная: без бронхиального свища, с бронихиальным свищом; без плеврокожного свища, с плеврокожным свищом);
д) бронхоэктазии (ателектатические, без ателектаза).
IV. По фазе течения деструкции:
1. Фаза преддеструкции. 2. Фаза острого течения. 3. Фаза подострого течения.4. Фаза хронического течения.
5. Осложнения:
А. Сепсис.
Б. Перикардит (гнойный, гнойно-фибринозный, фибринозный).
В. Медиастинальная эмфизема (простая, прогрессирующая).
Г. Кровотечение (легочное, легочно-плевральное, внутриплевральное 1, 2, 3 с
степени).
Глава 8.
Методы исследования пациентов при ОГДП.
Сбор анамнеза.
Сбор анамнеза проводился с акцентом внимания на сроки от начала заболевания до госпитализации в стационар, наличия или отсутствия признаков острой респираторной инфекции в дебюте заболевания, ранние клинические проявления болезни – повышение температуры тела и её максимальные значения в течение суток, кашель, время появления одышки и учащенного сердцебиения, слабость, вялость, отказ от еды, наличие болей в животе, и их динамику к моменту осмотра. В случаях присутствия в анамнезе обращений за первичной медицинской помощью уточнялись сроки и кратность обращения, установленные ранее диагнозы, объем назначенной терапии и его эффективность.
Клиника.
Оценивались клинические проявления: слабость, вялость, потливость, бледность кожных покровов, отказ от еды или снижение аппетита, тошнота, рвота, повышение температуры тела, цианоз носогубного треугольника, одышка и степень её проявления, тахикардия. Осмотр: симметричность грудной клетки, наличие дыхательной асимметрии, участие вспомогательной мускулатуры в акте дыхания, расширение межреберных промежутков. Перкуссия: притупление или коробочный звук со стороны поражения, смещение границ относительной тупости сердца в здоровую сторону. Аускультация: ослабление (отсутствие) дыхания со стороны поражения, наличие хрипов, смещение сердечного толчка в противоположную сторону.
Симптомы болезни зависят от тяжести протекания.
При средней степени тяжести
(называемой инфильтративно-деструктивнаяпневмония)
У ребёнка наблюдаются симптомы, похожие на ОРВИ. Он жалуется на
головную боль, температура повышается до 39-40 градусов, резко появляется одышка, учащенное сердцебиение. Родителей должен насторожить синюшный цвет кожных покровов и области вокруг рта. Кашель из сухого быстро переходит в слизисто-гнойный. Ребенка может тошнить и рвать.
При деструктивной пневмонии,
отягощенной гнойным воспалением легкого
Симптомы будут нарастать в геометрической прогрессии: тяжелая одышка, синий оттенок лица и кончиков пальцев, начинается мгновенное нарастание интоксикации в тяжелой форме, потеря сознания.
Абсцесс легкого
Самая тяжелая форма, обычно характеризующаяся прорывом
гнойных скоплений в бронхи или плевральную полость. Если у ребенка гнойная форма пневмонии, симптоматика ее будет зависеть от степени процесса. Перед прорывом у ребенка наблюдаются: лихорадка, сопровождающаяся сильным ознобом, боли в грудной клетке, одышка, тахикардия.
Жалобы
В анамнезе можно выяснить наличие респираторно-вирусной инфекции. Среди наиболее частых жалоб можно отметить кашель, одышку, повышение температуры тела, недомогание, снижение аппетита.
Физикальное обследование
Всем пациентам с подозрением на ОГДП рекомендовано оценить общее состояние. При ОГДП общее состояние пациента тяжелое или очень тяжелое
При осмотре пациента с подозрением на ОГДП рекомендованообратить внимание на форму грудной клетки и ее участие в акте дыхания.
Легочные формы пневмонии сопровождаются отставанием пораженной половины грудной клетки в акте дыхания. При легочно-плевральных формах отмечается более выраженное отставание соответствующей половины грудной клетки в акте дыхания, ее выбухание, сглаженность и расширение межреберных промежутков. Необходимо провести аускультацию легких и перкуссии грудной клетки. Для инфильтративно-деструктивной формы характерными являются ослабление дыхания при аускультации и укорочение перкуторного звука при перкуссии. При развитии гнойного лобита можно наблюдать цианоз, одышку, отставание в акте дыхания соответствующей половины грудной клетки. При аускультации отмечается резкое ослабление дыхания, при перкуссии - укорочение перкуторного звука. Пиоторакс характеризуется отставанием соответствующей половины грудной клетки в акте дыхания, резким ослаблением дыхания при аускультации и укорочением перкуторного звука при перкуссии. Напряженный пиопневмоторакс проявляется синдромом внутриплеврального напряжения: выраженная одышка, прогрессирующий цианоз, поверхностное дыхание с раздуванием крыльев носа и участием вспомогательной мускулатуры. Наблюдается отставание в акте дыхания соответствующей половины грудной клетки, со значительным ослаблением или отсутствием дыхания при аускультации. При перкуссии отмечается тимпанит в верхних отделах плевральной полости, укорочение перкуторного звука – в нижних. Пневмоторакс (напряженный) сопровождается развитием синдрома внутриплеврального напряжения. При осмотре отставание в дыхании и выбухание пораженной половины грудной клетки. Аускультативно – ослабление дыхания, перкуторно – типанит. Буллезная форма не сопровождается клиническими проявлениями и представляет собой вариант благоприятного течения.
Лабораторные методы исследования.
Клинические анализы крови и мочи, биохимический анализ крови (протеинограмма, коагулограмма, трансаминазы, электролиты крови, С-реактивный белок (СРБ)).
- Общий анализ крови. Определяется лейкоцитоз, сдвиг формулы влево, ускорение скорости оседания эритроцитов.
- Исследовать С-реактивный белок. С-реактивный белок или белок острой фазы воспаления. Уровень С-реактивного белка быстро и многократно увеличивается при ОГДП. Синтез С-реактивного белка растет уже через 4-6 часов после начала воспалительного процесса, достигает пика через 1-2 дня и быстро снижается при выздоровлении. Референтное значение С-реактивного белка: менее 5 мг/л.
- Посев крови на аэробные и анаэробные микроорганизмы и чувствительность к антибиотикам. Метод качественного бактериологического исследования крови с целью выявления и идентификации микроорганизмов с постановкой антибиотиков чувствительных к выделенным патогенам.
- Посев плевральной жидкости на анаэробы и чувствительность к антибиотикам. Уровень идентификации микроорганизмов из плевральной полости колеблется от 8 до 76%. S.pneumoniae в плевральной жидкости при эмпиеме плевры высевается в 75% случаев при использовании полимеразной цепной реакции. Другие бактерии представлены S. pyogenus, Haemophilus influenza, Mycoplasma pneumonia, S. Aureus.
- Цитологический анализ плевральной жидкости для исключения туберкулеза. В парапневмоническом плевральном экссудате преобладают полиморфонуклеарные лейкоциты. Преобладание лимфоцитов может свидетельствовать о туберкулезе, что требует проведения дополнительных диагностических мероприятий.
- Биохимический анализ плевральной жидкости. В норме плевральная жидкость содержит небольшое количество клеток (в основном мезотелиальные клетки и макрофаги) с низким уровнем белка (0,1 г/л) и лактатдегидрогеназы.По сравнению с сывороткой крови плевральная жидкость имеет более высокие уровни бикарбонатов, аналогичный уровень глюкозы. Перечисленные параметры изменяются при воспалении плевры под воздействием большого числа цитокинов. При этом снижаются концентрация глюкозы (менее 40 mg/dL), pH менее 7,0. Повышение лактатдегидрогеназы более 1000 U/ml.Биохимический анализ плевральной жидкости помогает определиться со стадией парапневмонического плеврита и выбором тактики лечения. Наличие белка, ацидоза плевральной жидкости с высоким уровнем лактатдегидрогеназы и низким уровнем глюкозы отличает воспалительный экссудат от транссудата.Многофакторный логистический анализ в ретроспективных исследований показал, что pH менее 7,2 в плевральном экссудате является существенным показателем формирования 2-3стадии эмпиемы и является показанием к торакоскопической санации плевральной полости.
Бактериологические методы исследования.
Бактериологическое исследование производили с целью идентификации патогенного микроорганизма и определения его чувствительности к антибактериальным препаратам.
Забор бактериологического материала осуществлялся во время оперативного вмешательства, на 3-и и 5-е сутки после начала лечения в стерильную пробирку и доставлялся в лабораторию.
В случаях видеоторакоскопического лечения в комбинации с ультразвуковой кавитацией плевральной полости и легких, забор материала осуществлялся до и непосредственно после озвучивания плевральной полости и легких ультразвуком низкой частоты.
Для ориентировочной оценки количественного роста микроорганизмов в ассоциации (Приказ МЗ СССР №535 от 22 апреля 1985г. «Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебнопрофилактических учреждений») использовали критерии, представленные в таблице (критерии ориентировочной оценки количественного роста микроорганизмов в ассоциации).
Лучевые методы исследования острых гнойных деструкций легких.
Всем пациентам с подозрением на ОГДП рекомендовано выполнить рентгенологическое исследование органов грудной клетки.
Для инфильтративно-деструктивной формы характерно умеренная инфильтрация легочной ткани без четких границ с множественными мелкоячеистыми просветлениями. На стадии воспалительной инфильтрации паренхимы легких возможно развитие парапневмонического плеврита, типичными рентгенологическими признаками которого являются отсутствие дифференциации купола диафрагмы и плеврального синуса на стороне поражения за счет наслоения экссудата, гомогенное затемнение различной степени протяженности, отсутствие легочного рисунка, смещение тени сердца в противоположную сторону, коллабирование легкого.
Объем экссудата в плевральной полости можно определить на рентгенограмме грудной клетки в прямой и вертикальной позиции.
Малый объем будет соответствовать затемнению менее ¼ гемиторакса, умеренный объем экссудата – более 1/4 , но менее 1/2 гемиторакса и большой объем будет соответствовать затемнению более ½ гемиторакса.
Тотальное затемнение доли легкого с выпуклыми контурами и признаками парапневмонического плеврита характерно для лобита.
Абсцесс легкого проявляется очагом затемнения округлой формы с четкими краями. При сообщении с бронхом появляется уровень жидкости и воздушный пузырь над ним. В начале развития абсцесса легкого на фоне полисегментарного инфильтрата определяется округлое образование высокой степени затемнения с провисающей нижней границей.
Рентгенологические признаки пиоторакса: значительное затемнение соответствующей половины грудной клетки со смещением средостения в противоположную сторону, расширение межреберных промежутков и отсутствие дифференцировки купола диафрагмы и плеврального синуса. Напряжённый пиопневмоторакс определяется наличием воздуха над горизонтальным уровнем жидкости, значительным смещением средостения в противоположную сторону, коллабированием легкого, расширением межреберных промежутков, отсутствием дифференцировки купола диафрагмы и плеврального синуса. Пневмоторакс рентгенологически характеризуется свободным воздухом в плевральной полости (тотальное просветление), коллабирование легкого, смещением средостения в противоположную сторону, уплощением купола диафрагмы, расширением межреберных промежутков при напряженном пневмотораксе.
Буллезная форма определяется наличием тонкостенных воздушных полостей различного диаметра с четкими контурами на фоне неизмененной легочной ткани.
В зависимости от путей инфицирования легких бактериальные пневмонии подразделяют на первичные и вторичные. При первичных пневмониях стафилококк попадает в легкие с вдыхаемым воздухом, то есть бронхогенным путем, и вызываемый им воспалительный процесс первично развивается в легких. При вторичных пневмониях стафилококк проникает гематогенным путем из другого, первичного, гнойного очага в организме. Чаще всего этим первичным очагом является острый гематогенный остеомиелит. Большую часть настоящей лекции я посвящаю первичным ОГДП, которые по своей частоте намного преобладают перед вторичными. В конце лекции мы отметим лишь особенности клиники и диагностики вторичных пневмоний, отличающие их от первичных.
Попав аэробронхогенным путем в легкие и не встретив там достаточного сопротивления, стафилококк начинает размножаться в легочной ткани и при этом выделяет в нее множество своих токсиновферментов, важнейший из которых-некротоксин. Под его воздействием происходит некроз ткани. Оказавшись в этой «мертвой», совершенно не сопротивляющейся среде, стафилококки, как в термостате, где «тепло и сыро» и много кислорода (стафилококки — аэробы), быстро размножаются. Выделяемые ими протеолитические ферменты и гиалуронидаза воздействуют на «приютившую» их «мертвую ткань». Под их воздействием ткань распадается, возникают гнойные полости. Сливаясь друг с другом, эти полости образуют абсцессы легкого — первое осложнение стафилококковой (бактериальной) пневмонии
Рис. 17. На R-грамме (боковая проэкция) в средней доле правого легкого визуализируется очаг деструкции легочной ткани имеющий уровень газа и жидкости.
Абсцесс может опорожниться в плевральную полость, при этом в легком образуется отверстие —бронхоплевральный (чаще его называют — бронхиальный) свищ, через который в плевральную полость выливается гной, и с каждым дыханием туда же поступает воздух, количество которого быстро нарастает. Это, второе, очень тяжелое, осложнение бактериальной пневмонии называется пиопневмотораксом.

Рис.18. Пиопневмоторакс слева.
На R-грамме грудной клетки определяется: значительное количество воздуха и жидкости в плевральной полости, коллабирующее легкое и смещающие средостение в противоположную сторону . При этом уровень жидкости четко дифференцируется на фоне воздуха.
Рис. 19. Пневмомедиастинум справа и слева (обозначен стрелками).
Если абсцесс оказался в центральной части легкого, где располагаются крупные сосуды и бронхи с окружающей их рыхлой клетчаткой, он распространяется по ней в клетчатку средостения, вызывая гнойный медиастинит. Здесь вместе с гноем, как правило, оказывается и воздух из легочной ткани, и потому осложнение называется пиопневмомедиастинум. Это третье осложнение бактериальной пневмонии, которое встречается во много раз реже остальных.
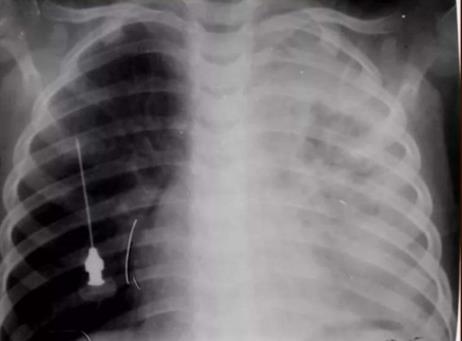
Рис. 20. Пиоторакс слева.
В случае если воспалительный процесс развивается в периферических отделах легкого, в него вовлекается висцеральная плевра, а воспалительный экссудат поступает в плевральную полость. Вначале продуцируется серозный стерильный экссудат и процесс характеризуется как экссудативный плеврит, но очень скоро в нем поселяется стафилококк, на борьбу с которым сюда мигрируют «полчища» лейкоцитов, и экссудат становится гнойным, то есть развивается гнойный плеврит. Это четвертое осложнение бактериальной пневмонии
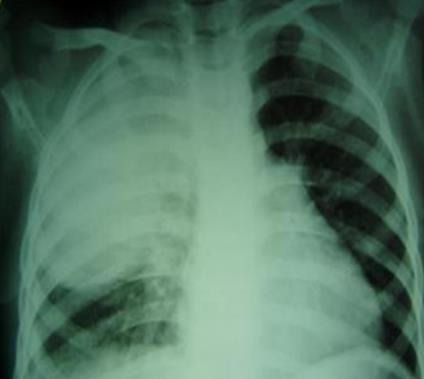
Рис. 21. Инфильтративнодеструктивная форма деструктивной пневмонии (средняя
степень тяжести).
Полисегментарная инфильтрация верхней доли и в различной степени выраженные проявления реактивного плеврита. Зачастую инфильтрат имеет характер лобита - с провисанием нижнего контура верхней доли.
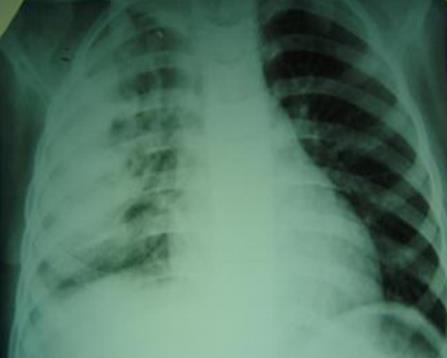
Рис.22. На 3-4 сутки тот же больной с инфильтративно-деструктивной формой.
В процессе разрешения воспалительного процесса на 3 - 4 сутки от начала интенсивной терапии при положительной динамике течения заболевания по данным рентгенографического контроля у детей с легочно - инфильтративной формой отмечается снижение интенсивности инфильтрата, на фоне которого начинают определяться полости деструкции.
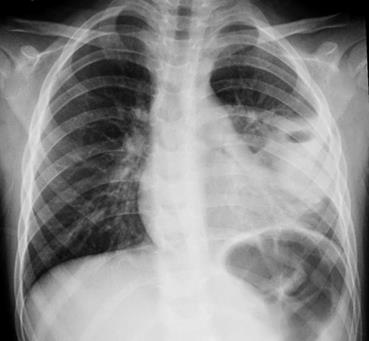
Рис.23. Гнойный лобит (деструктивная пневмония, отягощенная гнойным воспалением легкого).
В средней доле левого легкого отчетливо видно инфильтрацию паренхимы доли легкого, а так же очаг деструкции в центре с уровнем газа и жидкости.
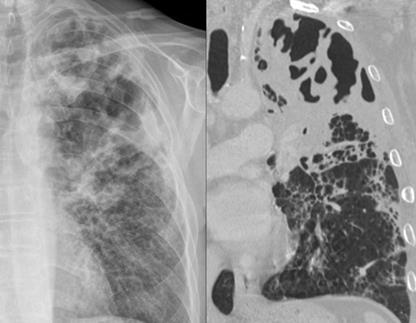
Рис.24. Абсцесс легкого на КТ.
Справа спереди верхней доли • легкого на уровне подключичного пояса - крупная абсцедирующая полость с жидким содержимым, окруженная широким валом уплотненной легочной ткани.
Дренирующийся и недренирующейся абсцесс легкого ?
После прорыва абсцесса состояние малыша либо улучшается, либо становится тяжелым. Последнее происходит, если гной прорвался в плевральную полость. При этом ребенок чувствует острую внезапную боль там, где произошел прорыв. В случае, когда прорыв был направлен в бронх, ребенок чувствует облегчение, снижается температура. Дети
довольно тяжело переносят это заболевание, и даже при благополучном и успешном лечении в дальнейшем болезнь может дать серьезные осложнения.
Недренирующийся абсцесс?
Клиническая картина недренирующегося абсцесса практически такая же, что и при бактериальном пневмоническом инфильтрате без нагноения. Там и тут выраженная дыхательная недостаточность и интоксикация, высокая температура. Физикально в обоих случаях отмечаются жесткое дыхание, влажные хрипы и укорочение перкуторного звука. Практически неотличимы они и на рентгенограмме: там и тут в легком — интенсивное гомогенное затемнение, охватывающее большой анатомический отдел (долю, несколько сегментов). Только округлость контуров инфильтрата (если таковая наблюдается) позволяет подумать об абсцедировании. Иногда, если абсцесс располагается в периферических отделах легкого, установить его помогает ультразвуковое исследование.
Отличие абсцесса и инфильтрата без нагноения ?
Обычно же диагноз ставится на основании динамического наблюдения при интенсивном лечении пневмонии. Если на фоне этого лечения в течение двух — трех дней состояние ребенка улучшается (снижается температура, улучшаются физикальные данные и картина крови), об абсцедировании, вероятно, речи не идет. Если эффекта от лечения нет, ребенок продолжает гектически лихорадить, не снижается и даже растет лейкоцитоз, нет положительной динамики по физикальным данным — здесь недренирующийся абсцесс, который надо опорожнять путем пункции через грудную стенку. Пункция производится под местной инфильтративной анестезией, но, в отличие от плевральной пункции, здесь требуется премедикация атропином. Это обусловлено тем, что иглу в абсцесс проводят через легочнуюткань, аонаиннервируется блуждающим нервом, его раздражение припункци и может реализовать ваговагальный рефлекс на работу сердца, у которого, как вы помните из физиологии, n. vagus вызывает урежение сокращений вплоть до асистолии. Место пункции выбирается по рентгенограмме в двух проекциях: по прямой рентгенограмме выбирается межреберье, а по боковой —линия пункции. В остальном техника пункции идентична плевральной. Техника пункции После того как игла преодолевает межреберье, она сразу попадает в легкое, так как на месте абсцесса оно обычно спаяно с париетальной плеврой. Поэтому зажим с трубки можно снять. При дальнейшем продвижении иглы следует одновременно потягивать поршень шприца. Когда игла проваливается в абсцесс, в шприц начинает поступать густой гной. Его нужно эвакуировать до конца, а затем несколько раз промыть полость абсцесса антисептиками и ввести суточную дозу антибиотика широкого спектра действия. Обычно бывает достаточно одной пункции, изредка приходится повторять ее через несколько дней. Показанием для повторной пункции является новое нарастание клинической картины, характерной для недренирующегося абсцесса и описанной выше. Перед пункцией опять нужна рентгенография грудной клетки для выбора точки пункции, так как абсцессы имеют свойство опускаться ниже.
Дренирующийся абсцесс ?
Клиническая картина дренирующегося абсцесса Клиническая картина дренирующегося абсцесса другая. Особенно она характерна для хорошо дренирующегося его варианта. Так называются абсцессы, вскрывшиеся в широкий бронх, расположенный близко к дну гнойника. Ситуация выглядит примерно так. Сестра докладывает утром врачу, что тяжелый ребенок с пневмонией, который несколько дней высоко температурил, ночью вдруг начал сильно влажно кашлять, откашливает много мокроты, температура снизилась. При осмотре врач находит выраженное изменение физикальных данных: там, где вчера было укорочение перкуторного звука, появился тимпанит, а при аускультации здесь же отмечается появление амфорического дыхания. Врач может легко вздохнуть — абсцесс у ребенка вскрылся в бронх.
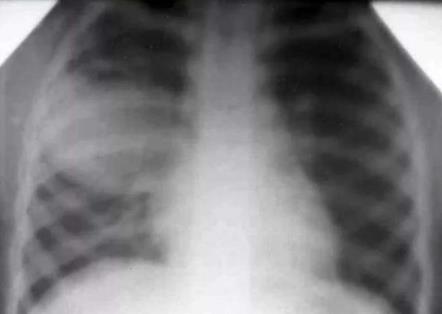
Рис.25. Рентгенограмма больного с хорошо дренирующимся абсцессом верхней доли правого легкого.
Плохо дренирующийся абсцесс?
Плохо дренирующиеся абсцессы опорожняются через мелкий бронх, располагающийся в верхних отделах гнойника Их клиническая картина тем больше напоминает описанную выше клинику недренирующегося абсцесса, чем хуже он дренируется. И наоборот, чем лучше он дренируется, тем больше по клинике похож на хорошо дренирующийся абсцесс. Опорожнение плохо дренирующегося абсцесса начинают с консервативных мероприятий. Обычно они успешны. При их неэффективности абсцесс опорожняется пункцией через грудную стенку, как это описано при недренирующемся абсцессе.
Пиопневмомедиастинум ?
Пиопневмомедиастинум является довольно редким осложнением бактериальной пневмонии. Диагностика его не сложна, поскольку клиника типична. На фоне пневмонии состояние больного ухудшается, изменяется его внешний вид — утолщаются шея и подчелюстные области, на шее становятся заметными выбухающие подкожные вены. При ощупывании шеи чувствуется подкожная эмфизема, которая нарастает. На рентгенограмме грудной клетки видны расширение тени средостения и отслоение кнаружи медиастинальной плевры, под которой прослеживаются прослойки воздуха.
Ультразвуковое исследование легких и плевральной полости на наличие гнойных плевральных выпотов.
УЗИ грудной клетки является высоко информативным радиологически безопасным методом диагностики плевральных выпотов, который позволяет эргономично и неинвазивно установить гнойный характер экссудата и определить оптимальное место дренирования. Для эмпиемы плевры характерно наличие в экссудате неоднородной плотной малоподвижной эхогенной взвеси, выраженные плевральные наложения, частое осумкование. При пиопневмотораксе в структуре выпота лоцируются множественные рыхло расположенные крупнозернистые гиперэхогенные сигналы от мелких пузырьков воздуха в гнойном экссудате, выше которого видна гиперэхогенная пристеночная линия от свободного воздуха с акустической тенью и интенсивными реверберациями «повторного эха».
Всем пациентам с подозрением на ОГДП рекомендовано выполнить ультразвуковое исследование плевральной полости.
Ультразвуковое исследование плевральной полости позволяет определить наличие жидкости, ее количество, расположение жидкости в плевральной полости в случаях ее осумкования. Ценность УЗИ повышается, если оно используется для выбора анатомической области дренирования плевральной полости. Существенным является то, что при УЗИ плевральной полости можно определить стадию гнойно-воспалительного процесса. Для эмпиемы плевры в экссудативной стадии характерен однородный эхонегативный выпот, свободно распределенный в плевральной полости. Фибринозно-гнойная стадия эмпиемы характеризуется неоднородностью картины плеврального содержимого из-за множества мелких сигналов, зависящих от количества в нем взвеси, и умеренным утолщением листков плевры.
При эмпиеме плевры в стадии организации в плевральной полости на фоне жидкости визуализируется фибриновые нити и шварты в виде линейных эхо структур, которые делят свободное пространство плевральной полости на ячейки. Основной эхографический признак эмпиемы плевры – разделение двух сигналов от плевральных листков эхонегативным участком однородной или неоднородной структуры, представляющей собой содержимое плевральной полости. Стадию парапневмонического плеврита также можно определить по плотности содержимого плевральной полости в единицах Хуансфильда. В стадии экссудации этот показатель составляет 15-20 ед. в гнойно-фибринозной стадии – 20-40 ед., в стадии организации фибриноторакса – выше 40 ед.
Главным ультразвуковым признаком эмпиемы плевры являлась крупнозернистая неоднородная взвесь с высокой плотностью частиц в единице объёма, которая придавала выпоту достаточно высокую эхогенность, иногда даже превышавшую эхогенность нормальной печени (рис.32 ). Она выявлена у 264 (92,6 %) больных, значительно реже при эмпиеме наблюдалась относительно рыхлая, мелкозернистая и однородная взвесь.
Рис.32. Распространённая эмпиема плевры с плотной эхогенной взвесью (1), сопоставимой с эхогенностью нормальной печени (2).
Ещё одним отличием гнойной взвеси являлась малая подвижность её частиц, которые незначительно смещались при сердцебиении или интенсивных глубоких вдохах.
Это свойственно распространённой эмпиеме и крупным гнойным осумкованиям, но в небольших осумкованных полостях взвесь оставалась неподвижной. В большинстве случаев взвесь диффузно и равномерно занимала весь объём и только у 18 (6,3 %) больных её плотность и эхогенность нарастали в пристеночной области, что делало границу утолщенной плевры с гнойным содержимым менее чёткой и затрудняло точное определение толщины плевральных наложений.
При высокой плотности и эхогенности неподвижная гнойная взвесь по эхоструктуре напоминала печень при жировом гепатозе, а утолщенная плевра выглядела по сравнению с ней гипоэхогенной (рис.33).
Такая эхокартина возникала при густом сливкообразном гное, который в серошкальном изображении имитировал объёмное образование. Для дифференцировки с опухолью требовалось выявить смещение частиц взвеси при сердцебиении или форсированном дыхании. При разной консистенции гнойное содержимое приобретало неоднородную структуру с менее вязкими гипоэхогенными зонами, медленно менявшими конфигурацию при перемене положения тела пациента, а локальные скопления более густого гноя лоцировались в гипоэхогенном жидком содержимом как эхогенные опухолевидные объекты диаметром до 4–5 см.
Рис. 33. Ограниченная эмпиема плевры с высоко эхогенной плотной однородной взвесью, имитировавшей солидное образование (1), гипоэхогенная утолщенная висцеральная плевра (2) вдоль гиперэхогенной границы воздушного лёгкого (3)
Равномерно утолщенная, с фибринозными наложениями плевра принципиально не отличалась от адгезивных изменений при экссудативном плеврите серозно-фибринозного характера. Стенки эмпиемной полости имели толщину до 5 мм, а при выраженных наложениях достигали 8 мм. Утолщенные листки плевры хорошо прослеживались вдоль грудной стенки, диафрагмы и лёгкого в виде дополнительной эхогенной полосы с чётким неровным контуром (рис. 34).
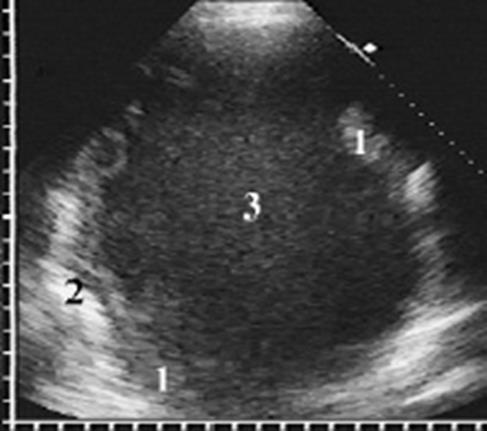
Рис. 34. Ограниченная эмпиема плевры. Утолщенная плевра в виде эхогенной полосы с чётким неровным контуром (1), отграничивающей гиперэхогенную поверхность воздушного лёгкого (2) от рыхлой мелкозернистой гнойной взвеси (3).
Изложенная эхокартина характерна для первично обследуемой полости эмпиемы. В процессе лечения после дренирования и промывания происходило значительное снижение плотности эхогенной взвеси, содержимое эмпиемного мешка становилось более однородным и анэхогенным, плевральные наложения уплотнялись. Размеры полости уменьшались, она приобретала более плоскую форму вдоль грудной стенки, а затем спадалась. В итоге на месте эмпиемы формировалась эхогенная шварта с облитерацией плевральной полости и отсутствием дыхательной подвижности лёгкого.
При пиопневмотораксе в плевральной полости содержался не только гнойный экссудат, но и воздух, как свободный, так и в виде отдельных мелких пузырьков в выпоте. Эхопризнаком пиопневмоторакса были множественные крупнозернистые и короткие линейные (длиной 2–3 мм) гиперэхогенные включения в виде очень яркой и крупной, но рыхлой взвеси, по своим размерам и эхогенности значительно превосходившей гнойную. Эти сигналы возникали при отражении ультразвука от мелких пузырьков воздуха, попавших в плевральную полость через бронхоплевральную фистулу при деструции в лёгком. Они диффузно распределялись по всему выпоту на фоне неоднородной гнойной взвеси или концентрировались в верхней части полости эмпиемы (рис.35).
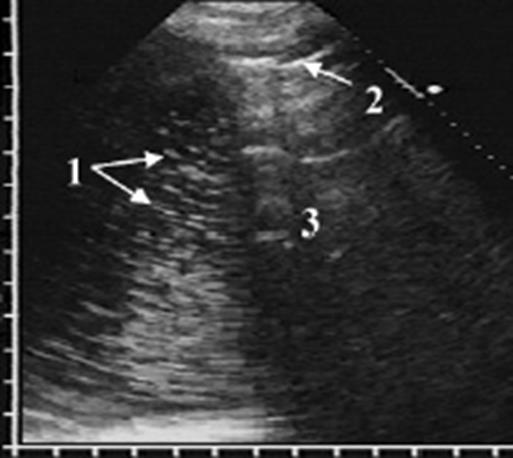
Рис. 35. Пиопневмоторакс: в плевральном выпоте видны множественные гиперэхогенные крупнозернистые и короткие линейные сигналы (1) от мелких пузырьков воздуха в гнойном экссудате, выше которых лоцируется гиперэхогенная линия (2) с дистальной акустической тенью (3) от свободного воздуха в плевральной полости.
Вторым обязательным компонентом эхокартины при пиопневмотораксе являлся свободный воздух в плевральной полости. Скапливаясь выше неоднородного жидкого содержимого, он приводил к появлению над ним пристеночной гиперэхогенной линии, очень похожей на линию от поверхности воздушного лёгкого, но более интенсивной и с выраженными реверберациями «повторного эха». При неравномерной толщине плевральных наложений эта гиперэхогенная линия была неровной, ступенчатой, в точности повторяя внутренний рельеф утолщенной костальной плевры. Акустическая тень и дистальные реверберации позади неё перекрывали все глубже лежащие структуры. Вследствие передаточной пульсации при сердцебиении край этой линии смещался вверх-вниз вдоль грудной стенки с высокой частотой и небольшой амплитудой, напоминая движения иглы швейной машинки, в отличие от ритмичных дыхательных движений нижнего края лёгкого.
Отдельные гиперэхогенные включения воздуха, находившиеся во взвешенном состоянии в достаточно густом экссудате, имели незначительную смещаемость и колебались с небольшой амплитудой в такт с движениями сердца или лёгкого. Они оставались неподвижными только при плотной эхогенной гнойной взвеси. Часто мелкие гиперэхогенные сигналы скапливались у стенок полости эмпиемы, формируя вдоль них пунктирные белые линии или цепочки, подчёркивавшие поверхность утолщенной плевры. Мы назвали это симптомом подчёркивания, его лучше видно вдоль костальной и диафрагмальной плевры (рис. 36).
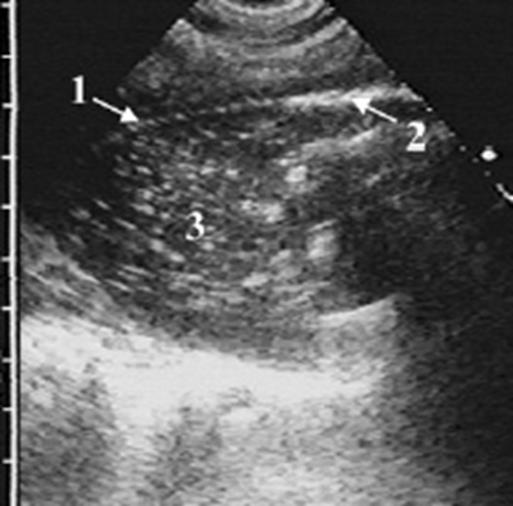
Рис. 36. Ограниченный пиопневмоторакс. В гнойном экссудате лоцируются гиперэхогенные крупнозернистые сигналы (1) от отдельных пузырьков воздуха, гиперэхогенная линия (2) с дистальной акустической тенью от свободного воздуха в плевральной полости, симптом подчёркивания – пристеночно мелкие пузырьки воздуха в виде цепочки гиперэхогенных сигналов вдоль внутренней поверхности утолщенной плевры (3).
Глава 9.
Методы лечения пациентов при ОГДП.
1. Пациенты с ОГДП, у которых малый или умеренный объем парапневмонического плеврита в стадии экссудации.
Рандомизированных исследований, касающихся выбора антибиотиков при деструктивных пневмониях у детей, не проводилось, и они вряд ли будут организованы в связи с редкостью данной патологии. Выбор антимикробного агента в идеале основывается на выделении возбудителя и определении его чувствительности, однако это требует времени. Поэтому старт лечения начинается с эмпирической антибиотикотерапии с учетом тяжести пневмонии (см. Приложение Г). В связи с этим, выбор антимикробного агента для эмпирической антибиотикотерапии должен базироваться на местных данных о восприимчивости микроорганизмов. В частности на сведениях о распространенности метициллинрезистентного золотистого стафилококка (Methicillin-resistant Staphylococcus aureus — MRSA) и штаммов Streptococcus pneumoniae, резистентных к бензилпенициллину/цефуроксиму**. Выбранный препарат или комбинация препаратов должны быть, как минимум, эффективны в отношении Streptococcus pneumoniae и Staphylococcus aureus. Так, специалисты из Канадского педиатрического общества в качестве первоначального выбора для эмпирической антибиотикотерапии в отсутствие подтвержденного организма, рекомендуют использовать цефотаксим** или цефтриаксон** Для улучшения воздействия на возможную анаэробную микрофлору или MRSA рекомендуется комбинация вышеуказанных препаратов с клиндамицином. Другим вариантом комбинации антибиотиков является добавление вместо клиндамицина ванкомицина (или линезолида**); этот вариант обычно используется в случае подтвержденной инфекции MRSA или при обоснованном подозрении на неё. Общество инфекционных болезней и Педиатрическое Общество инфекционных болезней Америки рекомендуют эмпирическую антибактериальную терапию ампициллином** детям, полностью иммунизированным против гемофильной и пневмококковой инфекций. Альтернативой для детей, не имеющих завершенного курса иммунизации, являются цефалоспорины 3 поколения, при наличии доказательств или обоснованного подозрения на MRSA дополнительно назначается клиндамицин или ванкомицин (альтернатива – левофлоксацин**).
Когда этиологический агент идентифицирован, проводят коррекцию антибиотикотерапии с учетом определенной чувствительности.
Рекомендуемая общая продолжительность антибиотикотерапии эмпием, если есть адекватный дренаж, и нет доказательств дополнительных осложнений, составляет от трех до четырех недель. Первоначально антибиотики вводятся внутривенно в течение 10-14 дней. После удаления дренажа и клинического улучшения пациента его переводят на пероральные антибиотики, выбор которых также зависит от локальных данных о чувствительности. Наиболее часто препаратом выбора для пероральной терапии на данном этапе является амоксициллин-клавуланат** в дозе 75-100 мг/кг массы тела по амоксициллину. Продолжительность пероральной антибиотикотерапии в зависимости от ситуации может составлять от 1 до 6 недель.
При лечении детей с эмпиемами следует учесть, что лихорадочная реакция у них нередко сохраняется более чем 72 часа после старта антибиотикотерапии; если ребенок имеет клинические проявления улучшения состояния, сохраняющаяся лихорадка обычно не является признаком неудачи антибиотикотерапии.
Пациентам при экссудативном плеврите рекомендуются повторные плевральные пункции.
Пункции выполняют в 6-7 межреберье по задней аксиллярной линии под местной анестезией. В случае образования спаек между плевральными листками и отграничения процесса в плевральной полости используют УЗИ для определения места пункции.
ПУНКЦИЯ ПЛЕВРАЛЬНОЙ ПОЛОСТИ.
Обычно пункцию производят в положении больного сидя на перевязочном столе. Голова и туловище наклонены вперед, а плечо на стороне пункции отведено вверх и вперед для расширения межреберных промежутков (рис.37). Целесообразно, чтобы голову и руку больного поддерживали.
Классическим местом для пункции плевральной полости с целью удаления жидкости является седьмое и восьмое межреберья между средней подмышечной и лопаточной линиями. Для отсасывания воздуха пункцию делают во втором или третьем межреберье по среднеключичной линии. Место пункции следует уточнять перкуссией, аускультацией и особенно рентгеноскопией.
Пункцию, как правило, производят под местной анестезией 0,5 % раствором новокаина (10—15 мл), которым послойно инфильтрируют грудную стенку в месте намеченного прокола.
Для пункции применяют достаточно длинную и толстую иглу, соединенную со шприцем резиновой трубкой длиной 10—15 см или краном. Прямое соединение иглы со шприцем не должно применяться, так как это всегда грозит попаданием воздуха из атмосферы в плевральную полость в момент отсоединения шприца.
Точка прокола грудной стенки должна соответствовать верхнему краю ребра во избежание повреждения межреберных сосудов и нерва, расположенных вдоль нижнего края. Направление вкола иглы — перпендикулярно к коже. На глубине 3—5 см в зависимости от толщины грудной стенки часто удается ощутить прокол париетальной плевры.
Всегда необходимо иметь в виду возможность ошибочного введения иглы в легкое, диафрагму, печень, селезенку, желудок.(рис.39).
При отсасывании воздуха или жидкости из плевральной полости перед отсоединением шприца накладывают зажим на резиновую трубку или закрывают кран.
По ходу удаления плеврального содержимого иногда несколько продвигают или извлекают иглу, меняют ее направление.
Эвакуировать большие количества жидкости или воздуха из плевральной полости нужно медленно, чтобы не вызвать очень быстрого смещения средостения.
| Виды | Методика пункции | Ошибки при выполнении плевральной пункции: |
| 1. диагностическая (зачастую переходит в лечебную) 2. лечебная | 1. Пункция проводится при поднятой и заведенной за голову руке на стороне пункции (т.к. в этом случае расширяются межреберные промежутки) 2. Пункция проводится по верхнему краю нижележащего ребра (меньше опасность повредить сосудисто-нервный пучок) 3. Делаем местную анестезию новокаином в месте предполагаемой пункции. 4. Натягиваем кожу и иглой с трубкой, зажатой зажимом, под прямым углом к поверхности тела пунктируем грудную клетку: а) при скоплении жидкости: в 7-8 межреберье по средней подмышечной линии б) при пневмотораксе: во 2-3 межреберье по средней ключичной линии 6. При значительном выпоте в плевральной полости (1-1,5 л) не следует все аспирировать, т.к. это может вызвать резкое падение сердечного выброса. | 1. Повреждение легкого (при пункции выше 8-ого межреберья) 2. Повреждение печени (при пункции ниже 8-ого межреберья: темная или алая кровь без пузырьков воздуха) На основе техники плевральной пункции разработана торакоскопия (видеоторакоскопия). |
| Инструменты для выполнения плевральной пункции (рис.38): | ||
| 1. толстая игла 2. резиновая или силиконовая трубка 3. шприц (обычный или Жане) или вакуумный аспиратор 4. Кровоостанавли-вающий зажим. |
Рис. 37. Положение больного при проведении пункции.
Рис. 38. Набор для проведения плевральной пункций.
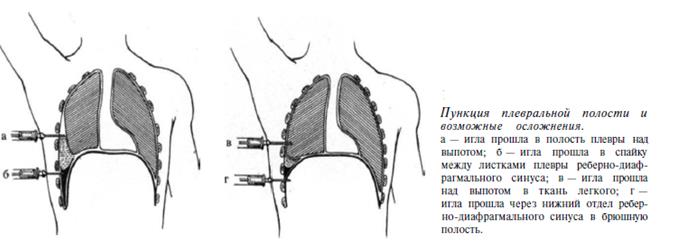
Рис. 39. Ошибки при выполнении плевральной пункции.
Шприцы и пробирки для проб жидкости для исследования:
1) биохимическое (белок, лактатдегидрогеназа (ЛДГ), pH, глюкоза, триглицериды, общий холестерин, амилаза, аденозиндеаминаза (ADA) — сухая пробирка, 5 мл жидкости;
2) гематокрит — пробирка с сухим версенианом (ЭДТА) или гепаринизированная, 2–3 мл раствора;
3) морфологическое (клеточный состав) — пробирка с сухим версенианом (ЭДТА) или гепаринизированной, 2–3 мл раствора;
4) цитологическое — пробирка с гепарином (1 мл), >30–50 мл жидкости;
5) микробиологическое — стерильная пластмассовая пробирка или питательная среда;
6) иммунологическое (комплемент, ревматоидный фактор, антинуклеарные антитела [ANA]) — сухая пробирка, 5 мл раствора.
Пациентам с гнойным плевритом необходимо выполнять торакоцентез и дренирование плевральной полости.
Процедура выполняется под общим обезболиванием, после предварительного УЗИ плевральной полости. Торакоцентез выполняется по средней аксиллярной линии в зоне безопасного треугольника, который ограничен передним краем широчайшей мышцы спины, латеральным краем большой грудной мышцы, верхней горизонтальной линией, проведенной через грудной сосок с вершиной треугольника на нижнем крае аксиллярной линии. Эта позиция снижет риск повреждений мышечных структур грудной клетки и является более комфортной для пациента в положении лежа. В зависимости от возраста ребенка используют дренажные трубки размером 8-12 CH/FR (шкала Шарьера).

Методы дренирования плевральной полости:
Торакоцентез
В 7-8 межреберье надсекают кожу и проколом вводят в плевральную полость троакар с мандреном-стилетом. Острие мандрена направляют вверх, удаляют мандрен и вводят дренажную трубку. Троакар удаляют, дренаж фиксируют двумя швами к коже и подключают к системе пассивной аспирации. Во избежание повреждения легкого не рекомендуется прикладывать больших усилий при проведении троакара в плевральную полость.

Закрытая межреберная торакотомия
Выполняется в 7-8 межреберье по средней аксиллярной линии, где производится разрез кожи длинной 1 см. Подготовленную дренажную трубки захватывают зажимом и через прокол в межреберье вводят в плевральную полость. Рану ушивают швами, трубку фиксируют к коже.
Рентгенография в вертикальной позиции выполняется после дренирования с целью оценки положения дренажной трубки в плевральной полости и исключения пневмоторакса.
Рекомендации , которые необходимо соблюдать по ведению пациента с
дренированием плевральной полости:
1. Дренирующая система должна обеспечивать непрерывный отток жидкости или воздуха из плевральной полости.
2. Погруженная под воду стеклянная трубка снабжается вентилем, приготовленным из пальца, отрезанного от резиновой перчатки, который предохраняет от обратного засасывания.
3. Первое боковое отверстие дренажной трубки не должно быть вне плевральной полости под кожей, что превращает отсасывающую систему в открытую и отсасывание становится неэффективным.
4. Сосуд с жидкостью и свободным концом дренажной трубки всегда должен быть ниже уровня грудной клетки пациента.
5. В случае обструкции дренажа гнойным экссудатом его можно промыть 10 мл физиологического раствора.
6. Дренажная трубка из плевральной полости может быть удалена при полной уверенности в отсутствии экссудата в плевральной полости, что контролируется УЗИ.
3. Пациенты с плевритом в стадии гнойно-фибринозного экссудата необходимо выполянть внутриплевральным введением фибринолитических препаратов.
Фибринолитические препараты способны растворять фибринозные пленки и перегородки, формирующие множественные небольшие гнойные полости, очищать лимфатические поры листков плевры, создавая условия для свободной циркуляции плевральной жидкости и ее оттока через дренажную трубку.
Фибринолитическое лечение эмпиемы плевры позволяет отказаться от хирургического лечения у 90% детей.
Используют следующие фибринолитические препараты: «Урокиназа», «Стрептокиназа», «Альтеплаза» (активатор тканевого плазминогена – tPA). Нет доказательств преимуществ одного препарата перед другим.
Детям при эмпиеме плевры необходимо применение урокиназы в качестве фибринолитической терапии (!).
«Урокиназа» (Urokinase) вводится два раза в день по 40000ед. в 40 мл 0,9% раствора натрия хлорида у детей весом 10 кг и выше; 10000 ед. в 10 мл 0,9% раствора натрия хлорида у детей весом менее 10 кг. После введения препарата в плевральную полость дренажная трубка пережимается на 2 часа. Продолжительность лечения составляет 3 дня (всего 6 раз).
После завершения лечения пиоторакса фибринолитиками дренажная трубка из плевральной полости удаляется при количестве отделяемого равного 1 мл/кг массы тела в сутки, рассчитанного за последние 12 часов.
4.Пациенты с подтвержденным абсцессом легкого рекомендуется провести консервативное лечение.
Наряду с антибактериальной терапией целесообразно провести бронхоскопию для удаления гноя из полости абсцесса и промывание ее антисептическими растворами. Эффективным бывает постуральный дренаж в сочетании с вибрационным массажем грудной клетки и ингаляции.
Вибрационным массаж грудной клетки

В качестве вспомогательной терапии при лечении разных заболеваний очень часто используются различные методики массажа. Одним из самых безопасных и эффективных вспомогательных методов лечения кашля у детей является дренажный массаж (это процедура вибрационного типа). Дренажный массаж для детей при кашле способствует выведению мокроты из бронхов, стабилизирует работу дыхательных путей.
Преимущества дренажного массажа:
- укрепляет мускулатуру дыхательных путей;
- восстанавливает дыхание;
- стимулирует лимфообращение и циркуляцию крови;
- ускоряет процесс очищения организма от бактерий;
- увеличивает подвижность ребер.
Методика проведения вибрационного массажа грудной клетки детям
Ребенку дренажный массаж могут делать сами родители, но первый раз эту процедуру желательно сделать под контролем специалиста. Интенсивность и продолжительность воздействия зависят от возраста ребенка. Движения должны быть мягкими, не стоит очень сильно надавливать. Маленьким детям достаточно 10-15 минут, для детей постарше продолжительность процедуры может составлять до 25 минут.
Перед проведением массажа необходимо проветрить и увлажнить помещение.
Вначале массируют грудную клетку, а затем переходят к массажу спины. Во время массажа спины очень важно, чтобы туловище ребенка находилось немного выше головы. Для этого достаточно положить под живот и ноги валик или плотную подушку. Это делается для того, чтобы скопившаяся слизь легче выходила из дыхательных путей.
Дренажный массаж начинают и заканчивают более мягкими и деликатными воздействиями. Наиболее активные и сильные поглаживания, пощипывания и постукивания проводятся в середине процедуры. Массаж проводят за час до приема пищи или через 2 часа после приема пищи, не позднее, чем за 2 часа до сна.
Техника дренажного массажа ребенку Вначале ребенок находится на спине, ноги согнуты в коленях. Начинают с мягких, поглаживающих движений грудной клетки, затем переходят к растиранию, а потом к легкому дренажу подушечками пальцев, заканчивают поглаживанием. Затем делают массаж спины. Голову ребенка располагают ниже туловища. Массаж начинают с поглаживаний, делают растирание, после чего переходят к прерывистым вибрациям, постукиванию, похлопыванию. После каждого элемента не забывайте делать поглаживание. Массаж спины также заканчивают поглаживанием.
Дренажный массаж выполняют на области грудной клетки, не затрагивая при этом позвоночник и почки. При выполнении вибраций обходят область сердца. Дренажный массаж производится не более 2 раз в день, курсом в 8-10 дней. Даже если улучшение самочувствия произошло после нескольких сеансов, оставшиеся процедуры надо обязательно доделать.
Комплексная интенсивная терапия (применяется у всех пациентов):
- антибактериальная,
- дезинтоксикационная,
- противогрибковая,
- бронхомуколитическая,
- антикоагулянты,
- симптоматическая.
По показаниям использовать респираторную поддержку и экстракорпоральные методы детоксикации.
Лечебная фибробронхоскопия.
Метод использовался при дренирующихся через бронх абсцессах легкого и гнойном эндобронхите. Кратность применения формировалась согласно клинико-рентгенологической и эндоскопической картине.
Трансторакальное дренирование ограниченных внутриплевральных полостей под ультразвуковым контролем.
Метод обезболивания – общая анестезия. Посредством ультразвукового исследования визуализируется ограниченная внутриплевральная полость, проводится её биометрия и выбирается наиболее рациональная точка установки дренажа. Выполняется диагностическая пункция. При получении гноя в той же точке проводится торакоцентез с проведением в полость дренажа на стилете. По извлечении стилета и эвакуации гноя полость промывается 55 раствором антисептика, дренаж фиксируется к коже хирургическим швом. Аспирация активная.
Дата добавления: 2020-11-29; просмотров: 306; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
