Газовые законы для изопроцессов. Изопроцессы в газах.
Процессы, происходящие при неизменном значении одного из параметров, называют изопроцессами. Газовые законы выражают количественную зависимость между двумя параметрами данной массы газа при фиксированном значении третьего параметра.
Для идеальных газов выполняются законы:
1) Закон Бойля-Мариотта: для данной массы газа при постоянной температуре произведение давления газа на его объем есть величина постоянная:
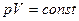 при
при  ,
, 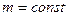 .
.
с этого закона следует, что для двух состояний газа при данных условиях справедливо уравнение
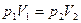 .
.
Процесс, протекающий при постоянной температуре, называется изотермическим. Кривая, отображающая зависимость между величинами 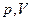 , характеризует свойства вещества при постоянной температуре, называется изотермой. Изотерма представляет собою гиперболу, характеризующую зависимость давления от объема при разных значениях температуры и расположены на графике тем выше, чем выше температура, при которой протекает процесс
, характеризует свойства вещества при постоянной температуре, называется изотермой. Изотерма представляет собою гиперболу, характеризующую зависимость давления от объема при разных значениях температуры и расположены на графике тем выше, чем выше температура, при которой протекает процесс 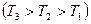 .
.

Рис.1
На рис.1 (а, б, в) изотермы в координатах p, V и прямых линиях в координатах p, T та V, T .
2) Закон Гей-Люссака: для данной массы газа при постоянном давлении отношение объема к абсолютной температуре есть величина постоянная:
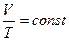 при
при 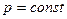 ,
, 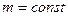 .
.
При выполнении ограничений для двух произвольных состояний газа можно записать:

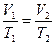 .
.
Процесс, протекающий при постоянном давлении, называется изобарным. График зависимости между параметрами состояния данной массы газа при постоянном давлении – изобара. Чем выше расположена изобара в координатах  ,тем меньшому давлению она соответствует
,тем меньшому давлению она соответствует  .
.
|
|
|

Рис.2
На рис.2 изображено две изобары в координатах V, T для разных значений давления p1 і p2, при этом p1<p2. На рис.2 б, даны графики изобарного процесса в координатах p, T, p, V.
3) Закон Шарля: для данной массы газа при постоянном объеме отношение давления к абсолютной температуре есть величина постоянная:
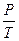 = const при
= const при 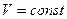 ,
, 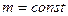 .
.
Процесс, протекающий при постоянном объеме, называется изохорным. На диаграмме в координатах 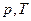 этот процесс изображается прямой, называемой изохорой. Чем выше изохора, расположенная в координатах
этот процесс изображается прямой, называемой изохорой. Чем выше изохора, расположенная в координатах 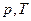 , тем меньшому объему она соответствует
, тем меньшому объему она соответствует 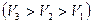 .
.

Рис.3
На рис. 3а в координатах p, T изображено две изохоры разных значений объема V1 и V2, при этом V1<V2. На рис. 3б, в дан график процесса в координатах V, T и p, V.
Таким образом, мы убедились в том, что основные газовые законы (Бойля-Мариотта, Гей-Люссака и Шарля) – это определенные случаи уравнения Клапейрона – Менделеева.
Дата добавления: 2020-11-29; просмотров: 67; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
