Уравнение состояния идеального газа. Уравнение Менделеева - Клапейрона.
Конспект занятия .
Идеальный газ.
Газ— агрегатное состояние вещества, для которого характерно большие расстояния между частицами по сравнению с твердыми и жидкими состояниями, малыми межмолекулярными взаимодействиями между ними, разупорядоченность, а средняя кинетическая энергия движения молекул намного больше за энергию взаимодействия между ними. Газ занимает весь предоставленный объем. Он не образует поверхности. Характерным примером газа является воздух, который состоит из нескольких газов — азоту, кислороду, окси углерода, аргону и др.
Идеальный газ. – это большое количество молекул, которые взаимодействуют только при столкновениях. Размеры молекул малы по сравнению со средними расстояниями между ними. Молекулы изменяют направление своего движения только при упругих столкновениях, а между столкновениями они движутся равномерно и прямолинейно. У идеального газа: молекулы не имеют размеров; отсутствуют силы межмолекулярного взаимодействия; столкновения молекул между собой и со стенками сосуда абсолютно упругие.
В природе идеального газа не существует. Идеальней газ – это реальный газ при достаточно низком давлении и высокой температуре, что позволяет пренебречь размерами и взаимодействием молекул.
Температура – величина, характеризующая тепловое равновесие системы. Во всех частях системы, находящейся в тепловом равновесии, температура одинаковая. Метод измерения температур основывается на установлении теплового равновесия между двумя телами при тепловом контакте. Считают, что два тела А и В имеют одинаковую температуру, если каждое из них находится в тепловом равновесии с телом С. Тело С называют термометром. Термометр – это тело, находящееся в тепловом контакте с другими, температура которого измеряют. После установления между ними теплового равновесия можно утверждать, что измеренная температура равна температуре термометра.
|
|
|
Действие термометра основано на зависимости некоторых физических свойств тел от температуры. Например, в жидких термометрах используют той факт, что высота столба жидкости в трубке термометра линейно возрастает с повышением температуры. Для градирования термометра стеклянный баллон в виде капилляра, заполненный закрашенным спиртом, толуолом либо ртуть, опускают в лед, тающий при нормальных условиях (0 °С, р = 1,01·105 Па = 760 мм. рт. ст.). После того, как между термометром и льдом наступит тепловое равновесие, движение жидкости в капилляре приостановится. Напротив этого уровня на шкале делаем отметку 0 ° С, после чего термометр переносится в кипящую дисцилированную воду при нормальном давлении. После прекращения поднятия жидкости в капилляре термометра делается отметка 100 °С, потом отрезок между 0 и 100 °С делят на 100 равных отрезков - градусов. Для измерения температуры тела термометр приводят в контакт с ним, но температура тела может быть намного ниже, чем температура тающего льда, то есть, она будет иною, если ее измерять по заданной шкале, названной в честь итальянского ученого Цельсия. У середине ХІХ столетия лорд Кельвин предложил точку 0°С температурной шкалы Цельсия заменить на 273,15 кельвина. Такую шкалу называют абсолютной температурной шкалой .
|
|
|
В единицах этой шкалы - "кельвинах" - и измеряют температуру в системе СИ. Переход от шкалы Цельсия к абсолютной температурной шкале такой: T(K) = (t °C + 273,15) K, но 1°С = 1К. Градирование этой шкалы выполняется за точку 0 К и 273,16 К. Температура 273,16 К - тройная точка води. Это температура, при которой вода находится одновременно у трех агрегатных состояниях.
Основное уравнение молекулярно – кинетической теории газа.
Основное уравнение молекулярно – кинетической теории газа (уравнение Клаузиуса )связь микропараметров ( m , n , 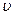 ) и макропараметров ( p , V , T ):
) и макропараметров ( p , V , T ):
 ,
,
где 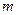 - масса молекулы,
- масса молекулы,
|
|
|
 - концентрация молекул,
- концентрация молекул,
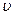 - средняя квадратичная скорость движения молекул.
- средняя квадратичная скорость движения молекул.
Если 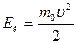 - средняя кинетическая энергия поступательного движения молекул, то основное уравнение молекулярно – кинетической теории газа( МКТ ) можна записать в виде:
- средняя кинетическая энергия поступательного движения молекул, то основное уравнение молекулярно – кинетической теории газа( МКТ ) можна записать в виде:
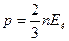 .
.
В молекулярно – кинетической теории температура – это величина, обусловленная средней кинетической энергией частиц, с которых состоит система:
 - для одноатомных молекул, (1)
- для одноатомных молекул, (1)
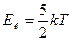 - для двухатомных молекул
- для двухатомных молекул
k = 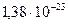 Дж/К - постоянная Больцмана, согласующая температуру в энергетических единицах с температурой в кельвинах (Т) .
Дж/К - постоянная Больцмана, согласующая температуру в энергетических единицах с температурой в кельвинах (Т) .
С формулы (1) следует, что абсолютным нулем температуры есть температура, при которой средняя кинетическая энергия поступательного движения молекул равна нулю. Это значит, что при абсолютном нуле прекращается любое движение молекул? Но доказано, что даже при абсолютном нуле молекулярное движение не прекращается – молекулы совершают колебательные движения. Однако ни при каком эксперименте дыбится абсолютного нуля температур невозможно. Тем более невозможно достичь температуры, ниже абсолютного нуля.
Основное уравнение МКТ, выражает зависимость давления газа (р) от концентрации молекул (n) и температуры (Т):
|
|
|
 .
.
Закон Авогадро: в равных объемах газов при одинаковых температурах и давлениях содержится одинаковое количество молекул :
 ,
, 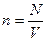 , тогда,
, тогда, 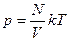
Концентрация ( n ) равна числу частиц в единице объема:
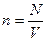 , [ n ] = м
, [ n ] = м  .
.
Уравнение состояния идеального газа. Уравнение Менделеева - Клапейрона.
Для объяснения тепловых явлений используют два подходах: термодинамический и молекулярно-кинетический.
Термодинамический подход основывается на понятии термодинамической системы, которую следует понимать как макроскопическое тело или их совокупность. Например, в цилиндре под поршнем находится газ, то есть имеем термодинамическую систему «цилиндр-газ», в посуду с водой кинули кусок льда- имеем термодинамическую систему «лед-вода».
Чтобы описать состояние термодинамической системы, надо связать с такими физическими величинами, как масса, объем, плотность, давление, температура т.д.. Эти физические величины характеризуют тело независимо от его молекулярного строения. Их называют макропараметрами термодинамической системы.
Температура - один з основных макропараметров термодинамической системы, характеризующий состояние ее теплового равновесия. В результате теплообмена между телами наступает состояние равновесия, когда температура всех тел, составляющих эту систему, становится одинаковой и теплообмен между ними прекращается. Например, возьмем термодинамическую систему «лед-вода». Она как тело, которое имеет боле высокую температуру, отдает тепло льду, лед плавится, и со временем эта система будет находиться в тепловом равновесии, то есть будет иметь воду одинаковой температуры.
Параметры состояния 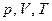 не зависят: один от другого один из них можно выразить через два других, например,
не зависят: один от другого один из них можно выразить через два других, например, 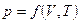 . Уравнение, связывающее между собой параметры состояния системы, называется уравнением системы. Уравнение состояния идеального газа связывает между собой параметры состояния газа
. Уравнение, связывающее между собой параметры состояния системы, называется уравнением системы. Уравнение состояния идеального газа связывает между собой параметры состояния газа 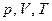 :
:

 – концентрация молекул.
– концентрация молекул.
Общее количество молекул:
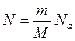 , тогда подставим в уравнение идеального газа, получим
, тогда подставим в уравнение идеального газа, получим
 (1)
(1)
Произведение 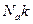 обозначим буквой
обозначим буквой  , называемой газовой постоянной:
, называемой газовой постоянной:
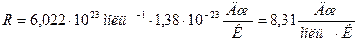 .
.
уравнение (1) имеет вид :
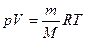 (2),
(2),
где 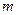 - масса газа;
- масса газа; 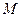 - его молярная масса.
- его молярная масса.
Уравнение (2) – это уравнение Менделеева-Клапейронадля идеальных газов, описывающее состояние одного газа. В некоторых задачах приходится иметь дело с смесью химических газов, которые не вступают между собой в реакцию. Давление, оказываемое только одним компонентом смеси газов, называется еепарциальнымдавлением. Для смеси газов выполняется закон Дальтона: давление смеси газов равно сумме парциальных давлений всех компонентов газа.
Уравнение состояния для смеси идеальных газов будет иметь вид: 
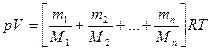 .
.
Дата добавления: 2020-11-29; просмотров: 68; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
