Влияние концентрации на положение химического равновесия
Равновесие сдвигается вправо, если увеличились равновесные концентрации исходных веществ и – влево, если увеличиваются концентрации продуктов реакции.
BiCl3+H2O  BiOCl + 2HCl
BiOCl + 2HCl
оксихлорид висмута
По приципу Ле Шателье добавление воды в равновесную систему вызовет усиление его расходования и смещение системы вправо, а при увеличении концентрации кислоты – влево.
Влияние температуры на положение химического равновесия
При повышении температуры возрастают скорости как прямой, так и обратной реакции, но быстрее возрастает скорость эндотермического процесса, т. е. процесса, идущего с поглощением тепла. Для этого процесса константа скорости находится в более сильной зависимости от температуры. Следовательно, равновесие сдвигается в сторону эндотермического процесса.
3H2+N2  2NH3 DH = –92 кДж/моль
2NH3 DH = –92 кДж/моль
Данная реакция экзотермическая. От системы нужно отводить тепло, чтобы реакция шла в прямом направлении с образованием аммиака.
Влияние давления на положение химического равновесия
Если в обратимой реакции участвует хотя бы одно газообразное вещество, смещение равновесия может быть вызвано изменением давления.
Повышение давления при неизменной температуре равносильно сжатию газа, т. е. увеличению его расходования. Равновесие при этом смещается в сторону уменьшения концентрации газа. Так, при увеличении давления в системе
|
|
|
СаСО3 (к)  СаО(к) + СО2(г)
СаО(к) + СО2(г)
возрастает скорость обратной реакции 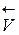 =
= 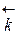 [СО2], что приведет к смещению равновесия влево. При понижении давления в той же системе скорость обратной реакции уменьшается, и равновесие смещается вправо.
[СО2], что приведет к смещению равновесия влево. При понижении давления в той же системе скорость обратной реакции уменьшается, и равновесие смещается вправо.
При увеличении давления равновесие смещается в сторону реакции с уменьшением объема системы. Давление влияет на изменение объема и на концентрации веществ.
При участии в реакции нескольких газообразных веществ изменение давления может и не привести к сдвигу равновесия, как, например, в системе
2HCl  H2 +Cl2 (Здесь все вещества в газообразном состоянии).
H2 +Cl2 (Здесь все вещества в газообразном состоянии).
При изменении давления в одинаковой степени изменятся скорости обоих разнонаправленных процессов и общие числа молей газов исходных веществ и продуктов реакций будут одинаковы.
Катализатор не влияет на смещение химического равновесия, т.к. катализатор в равной мере ускоряет и прямой и обратный процессы. Он ускоряет только достижение химического равновесия.
Пример. В каком направлении должно смещаться равновесие реакции
N2O4(г)  2NO2(г), DHо > 0
2NO2(г), DHо > 0
При
а) добавлении N2O4;
б) удалении NO2;
в) повышении давления;
г) увеличении объема;
д) понижении температуры.
|
|
|
Решение. Воспользуемся принципом Ле Шателье:
а) при добавлении N2O4 концентрация этого вещества в системе должна уменьшаться, следовательно, равновесие сместится в сторону образования большего количества продуктов (в правую сторону уравнения);
б) при удалении NO2 в системе образуется дополнительное количество NO2 в сторону образования продуктов (вправо);
в) системе установится новое равновесие, соответствующее меньшему объему (с меньшим числом молекул газа), следовательно, равновесие должно сместиться влево;
г) равновесие в системе сместится в сторону возрастания объема системы (повышение числа молекул газа), т.е. вправо;
д) система ответит на понижение температуры смещением равновесия в сторону увеличения выделения тепла, т. е. влево, так как реакция является эндотермической в прямом направлении.
Дата добавления: 2020-11-27; просмотров: 57; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
