Зависимость скорости реакции от температуры
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа, который экспериментально установил, что
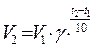 |
При повышении температуры на каждые 10 оС скорость реакции увеличивается примерно в 2 – 4 раза
где V1 и V2 скорость реакции при температуре t1 и t2 (t2 > t1), g – температурный коэффициент скорости реакции.
Пример. Во сколько раз увеличится скорость химической реакции, при повышении температуры от 10 до 40 оС, если g = 3
Решение.
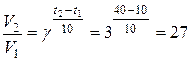
Скорость химической реакции увеличится в 27 раз.
Теория активации Аррениуса
Большинство соударений молекул не приводит к химическому взаимодействию – c толкнувшись, они разлетаются в разные стороны, как упругие шары. Для осуществления элементарного акта реакции необходимо, чтобы электронные оболочки атомов реагентов при соударении вторгались одна в другую, преодолевая взаимное отталкивание. Это вызовет разрыв старых связей и возникновение новых. Но для этого нужно затратить энергию. Поэтому в реакцию вступают не все молекулы, а лишь те, которые могут преодолеть энергетический барьер отталкивания и войти в химический контакт друг с другом. Такие молекулы являются активными, а избыточная энергия, которой они обладают по сравнению с молекулами, имеющими средний запас энергии, является энергией активации Еакт. С увеличением температуры растет число активных молекул и следовательно, возрастает скорость химической реакции.
|
|
|
При столкновении частиц образуется группировка в состоянии перераспределения связей, которая называется активированным комплексом.
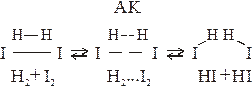
Переход системы из исходного состояния в конечное через активированный комплекс показан на рисунке.
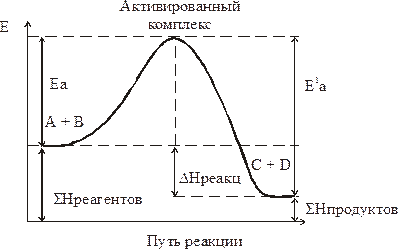
Е1а – энергия активации обратимой реакции
Е1а – Еа = DН, где DН – тепловой эффект реакции
Еакт энергией активации характеризует высоту энергетического барьера, преодолев который молекулы подвергаются химическим превращениям:
А + В = AB.
Активация молекул возможна при нагревании  или растворении вещества, при различных облучениях.
или растворении вещества, при различных облучениях.
Зависимость константы скорости реакции от энергии активации и температуры выражается формулой Аррениуса:

где А – постоянный множитель, не зависящий от температуры, Еакт – энергия активации, R – универсальная газовая постоянная.
Энергия активизации равна разности между средней энергией реагентов и энергией активированного комплекса.
Энергия активизации определяет влияние на скорость реакции природы реагентов.
Влияние катализатора
Катализ – это явление изменения скорости реакции в присутствии катализаторов, веществ изменяющих пути протекания реакций в циклах промежуточного взаимодействия с реагентами и восстанавливающих в итоге свой состав.
|
|
|
Катализаторы бывают положительные и отрицательные.
Положительные катализаторы (платина, оксид марганца (IV)) ускоряют реакцию в несколько раз.
MnO2
2H2O2 ® 2H2O + O2
Отрицательные катализаторы – ингибиторы, наоборот замеляют скорость химической реакции (пример использование ингибиторов для борьбы с коррозией нефтепроводов)
Различают гомогенный и гетерогенный катализ.
Если катализатор и реагенты находятся в одной фазе и процесс протекает в объеме, то это гомогенный катализ.
Если катализатор и реагенты находятся в разных фазах и процесс протекает на поверхности их раздела, то это гетерогенный катализ.
Механизм действия катализаторов объясняется образованием промежуточных соединений и заключается в снижении энергии активации при образовании активированного комплекса.

Для реакции А + B ® AB
A + К ® AК
A К + B ® AB + К
А + B ® AB
Катализатор ускоряет реакцию, хотя и не входит в ее продукты. Химическое состояние катализатора и его количество после реакции остается неизменным.
Механизм химических реакций
Реакции можно классифицировать по механизму их протекания. Они делятся на:
|
|
|
– простые (молекулярные) реакции, протекающие непосредственно между молекулами.
Молекулярность реакции определяется числом молекул, участвующих в элементарном акте превращения. Бывают реакции одномолекулярные, двухмолекулярные и трехмолекулярные:
одномолекулярная (мономолекулярная) СаСО3 ® СаО + СО2
двухмолекулярная (бимолекулярная) 2HI ® H2 + I2
трехмолекулярная (тримолекулярная) 2NO + H2 ® NO2 + H2O
Еакт энергия активации таких реакций составляет 120 – 440 кДж/моль
– ионные реакции, протекающие при растворении веществ.
Cl– + Ag+ = AgCl¯ Еакт = 0 – 80 кДж/моль
– радикальные (цепные) реакции с участием свободных радикалов имеющих ненасыщенные валентности.
H2 + Сl2 ® 2HCl
Обычное уравнение реакции не отражает истинный механизм данной реакции. Галогены уже при температуре 20 оС на свету образуют радикалы (ион, содержащий один неспаренный электрон)
hn
Сl2 ® 2Cl· радикал реагирует с водородом
hn
H2 + Сl· ® HCl + H·
hn
Сl2 + H· ® HCl + Cl· 1 квант света вызывает образование 100 тыс. молекул HCl
Реакция носит цепной характер, закон действия масс не соблюдается, т.к. энергия активации радикала и энергия активации взаимодействия радикала с водородом исключительно мала.
|
|
|
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Все химические реакции делятся на необратимые и обратимые.
Необратимые реакции протекают до конца (в одном направлении).
BaCl2 + H2SO4 ® BaSO4¯ + 2HCl
Признаки необратимых реакций:
1. выпадение осадка или образование газа;
2. образование малодиссоциирующих продуктов;
3. выделение большого количества энергии.
Обратимые реакции протекают в прямом и обратном направлениях.
СО2+Н2О  СО2+Н2
СО2+Н2
3H2+N2  2NH3
2NH3
Реакцию, протекающую в правую сторону (®), называют прямой, а в левую () – обратной.
С течением времени скорость прямой реакции уменьшается, и через некоторый промежуток времени наступает химическое равновесие, когда скорости прямой и обратной реакции равны.
Для реакции общего вида
аА + вВ  сС + dD,
сС + dD,
где А и В – исходные вещества, а и в – стехиометрические коэффициенты скорости прямой и обратной реакции по закону действующих масс будут равны
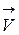 =
= 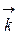 [A]a [B]b и
[A]a [B]b и 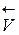 =
= 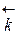 [C]c [D]d
[C]c [D]d
В условиях равновесия 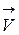 =
= 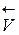 и
и 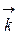 [A]a [B]b =
[A]a [B]b = 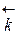 [C]c [D]d
[C]c [D]d
Преобразуем равенство в 
Величина Кр называется константой равновесия. Константа равновесия зависит только от температуры, и не зависит от концентрации реагирующих веществ. Присутствие катализатора тоже не влияет на нее.
Химическое равновесие, т.е. равенство скоростей прямой и обратной реакций, сохраняется до тех пор, пока сохраняются условия равновесия. При изменении условий, например температуры, или давления, или концентрации веществ, изменяются скорости прямой и обратной реакций, что ведет к нарушению равновесия и смещению (сдвигу) его в правую или левую сторону.
Направление смещения равновесия определяется принципом Ле Шателье:
если на систему, находящуюся в равновесии, оказывать внешнее воздействие, то состояние равновесия смещается в том направлении, которое ослабляет влияние этого воздействия (или в системе усиливаются процессы, направленные на компенсацию внешнего воздействия).
На сдвиг равновесия могут влиять температура, концентрации реагентов и давление.
2. Факторы, влияющие на положение химического равновесия – температура, концентрация, давление.
Дата добавления: 2020-11-27; просмотров: 44; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
