Тема: «Растворение глицерина в воде и взаимодействие с гидроксидом меди(II)»
Цель: исследовать свойства глицерина
Оборудование: штатив с пробирками (3 шт.), глицерина, вода, гидроксид натрия, раствор сульфат меди (II).
Задание на лабораторную работу:
по ссылке опыты:https://www.youtube.com/watch?v=Ie4fAS5bPAs
Опыт № 1. Растворение глицерина в воде.
Налейте в пробирку 1-2 мл глицерина, добавьте столько же воды и встряхните. Затем добавьте в 2-3 раза больше воды.
Задание для самостоятельных выводов:
1) Какова растворимость глицерина в воде?
Опыт № 2. Взаимодействие глицерина с гидроксидом меди (II).
В пробирку налейте 1 мл раствора гидроксида натрия и добавьте немного раствора сульфата меди (II) до выпадения осадка. К осадку прилейте глицерин и взболтайте.
Задание для самостоятельных выводов:
1) Какая реакция характерна для глицерина и других многоатомных спиртов? Напишите уравнения соответствующих реакций.
2) Какие вещества называются спиртами?
3) Дайте названия органическим соединениям по международной номенклатуре:
а) СН3 – СН – СН – СН2 – СН3
ОН СН3
б) СН3 – СН2 – СН – СН – СН2 –СН2ОН
СН3 СН3
4) Какой объѐм углекислого газа выделяется при сгорании 40 г этанола?
Сделать выводпо работе:
ДОМАШНЕЕ ЗАДАНИЕ
Ответьте на вопросы (письменно):
1. Какие вещества называют многоатомными спиртами?
2. Как называется двух-, трехатомный спирт, с которыми мы познакомились сегодня?
3. Для каких целей применяют этиленгликоль и глицерин?
|
|
|
4. Какие химические свойства многоатомных спиртов сходны с одноатомными спиртами?
5. С помощью какой качественной реакции можно отличить глицерин от этанола?
6. §21, з.8 и тесты, с.104 (учебник Рудзитис Г.Е., Фельдман Ф.Г.).

УРОК № 24
Тема: Фенол
Смотреть по ссылке: https://www.youtube.com/watch?v=pybD-rGCbUc
Это вещество было открыто в 1771 году. Сразу после открытия его стали использовать в качестве красителя. Текстильщики красили им свои ткани. В 1834 году немецкий химик Фридлиб Рунге обнаружил в продуктах перегонки каменноугольной смолы белое кристаллическое вещество с характерным запахом, но ему не удалось определить его состав. И только в 1841 году Огюст Лоран установил его формулу.
Фенолы – производные ароматических углеводородов, в молекулах которых гидроксильные группы непосредственно связаны с атомами углерода бензольного кольца. Функциональная группа, как и у спиртов, — OH.
Как вода и спирты молекула этого вещества имеет гидроксогруппу.Как бензол она имеет ароматическое кольцо.
Подобно метильной группе в толуоле, гидроксогруппа взаимодействует с электронами ароматического кольца. За счёт взаимодействия р-орбитали атома кислорода и π-электронной системой бензольного кольца неподелённая электронная пара атома кислорода вовлекается в ароматическое сопряжение и увеличивает электронную плотность в кольце. Кроме того, влияние гидроксогруппы на бензольное кольцо выражается в перераспределении электронной плотности в орто- и пара-положениях. В свою очередь, радикал фенил обедняет атом кислорода электронной плотностью, увеличивая полярность связи
|
|
|
О-Н и кислотность фенола по сравнению со спиртами.
Физические свойства
Фенол – твердое бесцветное кристаллическое вещество, низкоплавкое, очень гигроскопичное, с характерным запахом. На воздухе фенол окисляется, поэтому его кристаллы приобретают вначале розоватый оттенок, а при длительном хранении темнеют и становятся более красными. Он малорастворим в воде при комнатной температуре, но быстро и хорошо растворяется при 60 – 70oС. Фенол легкоплавок, его температура плавления 43oС. Ядовит.
Получение
В промышленных масштабах фенол получают из каменноугольной смолы. Среди лабораторных методов наиболее часто использую следующие:
— гидролиз хлорбензола
C6H5Cl + NaOH→C6H5OH + NaCl (kat = Cu, t0).
— щелочное плавление солей аренсульфоновых кислот
|
|
|
C6H5SO3Na + 2NaOH→C6H5OH + Na2SO3 + H2O (t0).
— кумольный метод (окисление изопропилбензола)
C6H5-C (CH3) H - CH3 + O2 → C6H5OH + CH3 - C(O) - CH3 (H+, t0).
Химические свойства
Обусловленны наличием О – Н группы
Кислотные свойства
2С2Н5ОН + 2Na → 2С2Н5ONa + Н2 2С6Н5ОН + 2Na→ 2С6Н5ОNа + Н2
2С2Н5ОН + NаОН ↛ С6Н5ОН + NaОH → C6Н5Ona + Н2O
Основные свойства
Н2SO4
С2Н5ОН + HС1→ С2Н5С1 + Н20 С2Н5ОН + НС1↛
Реакции окисления


Качественные реакции на одноатомные спирты, многоатомные спирты и фенол.
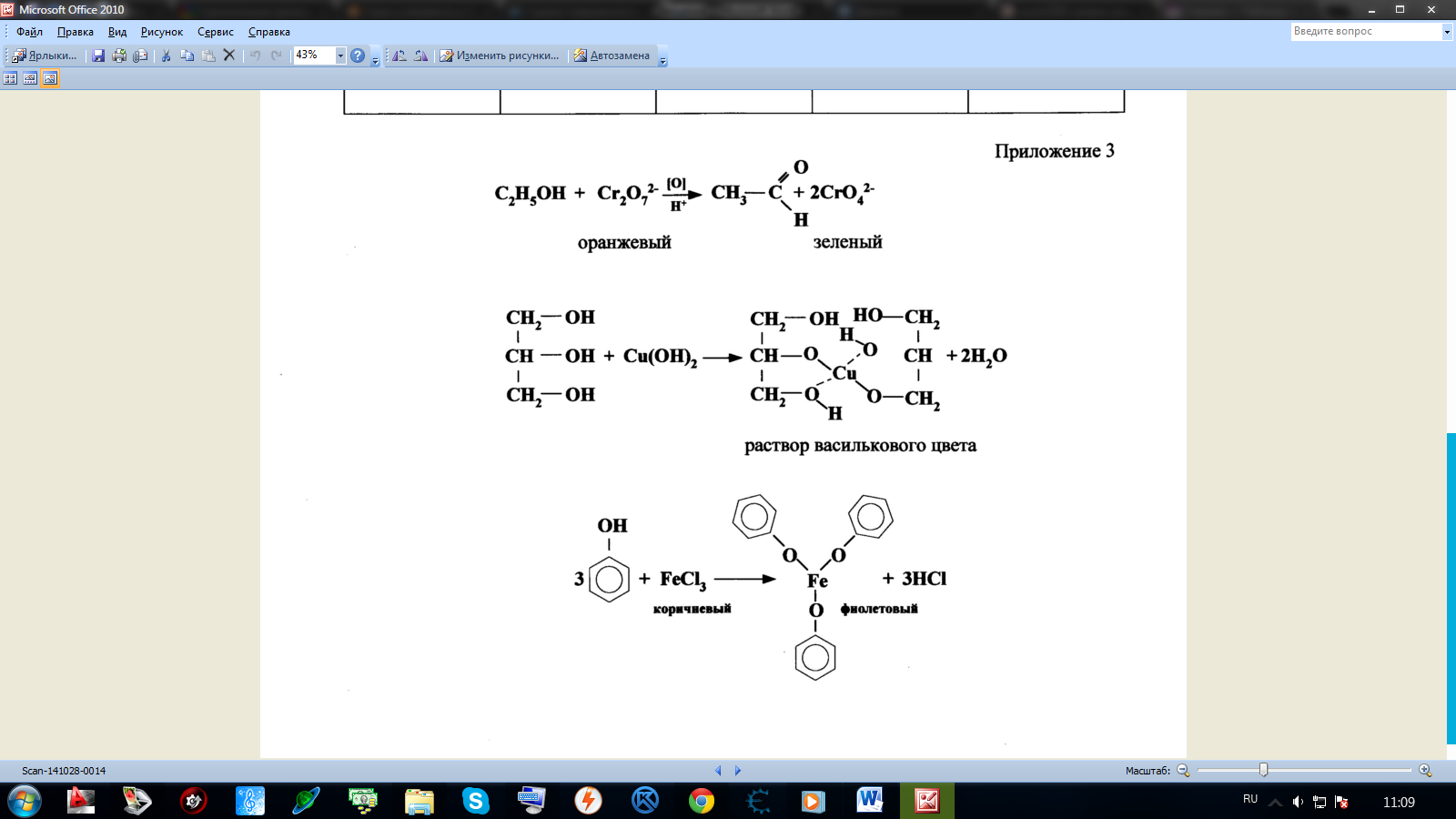
ДОМАШНЕЕ ЗАДАНИЕ
Ответьте на вопросы (письменно):
1) §22, з.5, 9 и тесты, с.109-110 (учебник Рудзитис Г.Е., Фельдман Ф.Г.).

2) Укажите основной продукт А, полученный в результате цепочки превращений:
+ H2 H2O [O]
CH3 – CH3  X1
X1  X2 → A
X2 → A
УРОК № 25
Тема: Альдегиды
Смотреть по ссылке: https://www.youtube.com/watch?v=dBACq2zqcr8
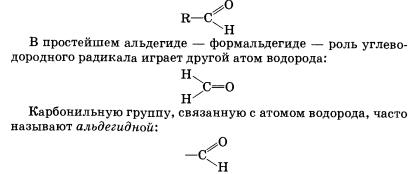
Альдегиды — органические вещества, молекулы которых содержат карбонильную группу
|
|
|
С=О, соединенную с атомом водорода и углеводородным радикалом.
Общая формула для альдегидов и кетонов – СnH2nO
Общая формула альдегидов имеет вид
Органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами, называют кетонами.
Очевидно, общая формула кетонов имеет вид:
O
║ Карбонильную группу кетонов называют кетогруппой.
R1— C — R2 В простейшем кетоне — ацетоне — карбонильная группа связана с двумя метильными радикалами:
O
║
СН3 — С — СН3 CH3—CO—CH3 пропанон (ацетон)
CH3—CO—CH2CH3 бутанон (метилэтилкетон)
Номенклатура альдегидов
Международная (систематическая, заместительная).
а) Названия образуются от названия, соответствующего алкана с таким же числом атомов углерода с добавлением суффикса – аль.
1. HCHO метаналь (формальдегид, муравьиный альдегид)
2. CH3CHO этаналь (ацетальдегид, уксусный альдегид)
3. CH3CH2CHO пропаналь (пропионовый альдегид)
4. CH3CH2CH2CHO бутаналь (масляный альдегид)
б) Нумерацию самой длинной цепи начинают от атома углерода альдегидной группы. в) Перед названием указывают положения и названия заместителей в цепи.
O
3 2 1 ⁄⁄
Например: CH3- CH- C – H 2- метилпропаналь.
|
CH3
1. Тривиальная (историческая). Названия происходят от названий соответствующих органических кислот, в которые они превращаются при окислении.
O
⁄⁄
1. H – C – H - муравьиный альдегид (формальдегид).
O
⁄⁄
2. CH3 – C – H - уксусный альдегид (ацетальдегид).
Изомерия альдегидов.
В пределах класса альдегидов возможен только один вид изомерии – изомерия углеродного скелета (углеродной цепи). Межклассовыми изомерами альдегидов являются кетоны.
Физические свойства
Между молекулами у альдегидов не возникают водородные связи, метаналь – газ (далее жидкости, высшие альдегиды – твердые C2 – C11 - жидкости С12 - … - твердые вещества).
Температура кипения у альдегидов ниже, чем у спиртов. Низшие альдегиды хорошо растворяются в воде, так как образуются водородные связи между «Н» воды и «О» альдегида.
Способы получения:
Лабораторный способ:
1. Окисление спиртов.
Первичных
CH3OH + CuO 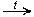 HCHO + Cu + H2O
HCHO + Cu + H2O
Вторичных
CH3—CH(OH)—CH3 + [O] 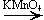 CH3—CO—CH3 + H2O
CH3—CO—CH3 + H2O
2. Дегидрирование спиртов (отщепление водорода)
Первичных
CH3CH2OH 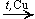 CH3CHO + H2
CH3CHO + H2
Вторичных
CH3—CH(OH)—CH3 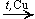 CH3—CO—CH3 + H2
CH3—CO—CH3 + H2
3. Гидролиз дигалогенпроизводных
CH3CHCl2 + 2NaOH = CH3COH + NaCl + H2O
Промышленность:
1. Окисление метана.
2. Окисление этилена.
3. Гидратация ацетилена (реакция Кучерова)
C2H2 + H2O 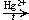 CH3CHO
CH3CHO
Дата добавления: 2020-11-23; просмотров: 376; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
