Электроотрицательность – это способность атомов элемента притягивать к себе электроны, связывающие их с другими атомами .
На прошлом уроке вы познакомились с одним из способов
завершения последнего электронного слоя атомами химических
элементов путем либо отдачи, либо приема недостающих электронов
внешнего энергетического уровня. Выяснили, что ионная связь
существует в молекулах сложных веществ, образованных ионами
типичных металлов и типичных неметаллов.
А как же образуются молекулы простых веществ. Как
взаимодействуют атомы элементов-неметаллов?
Рассмотрим образование молекулы водорода, состоящей
из двух атомов
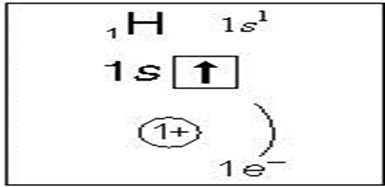
в атоме водорода 1 электрон на внешнем
энергетическом уровне и до завершения ему также не хватает 1
электрона
Обозначим электронами точками
Ссылка
Н. + . Н →
Что могут сделать атомы, чтобы их электронных слой
содержал бы два электрона? Что произойдет? Электроны
сблизятся. А если они сблизятся, то образуют общую
электронную пару
В данном случае оба атома завершают свой энергетический
уровень. Точнее электронные облака, притягиваются
ядрами атомов и, сближаясь, перекрываются в
определенной области, одинаково принадлежащей и
первому и второму атому водорода.
Пример
Связь атомов с помощью общих электронных пар
Называется ковалентной.
Заменив общую электронную пару чертой, мы получим
|
|
|
структурную формулу водорода.
Н – Н
Рассмотрим процесс образования молекулы
фтора и молекулы азота
. . . . . . . .
: F . + . F : = :F : F :
. . . . . . ..
Структурная формула F – F.
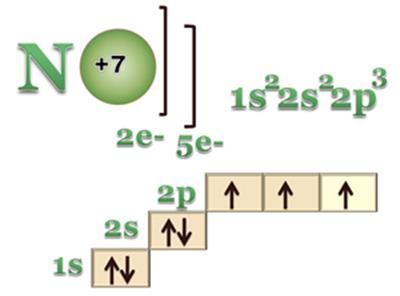

Структурная формула N Ξ N
Если атомы связаны одной общей электронной парой, то такую ковалентную связь называют одинарной, двумя – двойной, тремя – тройной. Как вы считаете, какая молекула прочнее, фтора или азота?
Чем больше общих электронных пар у атомов в молекуле, тем прочнее связаны атомы друг с другом и тем меньше расстояние между ними.
В молекуле фтора расстояние между атомами равно 1,42 нм (1нм = 10-9м), а в молекуле азота связь тройная и расстояние между атомами азота составляет 0,11нм. Чтобы разделить молекулу азота на отдельные на отдельные атомы необходимо затратить в 7 раз больше энергии, чем разорвать одинарную связь связь в молекуле фтора.
При взаимодействии двух атомов одного и того же элемента-неметалла между ними образуется ковалентная химическая связь с помощью общих электронных пар. Эту ковалентную связь называют НЕПОЛЯРНОЙ, так как общие электронные пары принадлежат обоим атомам в одинаковой степени.
|
|
|
Алгоритм составления схемы образования ковалентной неполярной химической связи
· Запишите формулу химического соединения.
· Укажите номер группы и определите число электронов внешнего уровня.
· Определите число неспаренных электронов.
· Запишите электронную формулу строения атома, приняв электрон за точку.
· Запишите оба химических элемента через знак + таким образом, чтобы они были обращены друг к другу непарными электронами.
· Запишите формулу образовавшегося соединения, взяв в скобку общую электронную пару.
Дополнительные материалы
· Проверь себя
Контрольно-тренировочные материалы
· Химическая связь
При рассмотрении механизма образования ковалентной связи вы обратили внимание на то, что она может образовываться как между атомами одного элемента, так и между атомами разных элементов.
Если молекула образована атомами одного элемента, то общая электронная пара в равной степени принадлежит обоим атомам. Такую ковалентную связь называют неполярной.
Если же молекула состоит из атомов различных элементов, то общая электронная пара обычно смещена в сторону одного из них, а именно в сторону того атома, которая обладает более выраженными неметаллическими свойствами.
|
|
|
Атомы разных элементов по-разному относятся к общим электронным парам: те неметаллы, что сильнее, будут сильнее оттягивать к себе общие электронные пары
Например, в молекуле HCl общая электронная пара смещена к атому хлора. Такую ковалентную связь называют полярной.
Для качественной характеристики полярной связи ввели понятие электроотрицательности атомов элемента.
Электроотрицательность – это способность атомов элемента притягивать к себе электроны, связывающие их с другими атомами .
Посмотрите на данный слайд. На нем расположен ряд электроотрицательности элементов в порядке возрастания.

Значит, самым электроотрицательным элементом будетФТОР.
Ответьте на вопрос:
Какой из элементов будет более электроотрицательным – УГЛЕРОД или АЗОТ?
В данной паре АЗОТ, т.к. он располагается правее УГЛЕРОДА и ближе к самому электроотрицательному элементу – ФТОРУ.
Дата добавления: 2020-11-23; просмотров: 216; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
