Молекулярная физика. Термодинамика
Основные формулы
Количество вещества тела (системы)
n = N/ NA,
где N - число структурных элементов (молекул, атомов, ионов и т.п.), составляющих тело (систему); NА - постоянная Авогадро
(NА = 6,02×1023моль-1).
Молярная масса вещества
M = m/ n,
где m - масса однородного тела (системы); n - количество вещества этого тела.
Относительная молекулярная масса вещества
Mr = S niAr, i ,
где ni - число атомов i-го химического элемента, входящих в состав молекулы данного вещества; Ar, i - относительная масса этого элемента. Относительные атомные массы приводятся в таблице Д.И.Менделева.
Связь молекулярной массы М с относительной молекулярной массой вещества
M = Mrk,
где k = 10-3 кг/моль.
Количество вещества смеси газов
n = n1 + n2 + … + n n = N1/ NA + N2/ NA + … + Nn/NA,
или
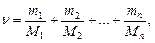
где n i, Ni, mi, Mi - соответственно количество вещества, число молекул, масса, молекулярная масса i-го компонента смеси.
Уравнение Менделеева-Клайперона (уравнение состояния идеального газа)
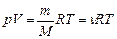
где m - масса газа, М - молекулярная масса газа, R - молекулярная газовая постоянная, n - количество вещества, Т - термодинамическая температура.
Опытные газовые законы, являющиеся частными случаями уравнения Менделеева-Клайперона для изопроцессов:
а) закон Бойля-Мариотта (изотермический процесс: T=const, m=const)
pV = const,
или для двух состояний газа
p1 V1 = p2 V2;
б) закон Гей-Люссака (изобарный процесс: p=const, m=const)
|
|
|

или для двух состояний
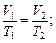
в) закон Шарля (изохорный процесс: V=const, m=const)
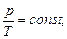
или для двух состояний

г) объединенный газовый закон (m=const)
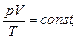 или
или 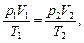
где p1, V1, T1 - давление, объем и температура газа в начальном состоянии; p2, V2, T2 - те же величины в конечном состоянии.
Закон Дальтона, определяющий давление смеси газов,
р = р1 + р2 + … + р n
где pi - парциальные давления компонентов смеси; n - число компонентов смеси.
Парциальным давлением называется давление газа, которое производил бы этот газ, если бы только он один находился в сосуде, занятом смесью.
Молекулярная масса смеси газов
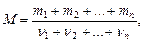
где mi - масса i-го компонента смеси; n i = mi/ Mi - количество вещества i-го компонента смеси; n - число компонентов смеси.
Массовая доля i-го компонента смеси газа (в долях единицы или процентах)
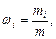
где m - масса смеси.
Концентрация молекул
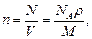
где N - число молекул, содержащихся в данной системе; r - плотность вещества; V - объем системы. Формула справедлива не только для газов, но и для любого агрегатного состояния вещества.
Основное уравнение кинетической теории газов
|
|
|
p = 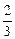 n á eп ñ,
n á eп ñ,
где á eп ñ - средняя кинетическая энергия поступательного движения молекулы.
Средняя кинетическая энергия поступательного движения молекулы
á eп ñ = 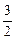 kT,
kT,
где k - постоянная Больцмана.
Средняя полная кинетическая энергия молекулы
á ei ñ = 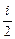 kT,
kT,
где i - число степеней свободы молекулы.
Зависимость давления газа от концентрации молекул и температуры
p = nkT.
Скорости молекул:
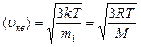 - средняя квадратичная;
- средняя квадратичная;
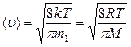 - средняя арифметическая;
- средняя арифметическая;
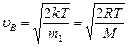 - наиболее вероятная,
- наиболее вероятная,
где mi - масса одной молекулы.
Относительная скорость молекулы
u = u/ u B,
где u - скорость данной молекулы.
Удельные теплоемкости газа при постоянном объеме (с v) и постоянном давлении (cp)

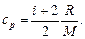
Связь между удельной с и молекулярной С теплоемкостями
с = С/М, С = сМ.
Уравнение Майера
С p – Cv = R
Внутренняя энергия идеального газа
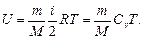
Первое начало термодинамики

где Q - теплота, сообщенная системе (газу); D U - изменение внутренней энергии системы; А - работа, совершенная системой против внешних сил.
Работа расширения газа:
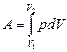 в общем случае;
в общем случае;
A = p( V2- V1) при изобарном процессе;
|
|
|
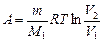 при изотермическом процессе;
при изотермическом процессе;
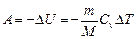 , или
, или 
при адиабатном процессе, где g = с p/ cv - показатель адиабаты.
Уравнения Пуассона, связывающие параметры идеального газа при адиабатном процессе:


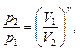
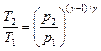
Термический КПД цикла
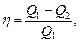
где Q1 - теплота, полученная рабочим телом от теплоотдатчика; Q2 - теплота, переданная рабочим телом теплоприемнику.
Термический КПД цикла Карно
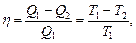
где T1 и T2 - термодинамические температуры теплоотдатчика и теплоприемника.
Коэффициент поверхностного натяжения
 или
или 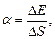
где F - сила поверхностного натяжения, действующая на контур l, ограничивающий поверхность жидкости; DЕ - изменение свободной энергии поверхностной пленки жидкости, связанное с изменением площади D S поверхности этой пленки.
Формула Лапласа, выражающая давление р, создаваемое сферической поверхностью жидкости:
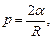
где R - радиус сферической поверхности.
Высота подъема жидкости в капиллярной трубке
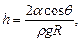
где q - краевой угол (q = 0 при полном смачивании стенок трубки жидкостью; q = p при полном несмачивании); R - радиус канала трубки; r - плотность жидкости; g - ускорение свободного падения.
Высота подъема жидкости между двумя близкими параллельными друг другу плоскостями
|
|
|

где d - расстояние между плоскостями.
Примеры решения задач
Пример 1. Определить молярную массу М смеси кислорода массой  г и азота массой
г и азота массой  г.
г.
Решение. Молярная масса смеси М есть отношение массы смеси m к количеству вещества смеси 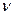 :
:
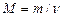 . (1)
. (1)
Масса смеси равна сумме масс компонентов смеси:
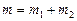 .
.
Количество вещества смеси равно сумме количеств вещества компонентов:
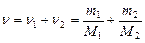 .
.
Подставив в формулу (1) выражения 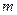 и
и 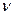 , получим
, получим
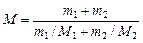 . (2)
. (2)
Найдем молярные массы кислорода 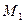 и азота
и азота 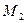 :
:
 кг/моль;
кг/моль;  кг/моль.
кг/моль.
Подставим значения величин в (2) и произведем вычисления:
 кг/моль =
кг/моль =
= 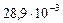 кг/моль.
кг/моль.
Пример 2. Найти среднюю кинетическую энергию 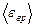 вращательного движения одной молекулы кислорода при температуре
вращательного движения одной молекулы кислорода при температуре 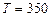 К, а также кинетическую энергию
К, а также кинетическую энергию 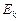 вращательного движения всех молекул кислорода массой
вращательного движения всех молекул кислорода массой 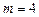 г.
г.
Решение. На каждую степень свободы молекулы газа приходится одинаковая средняя энергия 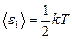 , где k – постоянная Больцмана; T – термодинамическая температура газа. Так как вращательному движению двухатомной молекулы (молекула кислорода – двухатомная) соответствуют две степени свободы, то средняя энергия вращательного движения молекулы кислорода
, где k – постоянная Больцмана; T – термодинамическая температура газа. Так как вращательному движению двухатомной молекулы (молекула кислорода – двухатомная) соответствуют две степени свободы, то средняя энергия вращательного движения молекулы кислорода
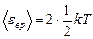 . (1)
. (1)
Кинетическая энергия вращательного движения всех молекул газа
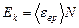 . (2)
. (2)
Число всех молекул газа
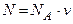 , (3)
, (3)
где 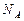 – постоянная Авогадро;
– постоянная Авогадро; 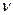 – количество вещества.
– количество вещества.
Если учесть, что количество вещества  , где m – масса газа; М – молярная масса газа, то формула (3) примет вид
, где m – масса газа; М – молярная масса газа, то формула (3) примет вид
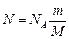 .
.
Подставив выражение N в формулу (2), получаем
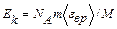 . (4)
. (4)
Произведем вычисления, учитывая, что для кислорода 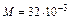 кг/моль:
кг/моль:
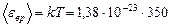 Дж
Дж  Дж;
Дж;
 Дж
Дж 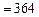 Дж.
Дж.
Пример 3. Вычислить удельные теплоемкости 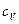 и
и  смеси неона и водорода, если массовые доли неона и водорода составляют
смеси неона и водорода, если массовые доли неона и водорода составляют 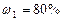 и
и 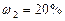 . Значения удельных теплоемкостей газов взять из справочника.
. Значения удельных теплоемкостей газов взять из справочника.
Решение. Удельную теплоемкость 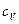 смеси при постоянном объеме найдем следующим образом. Теплоту, необходимую для нагревания смеси на
смеси при постоянном объеме найдем следующим образом. Теплоту, необходимую для нагревания смеси на 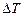 , выразим двумя способами:
, выразим двумя способами:
 , (1)
, (1)
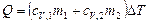 , (2)
, (2)
где  – удельная теплоемкость неона;
– удельная теплоемкость неона;  – удельная теплоемкость водорода.
– удельная теплоемкость водорода.
Приравняв правые части (1) и (2) и разделив обе части полученного равенства на  , получим
, получим 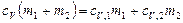 . Отсюда
. Отсюда
 ,
,
или
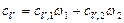 ,
,
где 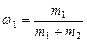 и
и  .
.
Рассуждая так же, получим формулу для вычисления удельной теплоемкости смеси при постоянном давлении:
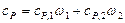 .
.
Произведем вычисления:
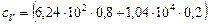
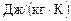 =
=

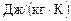
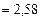
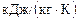 ;
;

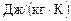 =
=
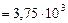
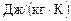

 .
.
Пример 4. Кислород массой  кг занимает объем
кг занимает объем
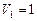
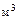 и находится под давлением
и находится под давлением 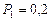 МПа. Газ был нагрет сначала при постоянном давлении до объема
МПа. Газ был нагрет сначала при постоянном давлении до объема 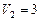 м3, а затем при постоянном объеме до давления
м3, а затем при постоянном объеме до давления  МПа. Найти изменение
МПа. Найти изменение 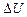 внутренней энергии газа, совершенную им работу А и теплоту Q, переданную газу. Построить график процесса.
внутренней энергии газа, совершенную им работу А и теплоту Q, переданную газу. Построить график процесса.
Решен ие. Изменение внутренней энергии газа
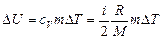 , (1)
, (1)
где i – число степеней свободы молекул газа (для двухатомных молекул кислорода i=5); 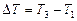 – разность температур газа в конечном (третьем) и начальном состояниях.
– разность температур газа в конечном (третьем) и начальном состояниях.
Начальную и конечную температуру газа найдем из уравнения Менделеева-Клапейрона  , откуда
, откуда
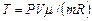 .
.
Работа расширения газа при постоянном давлении выражается формулой
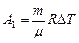 .
.
Работа газа, нагреваемого при постоянном объеме, равна нулю:
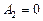 .
.
Следовательно, полная работа, совершаемая газом,
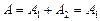 .
.
Согласно первому началу термодинамики, теплота Q, переданная газу, равна сумме изменения внутренней энергии 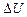 и работы A:
и работы A:
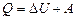 .
.
 Произведем вычисления, учтя, что для кислорода
Произведем вычисления, учтя, что для кислорода
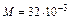 кг/моль:
кг/моль:
 K =
K =
= 385 K;
 K =
K =
= 1155 K;
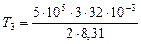 K =
K =
= 2887 K;
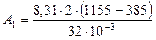 Дж
Дж  Дж
Дж 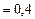 МДж;
МДж;

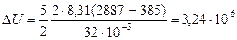 Дж = 3,24 МДж
Дж = 3,24 МДж
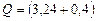 МДж
МДж 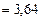 МДж.
МДж.
Пример 5. В цилиндре под поршнем находится водород массой  кг при температуре
кг при температуре 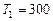 К. Водород сначала расширился адиабатно, увеличив свой объем в
К. Водород сначала расширился адиабатно, увеличив свой объем в  раз, а затем был сжат изотермически, причем объем газа уменьшился в
раз, а затем был сжат изотермически, причем объем газа уменьшился в 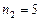 раз. Найти температуру в конце адиабатного расширения и работу, совершаемую газом при этих процессах.
раз. Найти температуру в конце адиабатного расширения и работу, совершаемую газом при этих процессах.
Решение. Температуры и объемы газа, совершающего адиабатный процесс, связаны между собой соотношением
 , или
, или 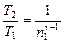 ,
,
где 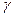 – отношение теплоемкостей газа при постоянном давлении и постоянном объеме;
– отношение теплоемкостей газа при постоянном давлении и постоянном объеме;  .
.
Отсюда получаем следующее выражение для конечной температуры:
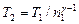 .
.
Работа 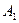 газа при адиабатном расширении может быть определена по формуле
газа при адиабатном расширении может быть определена по формуле
 ,
,
где  – молярная теплоемкость газа при постоянном объеме. Работа
– молярная теплоемкость газа при постоянном объеме. Работа 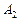 газа при изотермическом процессе может быть выражена в виде
газа при изотермическом процессе может быть выражена в виде
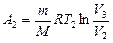 , или
, или 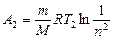 ,
,
где 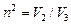 .
.
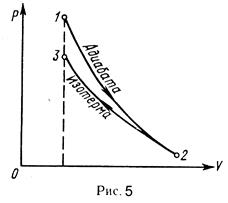 Произведем вычисления, учитывая, что для водорода как двухатомного газа
Произведем вычисления, учитывая, что для водорода как двухатомного газа 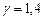 ,
, 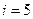 и
и  кг/моль:
кг/моль:
 К
К  К.
К.
Так как 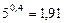 (находится логарифмированием), то
(находится логарифмированием), то
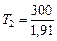 К
К  К;
К;
 Дж
Дж  кДж;
кДж;
 Дж
Дж 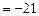 кДж.
кДж.
Знак минус показывает, что при сжатии работа газа совершается над газом внешними силами.
График процесса приведен на рис. 5.
Пример 6. Тепловая машина работает по обратимому циклу Карно. Температура теплоотдатчика 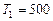 К. Определить термический КПД
К. Определить термический КПД 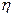 цикла и температуру
цикла и температуру  теплоприемника тепловой машины, если за счет каждого килоджоуля теплоты, полученной от теплоотдатчика, машина совершает работу
теплоприемника тепловой машины, если за счет каждого килоджоуля теплоты, полученной от теплоотдатчика, машина совершает работу  Дж.
Дж.
Решение. Термический КПД тепловой машины показывает, какая доля теплоты, полученной от теплоотдатчика, превращается в механическую работу. Термический КПД выражается формулой
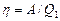 .
.
где  – теплота, полученная от теплоотдатчика; А – работа, совершенная рабочим телом тепловой машины.
– теплота, полученная от теплоотдатчика; А – работа, совершенная рабочим телом тепловой машины.
Зная КПД цикла, можно по формуле  определить температуру охладителя
определить температуру охладителя 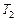 :
:
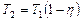 .
.
Произведем вычисления:
 ;
; 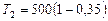 К
К 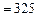 К.
К.
Пример 7. Найти добавочное давление внутри мыльного пузыря диаметром  см. Какую работу нужно совершить, чтобы выдуть этот пузырь?
см. Какую работу нужно совершить, чтобы выдуть этот пузырь?
Решение. Пленка мыльного пузыря имеет две сферические поверхности: внешнюю и внутреннюю. Обе поверхности оказывают давление на воздух, заключенный внутри пузыря. Так как толщина пленки чрезвычайно мала, то диаметры обеих поверхностей практически одинаковы. Поэтому добавочное давление
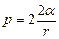 ,
,
где r – радиус пузыря. Так как 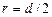 , то
, то
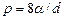 .
.
Работа, которую нужно совершить, чтобы, растягивая пленку, увеличить ее поверхность на  , выражается формулой
, выражается формулой
 , или
, или 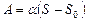 .
.
В данном случае S – общая площадь двух сферических поверхностей пленки мыльного пузыря; 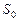 – общая площадь двух поверхностей плоской пленки, затягивавшей отверстие трубки до выдувания пузыря. Пренебрегая
– общая площадь двух поверхностей плоской пленки, затягивавшей отверстие трубки до выдувания пузыря. Пренебрегая 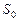 , получаем
, получаем
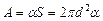 .
.
Произведем вычисления:
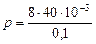 Па
Па  Па;
Па;
 Дж
Дж  Дж
Дж 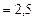 мДж.
мДж.
Дата добавления: 2020-11-23; просмотров: 90; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
