Факторы влияющие на скорость реакции.
Для гомогенных, гетерогенных реакций:
1) концентрация реагирующих веществ − чем выше концентрация, тем скорость выше;
2) температура − При увеличении температуры скорость большинства химических реакций повышается. Эта зависимость описана правилом Вант-Гоффа: «При повышении температуры на каждые 10 °C скорость химических реакций увеличивается в 2 – 4 раза».
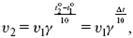
3) катализатор – вещество увеличивающее скорость реакции;
4) ингибитор – вещество замедляющее скорость реакции.
Только для гетерогенных:
1) скорость подвода реагирующих веществ к поверхности раздела фаз;
2) площадь поверхности – чем больше площадь, тем выше скорость.
Тепловой эффект химической реакции.
Тепловым эффектом химической реакции называется количество теплоты,
выделившееся (или поглотившееся) в ходе реакции и относимое к 1 моль прореагировавшего (или образовавшегося) вещества.
Тепловой эффект обозначается буквой Q и, как правило, измеряется в кДж/моль или в ккал/моль.
Если реакция происходит с выделением тепла (Q > 0), она называется экзотермической, а если с поглощением тепла (Q < 0) – эндотермической.
Термохимическое уравнение – это уравнение химической реакции, в котором указаны агрегатное состояние компонентов реакционной смеси (реагентов и продуктов) и тепловой эффект реакции. Например:
CuO (тв.) + H2 (г.) = Cu (тв.) + H2O (г.) +79 кДж
Химическое равновесие.
Обратимая реакция происходят как в прямом, так и в обратном направлении. Химическое равновесие - это такое состояние системы, при котором скорости
|
|
|
прямой и обратной реакций становятся одинаковыми (vпр..= vобр.). Количественной характеристикой химического равновесия является ее константа. Для гетерогенных реакций к выражения константы равновесия входят концентрации только тех веществ, которые находятся в газовой или жидкой фазе.
Влияние изменения внешних условий на состояние химического равновесия определяется по правилу, которое получило название принципа Ле Шателье: если на систему, находящуюся в состоянии равновесия, подействовать извне, то в системе будут происходить изменения, которые ослабляют внешнее воздействие.
На состояние химического равновесия влияют следующие факторы: концентрация реагирующих веществ, температура, давление (только для газовых систем).
Влияние концентрации на состояние равновесия. Добавление к системе одного из исходных веществ вызывает смещение равновесия в сторону образование продуктов реакции, то есть вправо (V. > V.). Добавление продуктов реакции смещает равновесие в сторону образования исходных веществ, то есть влево.
Влияние температуры на состояние равновесия. Во время нагрева системы, находящейся в состоянии равновесия, последняя смещается в сторону того из двух противоположно направленных процессов, который сопровождается поглощением теплоты (в сторону эндотермической реакции). Охлаждение способствует смещению равновесия в сторону реакции, которая сопровождается выделением теплоты (экзотермическая реакция).
|
|
|
Влияние давления на состояние равновесия. Давление влияет на состояние равновесия только в газовых системах, в случае если реакция протекает с изменением объемов реагирующих веществ в газообразном состоянии. Повышение давления приводит смещение химического равновесия в направлении процесса, который сопровождается уменьшением объема (уменьшением количества молекул газов), а снижение давления - вызывает смещение равновесия в противоположную сторону.
Д.З. Естествознание: учебное пособие / О.Е. Саенко, Т.П. Трушина, О.В. Арутюнян. — Москва: КноРус, 2018. Стр 117 – 132.
Изучить текст лекции.
Дата добавления: 2020-11-23; просмотров: 73; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
