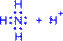Скорость реакции и факторы, от которых она зависит.
Раздел 3. Химия
Тема 3.1.
Основные законы и понятия химии.
1. Основные понятия химии.
2. Периодический закон.
3. Химическая связь.
4. Химические реакции.
5. Скорость реакции и факторы, от которых она зависит.
6. Тепловой эффект химической реакции.
7. Химическое равновесие.
Основные понятия химии.
Важнейшим разделом современного естествознания является химия. Она играет большую роль в решении наиболее актуальных и перспективных проблем современного общества. К их числу относят:
· Синтез новых веществ и композиций, необходимых для решения технических задач будущего, искусственных ферментов и гормонов, продуктов питания из несельскохозяйственного сырья;
· Выяснение механизма важнейших биохимических процессов и их реализация в искусственных условиях;
· Разработку и создание новых источников энергии;
· Охрану окружающей среды;
· Увеличение эффективности искусственных удобрений для повышения уровня урожайности сельскохозяйственной продукции;
· Освоение огромных океанических источников сырья.
Таким образом, главная задача химии – получение веществ с необходимыми свойствами.
Химия – это наука о веществах, их строении, свойствах и превращениях.
В широком понимании, вещество — это любой вид материи, обладающий собственной массой, например элементарные частицы. В химии понятие вещества более узкое, а именно: вещество — это любая совокупность атомов и молекул.
На сегодняшний день известно около 15 млн. органических и около полумиллиона неорганических веществ, причем каждое из этих веществ может вступать в десятки реакций, и каждое из них имеет внутреннее строение. Внутреннее строение определяет химические свойства; в свою очередь, по химическим свойствам мы часто можем судить о строении вещества.
Истоки химических знаний лежат в глубокой древности. Химические превращения использовались людьми еще в те времена, о которых не сохранилось письменных памятников. Эти химические «средства труда» (и, прежде всего, реакция горения) имели очень большое значение. При их помощи были заложены основы развития почти всех областей производства веществ, необходимых для прогресса человеческого общества. Огонь, очаг, печь, гончарное ремесло, металлургия, изготовление стекла, обработка кожи, приготовление продуктов брожения, красок, лекарств, средств косметики – все это основные ступени совершенствования и усложнения использованных человеком средств труда. Без расцвета разнообразных химических ремесел вряд ли было бы возможно появление высокоразвитых цивилизаций древних государств – Китая, Индии, Египта, Греции и Рима – с их товарообменом, письменностью и замечательной культурой. В древности наивысший уровень химических знаний совпал с расцветом Римской империи.
Исключительное значение для развития химии имело атомно-молекулярное учение.
Работы и открытия послужившие основой для его создания:
1. Атомистика древнегреческих материалистов – философское учение о дискретном строении материи.
2. Работы французского философа Пьера Гассенди (1592 – 1655 г.г.).
3. Открытие Р. Бойлем (1627 – 1691 г.г.) фундаментальной закономерности, описывающей изменения объема газа от его давления. Объяснение фактов, наблюдаемых Р. Бойлем, может дать только атомистика: если газ имеет дискретное строение, т.е. состоит из атомов и пустоты, то легкость его сжатия обусловлена сближением атомов в результате уменьшения свободного пространства между ними.
4. Открытие основных законов химии:
а)Закон сохранения массы сформулирован М. В. Ломоносовым в 1748 году и А. Лавуазье в 1777 году. Он гласит: масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции.
б)В 1801 году Ж. Пруст установил закон постоянства состава, согласно которому каждое химически чистое соединение независимо от способа его получения имеет вполне определенный состав.
в) Закон эквивалентов был сформулирован В. Рихтером в 1794 году. Он гласит: во всех химических реакциях взаимодействие различных веществ друг с другом происходит в соответствии с их эквивалентами, независимо от того, являются ли эти вещества простыми или сложными.
(Эквивалент — реальная или мнимая частица вещества, которая может присоединять, высвобождать или быть каким-либо иным образом эквивалентна (то есть равноценна) одному иону H+ в обменных реакциях или одному электрону в окислительно-восстановительных реакциях).
г ) В 1803 году Д. Дальтон открыл закон кратких отношений, если два элемента образуют друг с другом несколько химических соединений, то на одну и ту же массу одного из них приходятся такие массы другого, которые соотносятся между собой как простые целые числа.
д) Открытие Ж. Гей-Люссаком (в 1805 г.) закона объемных отношений, согласно которому объемы вступающих в реакцию газов относятся друг к другу, а также к объему получающихся газообразных продуктов как простые целые числа.
е) 1811 году А. Авогадро, сделал открытие которое вошло в химию как закон Авогадро. В равных объемах различных газов при одинаковой температуре и давлении содержится одинаковое число молекул.
В сентябре 1860 года на I Международном съезде химиков в Германии, в г. Карлсруэ были окончательно приняты основные положения атомно-молекулярного учения:
1. Все вещества состоят из атомов.
2. Атомы каждого вида (элемента) одинаковы между собой, но отличаются от атомов другого вида (элемента).
3. При взаимодействии атомов образуются молекулы: гомоядерные (при взаимодействии атомов одного элемента) или гетероядерные (при взаимодействии атомов разных элементов).
4. При физических явлениях молекулы сохраняются, а при химических – разрушаются. При химических реакциях атомы в отличие от молекул сохраняются.
5. Химические реакции заключаются в образовании новых веществ из тех же самых, из которых состоят первоначальные вещества.
Периодический закон.
Дальнейшее развитие атомно-молекулярного учения стало возможным благодаря открытию Д. И. Менделеева в 1869 году периодического закона химических элементов и создания его табличного выражения – периодической системы. Оказалось, что периодичность изменения свойств химических элементов и их соединений, связаны с повторяющейся структурой электронных оболочек их атомов.
В основу Периодического закона Д.И. Менделеев положил атомные массы (ранее - атомные веса) и химические свойства элементов.
Современная формулировка периодического закона такова: свойства химических элементов (т.е. свойства и форма образуемых ими соединений) находятся в периодической зависимости от заряда ядра атомов химических элементов.
В результате появилась естественная таблица, позже она стала называться периодической. Периодическая таблица Менделеева состоит из 8 групп и 7 периодов.
Вертикальные столбцы таблицы называют группами. Элементы, внутри каждой группы, обладают сходными химическими и физическими свойствами. Это объясняется тем, что элементы одной группы имеют сходные электронные конфигурации внешнего слоя, число электронов на котором равно номеру группы. При этом группа разделяется на главные и побочные подгруппы.
В Главные подгруппы входят элементы, у которых валентные электроны располагаются на внешних ns- и np- подуровнях.
В Побочные подгруппы входят элементы, у которых валентные электроны располагаются на внешнем ns- подуровне и внутреннем (n — 1) d- подуровне (или (n — 2) f- подуровне).
Все элементы в периодической таблице, в зависимости от того, на каком подуровне (s-, p-, d- или f-) находятся валентные электроны классифицируются на: s- элементы (элементы главной подгруппы I и II групп), p- элементы (элементы главных подгрупп III — VII групп), d- элементы (элементы побочных подгрупп), f- элементы (лантаноиды, актиноиды).
Высшая валентность элемента (за исключением O, F, элементов подгруппы меди и восьмой группы) равна номеру группы, в которой он находится.
Для элементов главных и побочных подгрупп одинаковыми являются формулы высших оксидов (и их гидратов). В главных подгруппах состав водородных соединений являются одинаковыми, для элементов, находящихся в этой группе. Твердые гидриды образуют элементы главных подгрупп I — III групп, а IV — VII групп образуют а газообразные водородные соединения. Водородные соединения типа ЭН4 – нейтральнее соединения, ЭН3 – основания, Н2Э и НЭ — кислоты.
Горизонтальные ряды таблицы называют периодами. Элементы в периодах отличаются между собой, но общее у них то, что последние электроны находятся на одном энергетическом уровне (главное квантовое число n — одинаково).
Первый период отличается от других тем, что там находятся всего 2 элемента: водород H и гелий He.
Во втором периоде находятся 8 элементов (Li — Ne). Литий Li – щелочной металл начинает период, а замыкает его благородный газ неон Ne.
В третьем периоде, также как и во втором находятся 8 элементов (Na — Ar). Начинает период щелочной металл натрий Na, а замыкает его благородный газ аргон Ar.
В четвёртом периоде находятся 18 элементов (K — Kr) – Менделеев его обозначил как первый большой период. Начинается он также с щелочного металла Калий, а заканчивается инертным газом криптон Kr. В состав больших периодов входят переходные элементы (Sc — Zn) — d-элементы.
В пятом периоде, аналогично четвертому находятся 18 элементов (Rb — Xe) и структура его сходна с четвёртым. Начинается он также с щелочного металла рубидий Rb, а заканчивается инертным газом ксенон Xe. В состав больших периодов входят переходные элементы (Y — Cd) — d-элементы.
Шестой период состоит из 32 элементов (Cs — Rn). Кроме 10 d-элементов (La, Hf — Hg) в нем находится ряд из 14 f-элементов(лантаноиды)- Ce — Lu
Седьмой период не закончен. Он начинается с Франций Fr, можно предположить, что он будет содержать, также как и шестой период, 32 элемента. Но найдено пока только 24(до элемента с Z = 110). Сюда входят 14 f-элементов, которые относятся к актиноидам.
Химическая связь.
На рубеже XIX – XX веков в химии начали прослеживаться кризисные тенденции, поскольку подверглась сомнению истинность сложившейся атомно-молекулярной концепции, т.к. она не могла объяснить некоторые экспериментальные данные, полученные к концу XIX века. Однако дальнейшее исследование сложного строения атома прояснило причину связи атомов друг с другом. Это – химическая связь, указывающая на действие электростатических сил между атомами.
Химическая связь - это взаимодействие двух атомов, осуществляемое путем обмена электронами. При образовании химической связи атомы стремятся приобрести устойчивую восьмиэлектронную (или двухэлектронную) внешнюю оболочку, соответствующую строению атома ближайшего инертного газа.
Основные характеристики химической связи − прочность, длина, полярность.
Энергия связи является важнейшей характеристикой химической связи, определяющей ее прочность.
Количественно она оценивается при помощи энергии, которая затрачивается на ее разрыв.
Различают следующие виды химической связи: ковалентная (полярная и неполярная; обменная и донорно-акцепторная), ионная, водородная и металлическая.
Ковалентьная связь.
Ковалентьная связь осуществляется за счет электронной пары, принадлежащей обоим атомам. Различают обменный и донорно-акцепторный механизм образования ковалентной связи.
1) Обменный механизм. Каждый атом дает по одному неспаренному электрону в общую электронную пару:
| H• + •H H : H | 
| | 
|
2) Донорно-акцепторный механизм. Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь;
|
| | 
|
Два атома могут обобществлять несколько пар электронов. В этом случае говорят о кратных связях:
|
| | 
| (или NN) – тройная связь |
Если электронная плотность расположена симметрично между атомами, ковалентная связь называется неполярной.
Если электронная плотность смещена в сторону одного из атомов, то ковалентная связь называется полярной.
Полярность связи тем больше, чем больше разность электроотрицательностей атомов.
Электроотрицательность – это способность атома притягивать электронную плотность от других атомов. Самый электроотрицательный элемент - фтор, самый электроположительный – франций.
Ионная связь.
Ионы – это заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов.
|
| | 
|
(фторид натрия состоит из ионов натрия Na+ и фторид-ионов F-)
Если разность электроотрицательностей атомов велика, то электронная пара, осуществляющая связь, переходит к одному из атомов, и оба атома превращаются в ионы.
Химическая связь между ионами, осуществляемая за счет электростатического притяжения, называется ионной связью.
Водородная связь.
Водородная связь - это связь между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы. Водородная связь имеет частично электростатический, частично донорно-акцепторный характер.

|
| Водородная связь изображена точками |
Наличие водородных связей объясняет высокие температуры кипения воды, спиртов, карбоновых кислот.
Металлическая связь.
Валентные электроны металлов достаточно слабо связаны со своими ядрами и могут легко отрываться от них. Поэтому металл содержит ряд положительных ионов, расположенных в определенных положениях кристаллической решетки, и большое количество электронов, свободно перемещающихся по всему кристаллу. Электроны в металле осуществляют связь между всеми атомами металла.
Теперь, когда мы повторили периодический закон и типы образующихся между атомами связей, настало время вспомнить, что же такое химические реакции.
Химические реакции.
Химическая реакция - это превращение одних веществ в другие. В отличие от ядерных реакций, в химических реакциях не затрагиваются ядра атомов. Все изменения происходят только во внешних электронных оболочках. Разрываются одни химические связи и образуются другие.
Вещества, вступающие в химическую реакцию, называются – реагентами.
Вещества, образующиеся в результате реакции – продукты реакции.
Типы химических реакций.
Существует 4 типа химических реакций:
1. реакции соединения,
2. реакции разложения,
3. реакции обмена,
4. реакции замещения.
Кроме того, химические реакции делятся на
1. Необратимые − протекают только в одном направлении (хотя бы одно из исходных веществ превращается в продукты реакции: осадок, или газ)
2. Обратимые− при данных условиях протекают в противоположных направлениях, прямом и обратном.
Так же, в результате химической реакции выделяется или поглощается теплота (тепловой эффект реакции Q).
В связи с этим химические реакции делятся на экзотермическиеи эндотермические.
Некоторые реакции протекают (1.) без степеней окисления, либо (2.) с изменением степени окисления всех или некоторых элементов – окислительно-восстановительные реакции.
По наличию или отсутствию поверхностей раздела между реагентами, химические реакции делятся на гомогенные (нет поверхности раздела) и гетерогенные (вещества отделены друг от друга поверхностью раздела).
Скорость реакции и факторы, от которых она зависит.
Скорость химической реакции – число элементарных актов химического взаимодействия, протекающих в единицу времени в единицу объема (гомогенные) или на единице поверхности (гетерогенные).
Истинная скорость реакции:
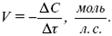
Дата добавления: 2020-11-23; просмотров: 77; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!