Химические свойства металлов и их соединений.
ЛАБОРАТОРНАЯ РАБОТА №1
По дисциплине «Химия»
Свойства металлов и неметаллов и их соединений.
(тема практического задания)
| ФИО студента | Ивановский Руслан Викторович |
| Направление подготовки | Техносферная безопасность |
| Группа | ТЕХ-Б-0-3-2019-1 |
Москва 2020
Свойства металлов и неметаллов и их соединений.
Цель: Изучить классификацию металлов и неметаллов. По литературным источникам познакомиться с их свойствами, с простейшими методами исследования, очистки и выделения неорганических веществ в природе. Вырабатывать навыки работы с учебной и научной литературой, правилами оформления отчетов. Развить умение формулировать выводы.
Учебные вопросы:
1. Свойства металлов основных групп таблицы Д. И. Менделеева.
2. Свойства металлов подгрупп таблицы Д. И. Менделеева.
3. Свойства неметаллов основных групп таблицы Д. И. Менделеева.
4. Свойства неметаллов подгрупп таблицы Д. И. Менделеева.
5. Важнейшие представители металлов и неметаллов и их использование в народном хозяйстве и быту.
6. Выводы.

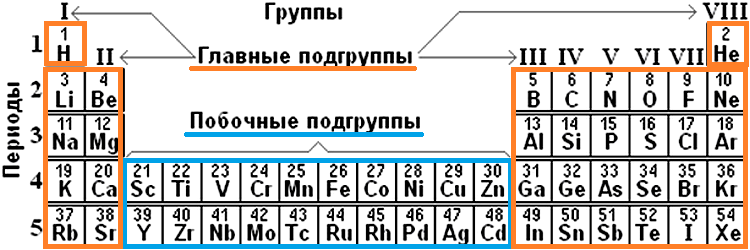
группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
|
|
|
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.
Металлы IA (первой группы главной подгруппы) также называются «щелочные металлы». К ним относятся литий, натрий, калий, рубидий, цезий. Франций – радиоактивный элемент, в природе практически не встречается. У всех металлов IA группы на внешнем энергетическом уровне, на s-подуровне в основном состоянии есть один неспаренный электрон.
Металлы IA группы — s-элементы. В химических реакциях они отдают один валентный электрон, поэтому для них характерна постоянная степень окисления +1.
Металлы IIA (второй группы главной подгруппы) — щелочноземельные. Раньше к щелочноземельным металлам относили только кальций, стронций, барий и радий, но по решению ИЮПАК бериллий и магний также называются щелочноземельными.
У щелочноземельных металлов на внешнем энергетическом уровне расположены два электрона. В основном состоянии это два спаренных электрона на s-подуровне. Щелочноземельные металлы — s-элементы. Отдавая два валентных электрона, они проявляют постоянную степень окисления +2. Все элементы подгруппы бериллия — сильные восстановители, но восстановительные свойства выражены слабее, чем у щелочных металлов.
|
|
|
Элементы IIIA (третьей группы главной подгруппы) — это бор, алюминий, галлий, индий, таллий и нихоний. В основном состоянии содержат на внешнем энергетическом уровне три электрона, которые распределены по s- и р-подуровням. Все элементы подгруппы бора относятся к р-элементам. В химических соединениях проявляются степень окисления +3. Хотя для таллия более устойчивая степень окисления +1.
В общем металлы IА–IIIА подгрупп характеризуются:
· небольшим количеством электронов на внешнем энергетическом уровне;
· сравнительно сильными восстановительными свойствами;
· низкими значениями электроотрицательности;
· сравнительно большими атомными радиусами (относительно радиусов других атомов в периодах, в которых расположены соответствующие металлы);
· металлической кристаллической решеткой;
|
|
|
· высокой электро- и теплопроводностью;
· твердым фазовым состоянием при нормальных условиях.
Все элементы побочных подгрупп являются металлами.
В главную подгруппу входят s-элементы и p-элементы.
В побочную подгруппу входят d-элементы (их также называют переходными элементами или переходными металлами).
Химические свойства металлов и их соединений.
Щелочные металлы самые активные из всех металлов. Они размещены в начале электрохимического ряда напряжений металлов. Реакционная способность очень велика. Уже при комнатной температуре они реагируют со многими неметаллами:
а) С водородом при нагревании образуют твердые вещества гидриды. Гидриды металлов легко разлагаются водой с образованием соответствующего щелочи и водорода:
2Na + H2 = 2NaH; NaH + H2O = NaOH + H2.
б) Во время горения натрия и калия в кислороде образуются пероксиды:
2Na + O2 = Na2O2.
Во время медленного окисления или горения в условиях нехватки кислорода образуются оксиды:
4Na + O2 = 2Na2O.
в) В результате взаимодействия с другими неметаллами (Cl2, N2, P, S, Si, Br2, J2, C) образуются соли – твердые кристаллические ионные соединения.
г) Калий и натрий бурно реагируют с водой при обычных условиях с образованием гидроксидов и водорода:
|
|
|
2Na + 2H2O = 2NaOH + H2 ↑.
При взаимодействии с водой кусочек натрия плавится и приобретя форму шарика «бегает» по поверхности воды благодаря подталкиванию его водородом, который выделяется. При взаимодействии калия с водой образованый водород самовозгорается.
д) Натрий и калий энергично взаимодействуют с кислотами – слабыми окислителями HCl, H2SO4 (разбавленная), HBr, HJ, H2S и т.д., с образованием соли и водорода:
2Na + 2HCl = 2NaCl + H2.
При реакции с кислотами – сильными окислителями HNO3 и концентрированной H2SO4 натрий и калий восстанавливают азот и серу соответствующих кислот в низших степеней окисления. Параллельно происходит взаимодействие этих металлов с водой с образованием водорода. Эти реакции сопровождаются взрывом:
8Na + 10HNO3 = 8NaNO3 + NH4NO3 + 3H2O;
8Na + 5H2SO4 = 4Na2SO4 + H2S + 4H2O.
Основные отрасли применения металлов:
| Отрасль | Производство | Металлы |
| Химическая промышленность | Катализаторы, соли, щёлочи | Pt, Fe, Ni, K |
| Пищевая промышленность | Поваренная соль (NaCl), сода (Na2CO3, NaHCO3) | Na, Ca, Ag |
| Металлургия | Сплавы, покрытия, детали разной формы, проволока, облицовка, строительные материалы и инструменты | Fe, Cr, Ni, W, Mo |
| Приборостроение | Микросхемы, фотоэлементы, датчики | Cs, Co, Ni, Cu |
| Ювелирная промышленность | Украшения | Au, Pt, Ag |
| Медицина | Протезы | Ti, Ni, Au |
Кальций в жизни и природе.
Добыча кальция.
В промышленности кальций добывают электролизом расплава смеси хлорида кальция CaCl2 и кальций флуорид CaF2 в отношении 3: 1. Последний добавляют для снижения температуры плавления смеси.
Применение кальция.
Благодаря большой химической активности металлический кальций применяют для восстановления некоторых тугоплавких металлов (титан, цирконий) с их оксидов. Его используют для очистки чугуна и стали от примесей, для извлечения некоторых сплавов (свинцово-кальциевых), для изготовления подшипников и оболочек кабелей.
Соединения кальция.
Кальций оксид CaO (технические названия: негашеная известь, кипелка, жженая известь) – тугоплавкое вещество белого цвета, температура плавления 2570ºС, с ярко выраженными основными свойствами.
Добывают кальций оксид окислением кальция: 2Ca + O2 = 2CaO; а в промышленности обжигом известняка при температуре 1000-1100ºС:
CaCO3 t CaO + CO2.
Химические свойства кальция.
Как все основные оксиды взаимодействует с кислотами и кислотными оксидами с образованием солей.
CaO + 2HCl = CaCl2 + H2O
CaO + SO3 = CaSO4.
Оксид кальция, связывая углекислый газ, превращается в карбонаты:
CaO + CO2 = CaCO3.
Взаимодействие кальций оксида с водой, называют гашением извести, которое происходит с выделением большого количества теплоты. Часть воды при этом превращается в пар, а кусочки оксида рассыпаются в хрупкую массу кальций гидроксида, который называют гашеной известью:
CaO + H2O = Ca(OH)2.
Кальций оксид применяют преимущественно для гашения извести. Его применяют в промышленности как вяжущий материал.
Кальций гидроксид Ca(OH)2 – (гашеная известь) твердое вещество белого цвета плохо растворимое в воде, в измельченном состоянии его называют пушонкой. Раствор (взвесь) извести в воде называют известковым молоком. Его применяют для побелки помещений, известкование деревьев, в производстве сахара. Бесцветный прозрачный раствор Ca(OH)2 называют известковой водой. Смесь гашеной извести, песка и воды называется известковым раствором. Кальций гидроксид обладает щелочными свойствами. Он взаимодействует с кислотами, кислотными оксидами и солями малоактивных металлов. При пропускании углекислого газа через известковую воду, прозрачный раствор мутнеет, так как образуется нерастворимый в воде кальций карбонат CaCO3.
Ca(OH)2 + CO2 = CaCO3 + H2O.
Это качественная реакция на ионы кальция.
В случае длительного пропускания углекислого газа муть исчезает, так как кальций карбонат превращается в растворимый в воде кальций гидрогенкарбонат Ca(HCO3)2.
Эта реакция обратима. При нагревании раствор кальций гидрокарбоната мутнеет, поскольку образуется нерастворимый кальций карбонат и выделяется углекислый газ.
Эти реакции играют важную роль в природе. Дождевая вода растворяет углекислый газ и, просачиваясь сквозь почву, взаимодействует с известняком, растворяя его в виде гидрокарбоната. Особенно эта реакция происходит в толщах известняковых пород. Когда такая вода выходит на поверхность и испаряется, остается кальций карбонат. В результате круговорота солей кальция образуются карстовые пещеры, возникновения в них сталактитов и сталагмитов.
Свойства неметаллов.
Для неметаллов характерны следующие химические свойства:
· взаимодействие с простыми веществами-металлами, в результате чего образуются основные и амфотерные оксиды, соли и бинарные соединения
2Na + Cl2 = 2NaCl
Fe + S = FeS
6Li + N2 = 2Li3N
2Ca + O2 = 2CaO
· взаимодействие друг с другом, в частности с кислородом, в результате чего образуются оксиды, проявляющие кислотный характер
3H2+ N2= 2NH3
H2+ Br2= 2HBr
S + O2= SO2
4P + 5O2= 2P2O5
2F2+ O2= 2OF2
S + 3F2= SF6,
C + 2Cl2= CCl4
Кроме этого, каждый неметалл обладает специфическими химическими свойствами, характерными только для него, которые подробно рассматривают при изучении каждого неметалла в отдельности.
У большинства неметаллов есть общие характеристики и свойства:
· Относительно небольшой радиус атома.
· Высокая электроотрицательность (значения, близкие к 3-4). Чем ближе к фтору элемент, то есть чем выше и правее расположен элемент, тем больше его электротрицательность.
· У неметаллов относительно электронов на внешнем энергетическом уровне (исключения — водород, бор, гелий). Как правило, у большинства неметаллов от 4 до 8 электронов на внешнем энергетическом уровне.
· Большинство неметаллов проявляют окислительные свойства. Окислительные свойства простых веществ зависят не только от положения в Периодической системе, но и от особенностей строения их молекул. Фтор, хлор или кислород в виде простых веществ — сильные окислители; мышьяк, селен, водород, углерод и кремний в виде простых веществ сильные восстановители и слабые окислители. А в целом почти все неметаллы могут проявлять как окислительные, так и восстановительные свойства в реакциях.
· Среди неметаллов есть газообразные вещества (H2, O2, N2, Cl2, F2), жидкие вещества (Br2) и твердые вещества (к примеру, S8, P4, I2).
· Для неметаллов характерны крайне низкие значения электро- и теплопроводности, у них отсутствуют такие свойства, как ковкость, пластичность.
Дата добавления: 2020-11-23; просмотров: 924; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
