При постоянной температуре давление пара растворителя над раствором было пропорционально его мольной доли в растворе
 |
где p10 и p1 – давление пара растворителя над чистым
растворителем и над раствором соответственно,
x1 – мольная доля растворителя в растворе


Для бинарных растворов:
Относительное понижение давления пара растворителя над раствором равно мольной доле растворенного вещества
Если бинарный (идеальный) раствор состоит из двух летучих компонентов, а пар обладает свойствами идеального газа, то закон Рауля справедлив как для растворителя, так и для растворенного вещества:
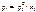 | 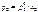 |
Общее давление пара над идеальным раствором равно сумме парциальных давлений пара отдельных компонентов:
 |
Парциальное давление пара растворителя и растворенного вещества,а также общее давление пара над идеальным раствором линейно зависят от состава раствора

С ростом давления пара и с увеличением концентрации раствора наблюдаются отклонения от уравнения Рауля
При больших давлениях пара отклонения вызваны неидеальностью самого пара, не подчиняющегося законам идеальных газов, и не зависят от природы и концентрации растворов
Эти отклонения учитываются при замене давления пара его фугитивностью. Обобщенный закон Рауля имеет вид:
 | 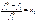 | ||
Температура кипения идеального раствора
• Чистый растворитель начинает кипеть при температуре, когда давление его насыщенного пара становится равным внешнему давлению (в обычных условиях 1 атм или 1.0133∙105 Па).
|
|
|
• Из закона Рауля следует, что давление пара растворителя над идеальным раствором меньше, чем над чистым растворителем при той же температуре.
• Температура кипения идеального раствора T1 выше температуры кипения чистого растворителя T10 на величину ΔTb (повышение температуры кипения раствора)
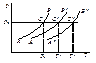 |










12.Мембранное равновесие. Осмос и осмотическое давление идеального раствора.






13.  Неидеальные растворы, отклонения от идеальности, активность и коэффициент активности. Предельно разбавленные растворы, закон Генри. Методы определения активностей растворителя и растворенного вещества.
Неидеальные растворы, отклонения от идеальности, активность и коэффициент активности. Предельно разбавленные растворы, закон Генри. Методы определения активностей растворителя и растворенного вещества.

















14. Функции смешения реальных растворов.


18.Специфика растворов электролитов. Электролитическая диссоциация в растворе. Изотонический коэффициент, коллигативные свойства растворов электролитов. Константа диссоциации и способы ее определения.



|
|
|


19. Теория Дебая-Хюккеля. Ионная сила.


20. Термодинамика ионной сольватации. Модель Борна.







24. Механизм возникновения электродного потенциала.












25.







22.



21.









23.













Дата добавления: 2020-11-23; просмотров: 48; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
