ВЫВОД: Термохимические уравнения можно складывать и вычитать подобно алгебраическим
Связь форм обмена энергии с координатами состояния и потенциалами взаимодействия
| Форма обмена энергией (Lm) | Координата состояния (qm) | Потенциал взаимодействия (pm) |
| Механическая работа (А) | Объем (V) | Давление (p) |
| Работа по переме-щению заряда (Aэл) | Заряд (q) | Электродвижущая сила (E) |
| Количество теплоты (Q) | Энтропия (S)* | Температура (Т) |
| Внутренняя энергия компонента (Wi) | Количество вещества (ni) | Химический потенциал i-го компонента (μi)* |
| … | … | …. |
* - невозможно измерить опытным путем
Принцип существования единой формы выражения количеств воздействия через характеристики состояния системы
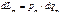 Существует единая форма выражения количеств воздействий (теплоты, работы и других форм обмена энергии) в равновесных процессах в виде произведения абсолютного потенциала взаимодействия на изменение координаты состояния системы, соответствующей потенциалу по роду взаимодействия:
Существует единая форма выражения количеств воздействий (теплоты, работы и других форм обмена энергии) в равновесных процессах в виде произведения абсолютного потенциала взаимодействия на изменение координаты состояния системы, соответствующей потенциалу по роду взаимодействия:

2. Первый закон (начало) термодинамики
Первый закон термодинамики – это закон сохранения энергии
Изменение внутренней энергии термодинамической системы равно разнице между количеством теплоты, подведенной к системе, и количеством механической и немеханических работ, совершенной системой
Первый закон термодинамики представляет собой постулат, т.е. базируется на многочисленных опытах. Его верность проверяется путем сопоставления вытекающих из него следствий с опытом. Пока в истории науки не найдено опытных данных, противоречащих этому закону.
|
|
|
Математическая запись
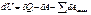 |
где dU - элементарное изменение внутренней энергии; U – функция состояния системы, это полный дифференциал, т.е. изменение ее не зависит от пути процесса;
δA и δQ – бесконечно малые количества элементарных работ и элементарного количества теплоты; это функции процесса, их значения зависят от пути процесса.
Альтернативная формулировка
Внутренняя энергия любой изолированной системы остается постоянной, несмотря на протекающие в ней процессы
Принцип существования внутренней энергии
Существует экстенсивная функция
состояния – внутренняя энергия, мерой изменения которой служат количества воздействий (теплота и различного рода работы)
Изотермический процесс (dT=0) для идеальных газов
Для идеального газа, а также для реального газа при невысоких давлениях внутренняя энергия является функцией только температуры. Для 1 моль газа:
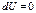 | 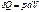 | ||
Изобарный процесс (dp=0)
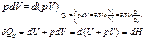 | |||
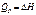 | |||
где величина Н = (U + pV) называется энтальпией системы. Энтальпия, как и внутренняя энергия, является функцией состояния, и ее изменения не зависят от пути процесса. Tеплота Qp при изобарическом процессе также приобретает свойства функции состояния.
|
|
|
Энтальпия
Энтальпия является функцией состояния, то есть ее изменение не зависит от пути протекания этого изменения, а определяется лишь значением энтальпии в начале процесса и в конце процесса
Энтальпия имеет ту же размерность, что и внутренняя энергия, это тоже экстенсивное свойство, то есть она зависит от массы системы.
В настоящее время на определении изменения энтальпии основан расчет тепловых балансов химических реакций:
Тепловой эффект реакции = - ΔHреакции
3. Теплоемкость
Общая теплоемкость системы – это количество теплоты, которое необходимо для повышения температуры системы на один градус.
Поскольку она является экстенсивной величиной, то более удобно пользоваться теплоемкостью, отнесенной к единице количества вещества. В зависимости от этого различают удельную (на 1 г или 1 кг массы) и мольную (на 1 моль) теплоемкости.
В зависимости от условий нагревания различают – теплоемкость при постоянном объеме, СV (при V = const) и теплоемкость при постоянном давлении,
Сp (p = const).
Теплоемкости зависят от природы вещества, а также от температуры.
|
|
|
Средняя теплоемкость – теплоемкость в заданном температурном интервале (от Т1 до Т2):
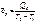 | 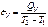 | ||
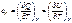
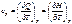 Истинная теплоемкость – теплоемкость при заданной температуре
Истинная теплоемкость – теплоемкость при заданной температуре
Связь между средней и истинной теплоемкостью
Средняя теплоемкость приближается к истинной при уменьшении температурного интервала, когда (Т2 – Т1) → 0.
При постоянном давлении справедливо:
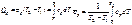 |
Связь между сp и cv
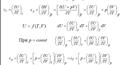
Для идеальных газов (формула Майера):
cp=cV+R.
Для реальных газов:
cp-cV>R
Чем выше давление газа, тем больше будет разность теплоемкостей отличаться от R.
Для твердого тела при обычной температуре разность cp-cV<R и составляет около 1 Дж/(моль∙К). Величина
cp-cV с понижением температуры уменьшается и при Т→0К стремится к нулю.
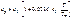 Для твердых тел справедливо эмпирическое уравнение: где Tm – температура плавления
Для твердых тел справедливо эмпирическое уравнение: где Tm – температура плавления
Расчет теплоемкости
Для идеальных газов теплоемкость определяется только поступательным движением их молекул. Из молекулярно-кинетической теории вытекает, что мольная теплоемкость одноатомного газа равна
cV = 3/2R=12.47 Дж/(моль∙К), для газов с двухатомными молекулами cV = 5/2R, с трехатомными – cV = 3R.
|
|
|
В действительности наблюдаются значительные отклонения от теоретических значений.
Теплоемкости некоторых газов при 298 К, Дж/(моль∙К)
| Газ | СV | Cp | Газ | cV | Cp |
| He | 12.46 | 20.77 | I2 | 27.61 | 35.92 |
| Ar | 12,55 | 20.86 | CO | 20.62 | 28.93 |
| H2 | 20.20 | 28.51 | CO2 | 28.07 | 36.38 |
Для расчетов теплоемкости жидкостей и растворов кинетическая теория вообще не может быть применена (теплоемкость зависит от их химического состава, структуры, температуры).
Для большинства жидкостей теплоемкость линейно увеличивается при повышении температуры, для ртути – уменьшается, а для воды – проходит через минимум.
Теплоемкость воды при различных температурах
| Температура, К | Сp, Дж/(моль∙К) | Температура, К | Сp, Дж/(моль∙К) |
| 273 | 75.91 | 313 | 75.21 |
| 293 | 75.27 | 323 | 75.25 |
| 303 | 75.21 | 343 | 75.41 |
| 308 | 75.20 | 363 | 75.69 |
Для расчета теплоемкости твердых тел разработаны квантовые теории (Эйнштейн, Дебай и т.д.).
Расчеты по формулам этих теорий дают правильные результаты лишь для некоторых веществ в ограниченном температурном интервале.
Поэтому для расчетов теплоемкостей и тепловых эффектов при разных температурах используют экспериментальные величины теплоемкостей:
c р = a +b∙T +c∙T 2
c р = a +b∙T +c*∙T -2+d∙T 2
В справочных таблицах приводятся значения коэффициентов (a, b, c, c*, d) и интервал температур,
для которого выполняются зависимости
4. Термохимия. Тепловые эффекты
Термохимия – раздел химической термодинамики, посвященный исследованиям тепловых эффектов химических реакций, теплот фазовых переходов, теплот растворения веществ и т.д.
Под тепловым эффектом химической реакции понимают количество теплоты, которое выделяется или поглощается при условиях: а) процесс протекает необратимо при постоянном объеме или давлении;
б) в системе не совершается никаких работ, кроме работы расширения системы; в) продукты реакции имеют ту же температуру, что и исходные вещества.
Экзотермические реакции – выделение тепла
Эндотермические реакции – поглощение тепла
Термохимия. Закон Гесса
Поскольку внутренняя энергия и энтальпия являются функциями состояния, и их изменения не зависят от пути процесса, то и тепловые эффекты не зависят от пути процесса.
Для химических реакций это положение было установлено опытным путем Г. И. Гессом в 1836 г. и известно под названием закона Гесса:
Тепловой эффект химической реакции не зависит от пути протекания процесса (промежуточных стадий),
а определяется лишь начальным и конечным состояниями системы (т.е. состоянием исходных веществ и продуктов реакции)
Закон Гесса выполняется при условии протекания реакции при постоянном давлении или при постоянном объеме (что реально соблюдается в подавляющем большинстве случаев)
В химии и химической технологии чаще всего встречаются изобарные процессы, поэтому в справочниках и учебниках (там, где особо не оговорено) приведены изобарные тепловые эффекты.
Связь изобарного и изохорного тепловых эффектов:
Qp – QV = ΔUp + р∙ΔV – ΔUV.≈ р∙ΔV
Разностью изобарного и изохорного тепловых эффектов можно пренебречь, если в реакции участвуют вещества только в твердом и жидком состоянии.
Следствия из закона Гесса
1. Тепловой эффект разложения химического соединения до определенных продуктов равен по величине и противоположен по знаку тепловому эффекту образования этого соединения из тех же продуктов
2. Разность между тепловыми эффектами превращения двух различных химических систем в одинаковые продукты реакции равна тепловому эффекту перехода одной системы в другую.
3. Разность между тепловыми эффектами превращения двух одинаковых химических систем в различные продукты реакции равна тепловому эффекту, соответствующему превращению одних продуктов реакции в другие
ВЫВОД: Термохимические уравнения можно складывать и вычитать подобно алгебраическим
Теплота образования
Под теплотой образования (энтальпией образования) понимают то количество теплоты, которое выделяется или поглощается при образовании одного моля вещества (атома, молекулы) из простых веществ, взятых в термодинамически устойчивом состоянии при рассматриваемых условиях – обычно 298 К и 1 атм.
Энтальпию (теплоту) образования простых веществ при стандартном давлении и 298 К и в термодинамически устойчивом состоянии (Н2, Сl2, Sромб, Сграфит) принимают равной нулю.
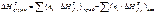
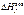
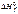 Энтальпии образования при стандартных условиях и 298 К табулированы в справочниках, их принято обозначать или
Энтальпии образования при стандартных условиях и 298 К табулированы в справочниках, их принято обозначать или
Теплота образования и тепловой эффект
химической реакции
Энтальпия (тепловой эффект) химической реакции равняется разности между суммами энтальпий (теплот) образования продуктов реакции и энтальпий (теплот) образования исходных веществ в соответствии с их стехиометрическими коэффициентами:
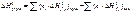 |
Для стандартного давления и 298 К справедливо:


5. Второй закон (начало) термодинамики
Второй закон термодинамики – постулат, который утверждает наличие в природе ассиметрии, выражающейся в односторонности и необратимости происходящих в ней неравновесных процессов.
С. Карно (1824): в тепловых машинах теплота, полученная от теплоисточника, не может быть полностью переведена в механическую работу; часть ее должна быть передана третьему телу – холодильнику

Второй закон (начало) термодинамики. Современная формулировка
Принцип существования энтропии: для каждой термодинамической системы существует физическая величина (энтропия), значение которой зависит от состояния системы и изменение которой происходит под действием энергии, передаваемой в виде теплоты



Расчет энтропии. Фазовые превращения
Фазовые (агрегатные) превращения (плавление, испарение, переход из одной кристаллической модификации в другую и т.п.) происходят при постоянных температуре и давлении.
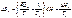 Теплота такого перехода равна изменению энтальпии при фазовом превращении ΔHtr, поэтому
Теплота такого перехода равна изменению энтальпии при фазовом превращении ΔHtr, поэтому
при p, Т = const:
где ΔStr – изменение энтропии при фазовых
превращениях;
Ttr – температура фазового перехода
Особенности неравновесных процессов
При непосредственном взаимодействии между телами с разными давлениями и температурами энергия передается необратимо и обязательно в направлении меньшего давления (работа) и температуры (теплота)
При необратимой передаче работы часть ее неизбежно превращается в теплоту, причем тем больше, чем выше степень неравновесности процесса
При необратимой передачи теплоты от тела с большой температурой к телу с меньшей температурой имеет место превращение потенциально возможной работы в теплоту
Принцип неравноценности теплоты и работы: теплота является «низшей» формой обмена энергией, в которую при малейшей возможности (неравновесности процесса) самопроизвольно превращается работа
ВЫВОД: Характерной особенностью необратимых процессов передачи энергии является их определенная направленность (от большего потенциала взаимодействия к меньшему) и неизбежное превращение работы (действительно совершаемой в процессе или потенциально возможной) в теплоту. Пропорционально количеству возникшей внутри системы теплоты увеличивается ее энтропия

Второй закон (начало) термодинамики для
изолированных систем
При протекании равновесного процесса в изолированной системе (δQ=0, U,V=const) энтропия системы останется неизменной:
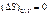 |
В неравновесных условиях:
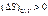
II закон термодинамики для изолированных систем: энтропия изолированной системы при наличии в ней неравновесных процессов всегда возрастает, причем ее рост продолжается до тех пор, пока система не достигнет равновесного состояния
6. Основное неравенство термодинамики
Для анализа поведения термодинамических систем в обратимых и необратимых процессах при равновесном тепловом и механическом взаимодействии между системой и окружающей средой может быть использовано выражение:
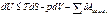
Характеристические функции
Характеристическими называются функции, через которые, а также через их производные, наиболее просто и в явном виде могут быть выражены все термодинамические свойства системы.
Характеристические функции обладают таким свойством, когда при определенном выборе независимых переменных частные производные этой характеристической функции будут равны одной из других переменных.
Дата добавления: 2020-11-23; просмотров: 70; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
