Экстракция смесями экстрагентов
При извлечении смесями экстрагентов часто наблюдаются изменения коэффициента распределения извлекаемого компонента в фазах или образование сольватов. Такой эффект называется синергетическим или синергизмом. Он выражается в том, что экспериментально определяемый коэффициент D оказывается больше этого коэффициента, вычисленного по схеме аддитивности. Синергизм обычно реализуется при невысоких концентрациях распределяемого компонента. При более полном использовании емкости экстрагента наблюдается противоположный эффект (антагонизм), при котором коэффициент распределения меньше суммы коэффициентов распределения компонентов данной системы. В хелатных экстракционных системах часто наблюдается синергетическое увеличение D, если два реагента взаимодействуют с металлом с образованием легко экстрагируемых соединений по сравнению с обычными хелатами. Например, магний образует с 8-гидроксихинолином (Ох) и н-бутиламином (Вu) соединение Mg(Ox)2(Bu)2, а европий(III) с теноилтрифторацетоном (ТТА) и трибутилфосфатом (ТБФ) – Eu(ТТА)3(ТБФ)2.
Маскирование при экстракции
Для повышения селективности извлечения компонента применяют:
♦ синтез или выбор экстракционного реагента в органическом разбавителе селективного действия,
♦ регулирование кислотности среды,
♦ различие в скорости экстракции компонентов,
♦ изменение степени окисления необходимого компонента,
|
|
|
♦ маскирование
и др. приемы.
Если два элемента образуют с реагентом экстрагируемые хелаты, то для их разделения при соответствующем значении рН значения рН1/2* должны
* рН1/2 = рН, при котором R = 50%
значительно различаться. При добавлении маскирующего вещества L значение рН1/2 может изменяться. В качестве маскирующих реагентов наиболее широко применяют тартраты, фториды, ЭДТА и др. Они препятствуют экстракции элементов в органическую фазу вследствие образования растворимых в воде прочных (обычно отрицательно заряженных) комплексных соединений. В присутствии L
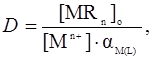
где  ;
;  ,
,  ,…,
,…,  – константы ступенчатого комплексообразования.
– константы ступенчатого комплексообразования.
Отсуда получаем:
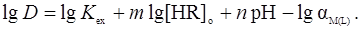
Таким образом, значение рН1/2 увеличивается на  . Поскольку HL является слабой кислотой, то
. Поскольку HL является слабой кислотой, то  возрастает с увеличением рН. В присутствии маскирующего реагента зависимость рН от lgD носит сложный характер и на кривых lgD – pH иногда могут наблюдаться максимумы и минимумы.
возрастает с увеличением рН. В присутствии маскирующего реагента зависимость рН от lgD носит сложный характер и на кривых lgD – pH иногда могут наблюдаться максимумы и минимумы.
В хелатных экстракционных системах можно значительно повысить селективность, используя одновременно два и более маскирующих реагентов. Многие элементы экстрагируются в хлороформ в виде дитизонатов. Введение маскирующих веществ и изменение кислотности водной фазы ограничивает число экстрагируемых элементов (табл. 1).
|
|
|
Таблица 1. Маскирующие реагенты, применяемые при экстракции дитизоном [9]
| Маскирующий реагент | Характеристика водной фазы | Экстрагируемые элементы |
| Бромиды или иодиды | Умеренно кислая | Au, Cu, Pd |
| Тиоцианаты | Умеренно кислая | Au, Cu, Hg |
| Тиоцианаты + цианиды | Умеренно кислая | Cu, Hg |
| Тиосульфат | Слабокислая | Cd. Co, In, Ni, Pd, Sn(II), Zn |
| Тиосульфат + цианид | Слабокислая | Sn(II), Zn |
| ЭДТА | Умеренно кислая | Ag, Hg |
| ДДТК натрия | Щелочная Слабокислая | Zn Bi, Cd, Zn |
| Бис (2-гидроксиэтил)-дитиокарбамат | Слабощелочная | Zn |
Литература
1. Химическая энциклопедия. Том 5 /Под ред. Н.С. Зефирова. – М.: Большая Российская энциклопедия, 1998. – 783с.
2. Фомин В.В. Химия экстракционных процессов / В.В. Фомин. – М.: Атомиздат, 1960. – 166с.
3. Золотов Ю.А. Экстракция внутрикомплексных соединений / Ю.А. Золотов. – М.: Наука, 1968. – 295с.
4. Шевчук И.А. Комплексообразование и экстракция (Спектроскопия ассоциатов). Учебное пособие / И.А. Шевчук – Донецк: ДонГУ, 1973. – 199с.
5. Пилипенко А.Т. Разнолигандные и разнометальные комплексы и их применение в аналитической химии / А.Т. Пилипенко, М.М. Тананайко. – М.: Химия, 1983. – 224с.
|
|
|
6. Гиндин Л.М. Экстракционные процессы и их примнение / Л.М. Гиндин. – М.: Наука, 1984. – 144с.
7. Ягодин Г.А. Основы жидкостной экстракции / Г.А. Ягодин, С.З. Касан, В.В. Тарасов и др.; Под ред. Г.А. Ягодина. – М.: Химия, 1981. – 400с.
8. Золотов Ю.А. Экстракция в неорганическом анализе / Ю.А. Золотов – М.: Изд-во Моск. ун-та, 1988. – 82с.
9. Мицуике А. Методы концентрирования микроэлементов в неорганическом анализе: Пер. с англ. / А. Мицуике – М.: Химия, 1986. – 152с.
10. Основы аналитической химии. Кн. 1. Общие вопросы. Методы разделения: Учебник для ВУЗов / Ю.А. Золотов, Е.Н. Дорохова, В.И. Фадеева и др. Под ред. Ю.А. Золотова. – М.: Высш. шк., 2004 – 361 с.
Дата добавления: 2020-11-15; просмотров: 116; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
