Состав экстрагируемых соединений
Определение состава экстрагируемых соединений имеет важное значение для выяснения химизма экстракционных процессов. Для этого применяют комплекс различных методов анализа и исследования химических соединений в органической фазе [2-8].
♦ Методы, основанные на изучении химических равновесий, закона действия масс. К ним относятся: метод сдвига равновесий, метод молярных отношений, изомолярных серий и др. Необходимо учитывать условия применения и ограничения этих методов.
♦ Химический анализ экстрактов. Этот способ требует насыщения органической фазы соединением аналита. Это достигается многократным встряхиванием органической фазы со свежими порциями водной фазы. Экстрагируемое соединение часто выделяют из экстракта, выпаривая органический растворитель. Анализ проводят на содержание основных и дополнительных компонентов. Для этого используют методы элементного анализа, титриметрии, иногда гравиметрии, фотометрические методы и др. Важное значение имеет постановка контрольных опытов. Так как иногда химическому анализу предшествует выделение экстрагируемого комплекса из органической фазы, то при этом возможно изменение химической формы. Условия при насыщении экстракта могут отличаться от обычных условий экстракции. Эти и другие обстоятельства необходимо учитывать в выводах о составе соединения. Их необходимо дополнить другими методами исследования.
|
|
|
♦ Физико-химические и физические методы изучения экстрактов. Желательно эти методы использовать в реальных условиях экстракции. Широкое распространение получили методы молекулярной абсорбционной спектрофотометрии в УФ- и видимой областях, ИК-спектроскопии, спектроско-пии комбинационного рассеяния, ПМР-, ЯМР-спектроскопии и др.
Криоскопический метод впервые применил Фомин В.В. с сотрудниками. Он позволил определять состав сольватов в предельных случаях, когда экстрагируемое соединение не диссоциирует и не образует ассоциатов в органической фазе [2].
Для определения состава экстрагируемых соединений термодинамическим методом получили распространение расчеты экстракционных систем с помощью ЭВМ.
Скорость экстракции
Экстракция рассматривается как процесс массопередачи, происходящий в результате существования разности химических потенциалов переносимых веществ в фазах.
Состояние равновесия характеризуется термодинамической константой распределения
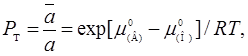
где  и
и 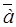 – стандартный химический потенциал и термодинамическая активность распределяемого компонента в извлекающей фазе;
– стандартный химический потенциал и термодинамическая активность распределяемого компонента в извлекающей фазе; 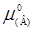 и а – то же для распределяемого компонента в исходной (водной фазе); R – универсальная газовая постоянная; Т – температура.
и а – то же для распределяемого компонента в исходной (водной фазе); R – универсальная газовая постоянная; Т – температура.
|
|
|
Разность химических потенциалов переносимых компонентов в фазах представляет собой движущую силу жидкостной экстракции. Точное определение химических потенциалов в экстракционных системах затруднено.
Для характеристики равновесного распределения используют кривую рановесия или изотерму экстракции (рис. 1) 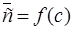 , где
, где 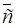 – концентрация вещества в органической фазе; с – в водной фазе.
– концентрация вещества в органической фазе; с – в водной фазе.
На экстракционное равновесие сильное влияние оказывают также коэффициенты активности в фазах, что объясняется относительно небольшим изменением свободной энергии при экстракции (до 11 кДж/моль).
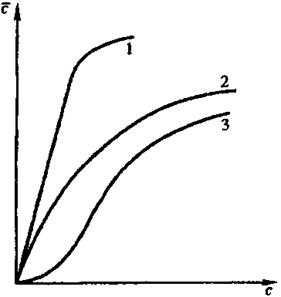
Рис.1. Изотерма экстракции неэлектролитов (1, 2) и электролитов (2, 3)
Жидкостная экстракция протекает во времени. Она сопровождается разнообразными физико-химическими процессами, происходящими на межфазной границе, в прилегающих к ней слоях и в объемах фаз. Для практического ипользования экстракции существенна скорость достижения экстракционного равновесия или кинетика экстракции.
Скорость экстракции определяется:
♦ скоростью химических реакций (химические взаимодействия);
♦ скоростью массопереноса.
|
|
|
Влияние различных факторов на скорость экстракции представлено в работе [10].
На скорость химических реакций можно влиять, увеличивая концентрации взаимодействующих компонентов, подавляя мешающие реакции, например, гидролиза и полимеризации. Ускорить процесс экстракции можно увеличением скорости перемешивания фаз.
В большинстве экстракционных систем равновесие достигается быстро, например, при извлечении ионных ассоциатов. Время экстракции устанав-ливается за несколько минут и менее. В некоторых случаях для достижения равновесия требуется несколько часов. Медленно экстракция протекает для кинетически инертных комплексов, например, хрома(III), платиновых металлов и др. Невысокая скорость также может наблюдаться и при реэкстракции.
На практике изучают зависимость D, R от времени контакта фаз (рис. 2).

Рис. 2. Зависимость коэффициента распределения (а), степени извлечения (б) от времени контакта фаз
Если коэффициенты распределения высоки, то данная зависимость не всегда может дать правильную информацию об установлении равновесия (рис. 3).

Рис. 3. Зависимость логарифма коэффициента распределения от времени контакта фаз
Коэффициент распределения продолжает расти, т.е. равновесия нет, но степень извлечения достигает ~100%.
|
|
|
Представляет интерес проведение исследований для решения вопроса о том, где образуется экстрагируемое соединение – в водной, огранической фазе или на границе их раздела.
Более подробно эти вопросы представлены в литературе [2-8].
Дата добавления: 2020-11-15; просмотров: 168; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
