Нащокин В. В. Техническая термодинамика и теплопередача / Нащокин В. В. – М.: Книга по Требованию, 2013. – 496 с
Практическое занятие №7-8
Название занятия (работы): «Теплоемкость газов и газовых смесей».
Цель работы: Приобретение практических навыков расчета теплоемкостей газов и газовых смесей, количества подведенного или отведенного тепла через массу газа или через объем, приведенный к нормальным условиям.
Исходные данные (задание):
1. Данные для расчетов (по вариантам) взять из таблиц 2.1-2.2.
2. По условиям задач 2.1-2.2 выполнить следующее:
2. 1. Рассчитать теплоемкости газов или газовой смеси;
1. 2. Определить количество подведенного или отведенного тепла.
Задача 2.1.
Для газа массой m, определить среднюю теплоемкость (с помощью таблиц), количество подведенного и отведенного тепла при следующих условиях:
а) газ с давлением р и температурой Т1 нагревается при постоянном давлении до температуры Т2;
б) газ с объемом V и температурой Т2 охлаждается при постоянном объеме до температуры Т1.
Исходные данные взять из табл.2.1. Для определения теплоемкостей использовать таблицу П2-1.
Таблица 2.2.
| № вар-та | Газ | m, кг | а) | б) | ||||
| Р, бар | Т1, К | Т2, К | V, м3 | Т1, К | Т2, К | |||
| 1 | СО | 7,9 | 0,5 | 275 | 395 | 0,1 | 275 | 395 |
| 2 | СО2 | 2,8 | 0,55 | 280 | 400 | 0,15 | 280 | 400 |
| 3 | воздух | 10,4 | 0,6 | 285 | 405 | 0,2 | 285 | 405 |
| 4 | Н2 | 3,6 | 0,65 | 290 | 410 | 0,25 | 290 | 410 |
| 5 | Н2О (вод.пар) | 5,4 | 0,7 | 295 | 415 | 0,3 | 295 | 415 |
| 6 | SO2 | 4,8 | 0,75 | 300 | 420 | 0,35 | 300 | 420 |
| 7 | N2 | 1,2 | 0,8 | 305 | 425 | 0,4 | 305 | 425 |
| 8 | СО2 | 6,3 | 0,85 | 310 | 430 | 0,45 | 310 | 430 |
| 9 | воздух | 8,2 | 0,9 | 315 | 435 | 0,5 | 315 | 435 |
| 10 | O2 | 9,5 | 0,95 | 320 | 440 | 0,55 | 320 | 440 |
|
|
|
Задача 2.2.
Природный (попутный) газ представляет собой газовую смесь, заданную объемными долями компонентов и занимающую объем V, м3. Газ нагревается (охлаждается) при постоянном давлении от температуры t1 до температуры t2.
Определить: газовую постоянную смеси, теплоемкость смеси, количество подведенного или отведенного тепла.
Исходные данные для решения задачи взять из табл.2.2. Объемный состав газа указан в табл.П4.
Таблица 2.2.
| № вар-та | Вид топлива | Месторождение | V, м3 | t1, ºС | t2, ºС |
| 1 | Природный газ | Северо-Ставропольское | 800 | 5 | 62 |
| 2 | Попутный газ | Туймазинское | 1000 | 65 | 14 |
| 3 | Природный газ | Березовское | 1200 | 10 | 88 |
| 4 | Попутный газ | Ромашкинское | 1600 | -2 | 37 |
| 5 | Природный газ | Уренгойское | 1800 | 86 | 19 |
| 6 | Попутный газ | Пермское | 2000 | 13 | 70 |
| 7 | Природный газ | Медвежье | 2200 | 25 | 93 |
| 8 | Попутный газ | Бавлинское | 2500 | 0 | 45 |
| 9 | Природный газ | Оренбургское | 1500 | 74 | 22 |
| 10 | Попутный газ | Узеньское | 900 | -10 | 50 |
Порядок выполнения:
1. Выполнить задание в соответствии с данными своего варианта (см. таблицы 2.1-2.2).
|
|
|
2. Ответить письменно на контрольные вопросы.
Вопросы для повторения:
1. Понятие массовой, объемной и мольной теплоемкостей.
2. От каких параметров зависит теплоемкость идеального и реального газа?
3. Понятие истинной и средней теплоемкости. В чем различие между ними?
4. Как определить по таблице средних теплоемкостей теплоемкость оксида углерода (СО) при 580 °С?
5. Как определяются массовая и объемная теплоемкости смеси?
Литература:
Основные источники:
Нащокин В. В. Техническая термодинамика и теплопередача / Нащокин В. В. – М.: Книга по Требованию, 2013. – 496 с
Дополнительные источники:
Арнольд Л.В., Михайловский Г.А., Селиверстов В.М. Техническая термодинамика и теплопередача, М, Высшая школа, 1979, - 446 с.
2. А.Ф. Гогин Судовые дизели, М. Транспорт, 1988.
Интернет-ресурсы:
1.Электронный ресурс «Измерительный инструмент» - Режим доступа: http://www.chelzavod.ru/.
2.Электронный ресурс «Мега Слесарь» - Режим доступа: http://www.megaslesar.ru/.
3.Электронный ресурс «Понятия о допусках и посадках основные термины» - Режим доступа: http://cxt.telesort.ru/vdovichenkovaucheb/Dopuski.htm.
4.Электронные ресурсы «Теоретические основы теплотехники», форма доступа: http://03-ts.r.
5.Электронный ресурс «Материаловедение» - Режим доступа: http://www.materialcince.ru.
|
|
|
Пример выполнения работы:
Задача №1. Газ при начальном давлении р1=100 кПа занимает объем V1=0,05 м3. При каком давлении он займет объем V2=0,35 м3, если температура газа постоянна?
Решение:
Т.к. T=const, то газ подчиняется з-ну Бойля-Мариотта и его параметры связаны соотношением 
Отсюда 
Задача №2. При давлении р1=5 бар, газ имеет температуру t1=25 ºС. Определить температуру этого газа при давлении р2=8 бар, если его объем не изменяется.
Решение:
При V=const, газ подчиняется з-ну Шарля и его давления прямо пропорциональны абсолютным температурам 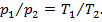
Выполняем перевод единиц измерений в систему СИ (см.табл.П1-1).
р1= 5 бар=5·0,1·105=0,5·105 Па; р2= 8 бар=8·0,1·105=0,8·105 Па; Т1=25+273=298 К.

Задача №3. Метан (СН4) при давлении р=1 ат и температуре t=20 ºC занимает объем V=400 л. Определить массу метана и силу тяжести газа.
Решение:
Выполняем перевод единиц измерений в систему СИ (см.табл.П1-1).
р=1 ат=9,8·104 Па; T=20+273=293 К; V=0,4 м3.
Молярную массу метана определим по табл.П2.
μ=16 кг/кмоль.
Газовую постоянную метана находим по формуле  Дж/(кг·К).
Дж/(кг·К).
Массу метана определяем из уравнения состояния

Откуда  кг.
кг.
По з-ну Ньютона находим силу тяжести газа
 Н.
Н.
Задача №4. Газ при температуре t1=30 ºC занимает объем V1=500 cм3. Какой объем он займет при температуре t2=5 ºC, если его давление при этом не меняется?
|
|
|
Решение:
При p=const газ подчиняется з-ну Гей-Люссака и его объемы прямо пропорциональны абсолютным температурам 
Выполняем перевод единиц измерений в систему СИ (см.табл.П1-1).
Т1=30+273=303 К; Т2=5+273=278 К; V1=500·10-6 м3.
Конечный объем  м3.
м3.
Задача №5. Дымовые газы представляют собой смесь массой m=2 кг, занимающей объем V=10 м3 при температуре Т=700 К. Объемный состав смеси: 
Определить газовую постоянную смеси Rсм, давление смеси рсм и парциальные давления компонентов смеси.
Решение:
Т.к. смесь задана объемными долями, то применяем следующий порядок расчета:
1) по табл.П2 определяем молярные массы компонентов

2) определяем молярную массу смеси по формуле

3) находим газовую постоянную смеси по формуле

4) давление смеси определяем из уравнения состояния для смеси

Откуда 
5) Определим парциальные давления компонентов:

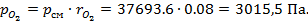

Задача №6. Кислород (О2) массой m=10 кг нагревается при постоянном давлении от температуры Т1=273 К до температуры Т2=313 К.
Определить с помощью таблиц среднюю теплоемкость газа и рассчитать количество подведенного при нагреве тепла.
Этот же газ объемом V=10 м3 охлаждается при постоянном объеме от температуры t1=45 ºС до температуры t2=15 ºС.
Определить количество отведенного тепла от газа, считая теплоемкость постоянной.
Решение:
Первый случай.
1) По табл.П3 определяем массовую изобарную теплоемкость кислорода при средней температуре (Тср=(Т1+Т2)/2=(273+313)/2=343 К=(343-273)=70 ºС).
ср=0,9257 кДж/(кг·К).
2) Количество подведенного тепла определим по формуле

Второй случай.
1) Т.к. кислород – двухатомный газ, то его объемная изохорная теплоемкость может быть определена по формуле табл.П1-2
 кДж/(кг·К).
кДж/(кг·К).
2) Количество отведенного тепла определим по формуле

Задача №7. Какое количество тепла необходимо подвести к 500 м3 природного газа состава: СН4=92,8 %; С2Н6=3,9 %; С3Н8=1,0 %; С4Н10=0,4 %; С5Н12=0,3 %; СО2=0,1 %; N2=1,5 %; чтобы нагреть его от температуры t1=20 ºС до температуры t2=1500 ºС? Теплоемкости компонентов считать постоянными.
Решение:
1) Определяем объемную теплоемкость смеси по формуле

Введем следующие обозначения:
 – объемная теплоемкость и объемная доля метана (СН4);
– объемная теплоемкость и объемная доля метана (СН4);
 - объемная теплоемкость и объемная доля этана (С2Н6);
- объемная теплоемкость и объемная доля этана (С2Н6);
 - объемная теплоемкость и объемная доля пропана (С3Н8);
- объемная теплоемкость и объемная доля пропана (С3Н8);
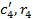 - объемная теплоемкость и объемная доля бутана (С4Н10);
- объемная теплоемкость и объемная доля бутана (С4Н10);
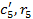 - объемная теплоемкость и объемная доля пентана (С5Н12);
- объемная теплоемкость и объемная доля пентана (С5Н12);
 - объемная теплоемкость и объемная доля углекислого газа (СО2);
- объемная теплоемкость и объемная доля углекислого газа (СО2);
 - объемная теплоемкость и объемная доля азота (N2).
- объемная теплоемкость и объемная доля азота (N2).
Объемные теплоемкости компонентов определим в зависимости от атомности газов. Значения  для этого берем из табл.П1-2.
для этого берем из табл.П1-2.
Метан, этан, пропан, бутан, пентан и углекислый газ – трех- и многоатомные газы, поэтому 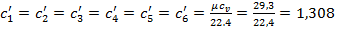 кДж/(м3·К).
кДж/(м3·К).
Азот – двухатомный газ, для него объемная теплоемкость  кДж/(м3·К).
кДж/(м3·К).
 кДж/(м3·К).
кДж/(м3·К).
2) Рассчитываем количество подведенного тепла по формуле

Практическое занятие №3
Название занятия (работы): «Расчет термодинамических процессов».
Цель работы: Приобретение практических навыков расчета основных термодинамических процессов.
Исходные данные (задание):
1. Данные для расчетов (по вариантам) взять из таблиц 3.1-3.4.
2. По условиям задач выполнить следующее:
2.1. Определить недостающие параметры состояния;
2.2. Определить количество тепла, совершенную работу в процессе и изменение внутренней энергии;
2.3. Изобразить процессы в pV-диаграмме.
Задача 3.1. Изотермически сжимают V м3 газа с Р1= 2,0 кПа до Р2, кПа. Температура газа t , °С.
Вычислить:
1) параметры газа в начале и конце процесса;
2) работу, затраченную на сжатие;
3) количество тепла, выделенное при сжатии.
4) построить процесс в pV-диаграмме.
Исходные данные взять из табл. 3.1.
Таблица 3.1.
| № вар-та | Газ | р2, кПа | t, °С | V, м3 |
| 1 | Воздух | 100 | 20 | 150 |
| 2 | Водород | 110 | 30 | 200 |
| 3 | Кислород | 120 | 40 | 250 |
| 4 | Аммиак | 130 | 50 | 300 |
| 5 | Азот | 140 | 60 | 350 |
| 6 | Углекислый газ | 150 | 50 | 400 |
| 7 | Метан | 160 | 40 | 450 |
| 8 | Бутан | 170 | 30 | 500 |
| 9 | Пропан | 180 | 20 | 550 |
| 10 | Сероводород | 190 | 10 | 600 |
Задача 3.2. В автоклаве объемом V находится газ под давлением P1 кПа и t1 °С. При нагревании (V=const) давление в автоклаве поднялось до Р2 кПа.
Определить:
1) сколько тепла сообщено газу в автоклаве;
2) до какой температуры нагреется газ.
3) построить процесс в pV-диаграмме.
Исходные данные взять из табл. 3.2.
Таблица 3.2.
| № вар-та | газ | V, м3 | р1, кПа | t1, °С | р2, кПа |
| 1 | H2S | 0,06 | 20 | 10 | 120 |
| 2 | NH3 | 0,05 | 25 | 15 | 130 |
| 3 | CO | 0,04 | 30 | 25 | 140 |
| 4 | CO2 | 0,03 | 35 | 30 | 155 |
| 5 | He | 0,02 | 40 | 40 | 115 |
| 6 | Ne | 0,04 | 45 | 50 | 135 |
| 7 | CH4 | 0,06 | 50 | 60 | 165 |
| 8 | C2H2 | 0,08 | 55 | 70 | 205 |
| 9 | C3H8 | 0,05 | 60 | 80 | 190 |
| 10 | О2 | 0,1 | 65 | 30 | 180 |
Задача 3.3. Газ с начальным давлением р1, ат и начальной температурой t1, °С, расширяется при постоянном давлении от начального объема V1, м3 в n раз.
1) Определить:
- конечные параметры газа;
- работу, затраченную на расширение L;
- тепло, участвующее в процессе Q;
- изменение внутренней энергии ΔU.
2) Построить процесс pV-диаграмме.
Исходные данные взять из табл. 3.3.
Таблица 3.3
| № вар-та | Газ | V1, м3 | n | р1, ат | t1, °С |
| 1 | Воздух | 0,1 | 2 | 20 | 48 |
| 2 | Аргон | 0,12 | 1,5 | 22 | 24 |
| 3 | Бутан | 0,14 | 1,7 | 24 | 39 |
| 4 | Пропан | 0,16 | 3,0 | 35 | 54 |
| 5 | Сероводород | 0,2 | 3,5 | 31 | 18 |
| 6 | Углекислый газ | 0,23 | 2,2 | 28 | 26 |
| 7 | Аммиак | 0,26 | 2,4 | 42 | 35 |
| 8 | Азот | 0,32 | 2,6 | 56 | 44 |
| 9 | Водород | 0,41 | 1,8 | 33 | 60 |
| 10 | Кислород | 0,58 | 4,0 | 10 | 74 |
Задача 3.4. Газ массой m, кг с начальным давлением р1, атм и начальной температурой Т1, К сжимается и объем газа уменьшается в 2 раза.
Определить:
1) Начальные и конечные параметры газа;
2) Количество тепла в процессе;
3) Совершенную работу и изменение внутренней энергии, если сжатие происходит
А) по адиабате c показателем адиабаты К=1.4;
Б) по политропе с показателем политропы m=1.2.
4) Изобразить процессы в pV-диаграмме.
Исходные данные взять из табл. 3.4.
Таблица 3.4
| № вар-та | Газ | m, кг | р1, атм | Т1, К |
| 1 | Воздух | 2,5 | 0,5 | 288 |
| 2 | Азот | 5,0 | 0,8 | 302 |
| 3 | Водород | 3,6 | 1,1 | 290 |
| 4 | Углекислый газ | 4,1 | 0,3 | 314 |
| 5 | Сероводород | 1,8 | 0,4 | 295 |
| 6 | Метан | 2,7 | 0,6 | 306 |
| 7 | Аргон | 3,3 | 1,0 | 284 |
| 8 | Гелий | 5,6 | 0,2 | 310 |
| 9 | Оксид углерода | 1,5 | 0,7 | 325 |
| 10 | Аммиак | 7,4 | 0,9 | 300 |
Порядок выполнения:
1. Выполнить задание в соответствии с данными своего варианта (см. табл. 3.1 – 3.4).
2. Ответить на контрольные вопросы (письменно).
Вопросы для повторения:
1. Понятие изохорного, изобарного, изотермического и адиабатного процессов.
2. Назначение pV-диаграммы.
3. Понятие политропного процесса.
4. Показатель адиабаты. Почему он всегда больше единицы для любых газов?
5. Почему адиабата идет круче изотермы в pV-диаграмме.
Литература:
Основные источники:
Нащокин В. В. Техническая термодинамика и теплопередача / Нащокин В. В. – М.: Книга по Требованию, 2013. – 496 с
Дополнительные источники:
Дата добавления: 2020-04-25; просмотров: 1238; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
