Основные реакции аминокислот.
A -аминокислоты.
Белки составляют материальную основу химической деятельности клетки. Функции белков в природе универсальны.
К настоящему времени достигнуты большие успехи в установлении соотношения структуры и функций белков, механизма их участия в важнейших процессах жизнедеятельности организма и в понимании молекулярных основ патогенеза многих болезней.
Пептиды и белки построены из остатков a-аминокислот.
Общее число встречающихся в природе аминокислот превышает 100? (в др. источниках » 300), в организме человека приблизительно 70 аминокислот и их производных. Но выделяют группу наиболее важных аминокислот - их 20 - которые постоянно встречаются во всех белках.
a- аминокислоты – это гетерофункциональные соединения, содержащие группы СООН и NH 2 у одного и того же атома углерода.
СЛАЙД № 1
a
R – CH – COOH
| кислотная
NH2 функция
основная
функция
Все 20 природных a-аминокислот оптически активны и относятся к L-стереохимическому ряду (кроме глицина):
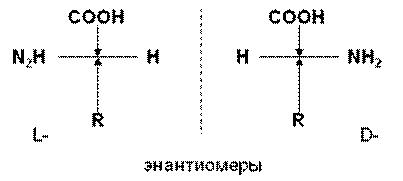
Формулы важнейших аминокислот см. учебник, стр. 299, табл. 22.
Классификация a -аминокислот.
Классификация a-аминокислот основывается на нескольких принципах.
СЛАЙД № 2
І. По химической структуре радикала ( R ) различают:
|
|
|
а) ароматические:фенилаланин, тирозин.
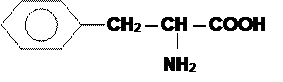 | ||||
| ||||
б) алифатические: глицин, аланин, валин, серин, глутаминовая кислота.
СООН – СН2 – СН2 - СН – СООН
|
NH 2
глутаминовая кислота
в) гетероциклические: триптофан, гистидин, оксипролин, пролин.
 |
|



СЛАЙД № 3
ІІ.По кислотно-основным свойствам различают нейтральные, основные и кислые аминокислоты.
а) нейтральные – это моноаминокарбоновые кислоты:
глицин серин
аланин треонин
валин аспарагин
лейцин глутамин
изолейцин пролин
метионин триптофан
фенилаланин
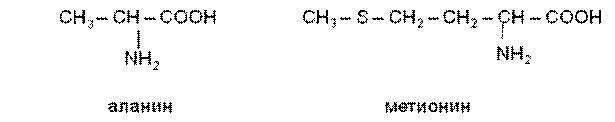
б) основные – это диаминомонокарбоновые кислоты, несущие положительный заряд: аргинин, гистидин, лизин.
NH2 – (CH2)3 – CH2 – CH – COOH
|
|
|
|
NH 2
лизин
в) кислые – это моноаминодикарбоновые кислоты, несущие отрицательный заряд: аспарагиновая кислота, глутаминовая кислота, цистеин, тирозин.
НООС – СН2 – СН – СООН
|
NH 2
аспарагиновая кислота
СЛАЙД № 4
ІІІ. В зависимости от полярности радикалов, т.е. способности их к взаимодействию с водой, аминокислоты делят на:
а) неполярные (гидрофобные): аланин, валин, лейцин, изолейцин, серин, глутамин, аспарагин и др.;
б) полярные (гидрофильные): аспарагиновая кислота, глутаминовая кислота, лизин, аргинин, тирозин и др..
IV . С понятием биологической ценности белков аминокислоты делят на:
а) незаменимые (их 8): валин, изолейцин, лейцин, лизин.
метионин, треонин, триптофан, фенилаланин,
аргинин, гистидин;
б) заменимые.
В организме человека синтезируется 10 из 20 необходимых аминокислот, их называют заменимыми.
Остальные 10, которые не синтезируются в организме, должны поступать извне, поэтому были названы жизненно необходимыми или незаменимыми: аргинин, гистидин, изолейцин, лейцин, метионин, треонин, триптофан, фенилаланин, валин, лизин.
|
|
|
Две из них – аргинин и гистидин – являются частично незаменимыми.
Ионные свойства аминокислот.
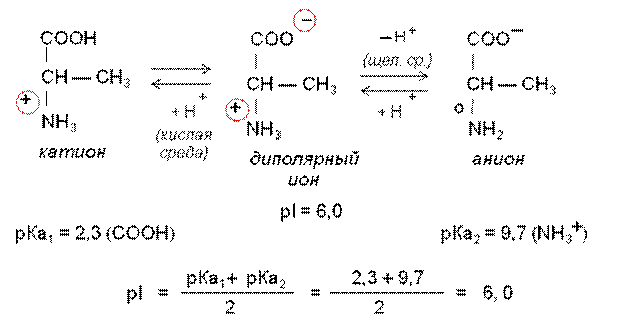
Аминокислоты легко растворимы в воде и в водном растворе они существуют в виде равновесной смеси биполярного иона, катионной и анионной форм. Положение равновесия зависит от рН среды.
Все a-аминокислоты в сильнокислой среде (рН = 1 – 2) находятся в катионной форме, а в сильнощелочной среде (рН = 13 – 14) – в анионной форме.
Аминокислоты при рН = 7,0 – 7,4 имеют структуру биполярного иона или цвиттериона.
|
|

 СЛАЙД № 5
СЛАЙД № 5  |  | ||||||
 | |||||||
| |||||||
|
|
|
|
|



|
|
|
|


|
|
|
|
Соотношение различных форм a-аминокислот в водном растворе при определенных значениях рН зависит от наличия в радикале ионогенных групп, которые играют роль дополнительных кислотных или основных центров.
|
|
|
Значение рН, при котором концентрация биполярных ионов максимальна, а минимальные концентрации катионных и анионных форм аминокислоты равны между собой, называют изоэлектрической точкой белка (ИЭТ, р Ĵ).
В ИЭТ суммарный заряд молекулы равен 0, и она не перемещается в электрическом поле ни к аноду, ни к катоду – изоэлектрическое состояние.
СЛАЙД № 6
Основные реакции аминокислот.
І. Реакции аминогруппы.
1) Ацилирования (образования N-ацил-производных аминокислот).
СЛАЙД № 7
O
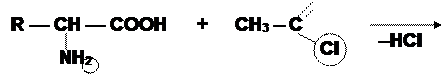 | |||||
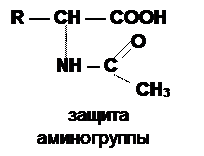 | |||||
| |||||
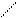
2) Взаимодействие с альдегидами. (Образование оснований Шиффа)
Реакция присоединения – отщепления.
СЛАЙД № 8
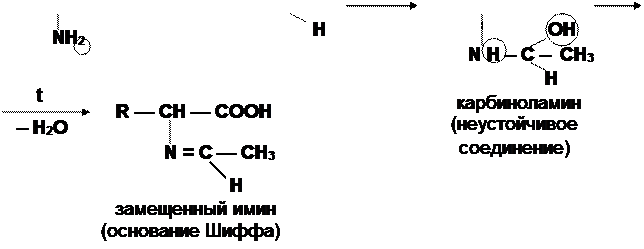
H +
R — CH — СООH
CH3 – C
+
R — CH — СООH
O
Практическое значение имеет реакция с формальдегидом, которая лежит в основе количественного определения a-аминокислот методом формольного титрования (метод Сёренсона):
СЛАЙД № 9
O
 |
3) Действие азотистой кислоты или дезаминирование in vitro .
Азотистая кислота разлагает аминокислоты с выделением свободного азота. Эта реакция также для количественного определения по методу Ван-Слайка.
По объему выделившегося азота судят о количестве вступившей в реакцию аминокислоты.
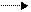 СН 3 – СН – СООН + HONO CH3 – CH – COOH + N2 + H2O
СН 3 – СН – СООН + HONO CH3 – CH – COOH + N2 + H2O
| |
NH 2 OH
аланин гидроксикислота
(2-гидроксипропановая)
4) Образование гиппуровой кислоты.
В организме гиппуровая кислота синтезируется в печени. Она представляет собой продукт соединения глицина и бензойной кислоты:
СЛАЙД № 10
 | ||||||||
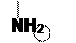 |  | |||||||
| ||||||||
|
|
|
|
|
|
В норме в печени происходит обезвреживание бензойной кислоты глицином и образовавшаяся гиппуровая кислота выводится с мочой. При поражении печени образование гиппуровой кислоты в моче резко падает.
Дата добавления: 2020-04-25; просмотров: 211; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
