Приближенные методы описания кинетики сложных реакций
Принцип независимости протекания отдельных стадий химического процесса.
(Принцип независимости)
Если в системе протекают несколько элементарных стадий, то каждая из них протекает независимо от других, подчиняясь основному постулату химической кинетики – ЗДМ (закон действующих масс). Этот принцип имеет ограничения, в частности, он не применим к сопряженным реакциям.
 =
= 
В этом уравнении, ( ±) стоящий перед выражением скорости простой реакции:
r = ± 1/( n I )* dCi / d t переходит в значение c техиометрического коэффициента ( n I )
Для исходных веществ берем (-n I ) и
Для продуктов реакции берем (n J )
Обратимые реакции
k1
Кинетика обратимой реакции первого порядка A = B
k-1
где r1 = k1CA и где r-1 = k-1CВ . WA = - r1 + r-1 = - k1CA + k-1CВ
Интегральное уравнение имеет вид :
 =
=  = t
= t  (1)
(1)
Для нахождения индивидуальных констант необходимо второе уравнение : K 1 = k 1 / k -1
При обработке данных по интегральному уравнению (1) получим систему уравнений из которых найдем индивидуальные константы скорости:
tga = k1 +k-1
K1 = k1/k-1 = CµB / CµA
Пример. Для реакции А = В получены следующие зависимости концентрация В от времени:
|
|
|
| τ, мин | 0 | 21 | 36 | 50 | 65 | 80 | 100 | 160 | 220 | ∞ |
| [В]*102,М | 0 | 2,41 | 3,73 | 4,99 | 6,10 | 7,08 | 9,11 | 10,35 | 11,55 | 13,28 |
Начальная концентрация кислоты 0,1823 М. Определите константы скорости прямой и обратной реакции.
Решение:
Найдем константу равновесия по уравнению:
K1 = C µ B / C µ A = C µ B /(C0A - C µ B ) = 13,28*10-2/(0,1823-13,28*10-2) = 2,68
Для двух точек с временами 21 и 36 мин найдем k1 +k-1 :
t = 21 мин (k1 +k-1 ) = ln [( 13,28 )/(13,28 – 2,41)] / 21 = 9,5*10-3 мин-1
t = 36 мин (k1 +k-1 ) = ln [( 13,28 )/(13,28 – 3,73)] / 36 = 9,16 *10-3 мин-1
(k1 +k-1)ср = 9,33 *10-3 мин-1
K1 = k1/k-1 = 2,68 k1= k-1 *2,68 и (k1 +k-1) = (k-1*2,68 + k-1 ) = k-1*3,68 = 9,33 *10-3
k-1 = 9,33 *10-3 /3,68 = 2,54*10-3 мин-1 и k1 = (9,33 *10-3 - k-1) = 6,79*10-3 мин-1
Параллельные реакции
Кинетика параллельной реакции первого порядка описывается уравнением:
lnCA = lnCA0 - 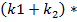
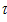 (2)
(2)
Для нахождения индивидуальных констант необходимо второе уравнение:
Для любого времени t отношение (СВ/CC)t = k1/k2 , где СВ и CC концентрации продуктов В и С в момент времени t.
При обработке данных по интегральному уравнению (2) получим систему уравнений, из которых найдем индивидуальные константы скорости:
tga = k1 +k2
Пример. Муравьиная кислота на окисных катализаторах разлагается в соответствии со
схемой:
|
|
|
HCOOH à CO2 + H2 ( k1)
HCOOH à CO + H2O ( k2)
В одном из опытов за 15,4 с выход С02 составил 77,5 % от теоретического, а СО - 2,6 %. Вычислите константы скоростей дегидратации и дегидрирования муравьиной кислоты.
Решение:
Найдем отношение констант скоростей : (ССо2/CСО)t=15,4 = k1/k2 = 77,5/2,6 = 29,81
lnCA = lnCA0 - 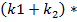
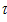 отсюда ln(CA0/CA) = (k1 +k2)t
отсюда ln(CA0/CA) = (k1 +k2)t
Концентрацию CHCOOH найдем по уравнению МБ: C0HCOOH = CHCOOH + CCO2 + CCO =100 %
Отсюда CHCOOH = C0HCOOH - CCO2 -CCO =(100 – 77,5 – 2,6)% = 19,9 %
k1 +k2 = ln(CA0/CA)/t = ln(100/19,9)/15,4 = 0,1048 с-1
k1/k2 = 29,81 отсюда k1 = 29,81*k2
k1 +k2 = 29,81*k2 +k2 = 30,81*k2 ;
30,81*k2 = 0,1048 отсюда k2 = 0,1048/30,81 = 3,40 *10-3 c-1 и k1 = 0,1048 - k2 = 0,1014 c-1
Ответ: k2 = 3,40 *10-3 c-1 и k1 = 0,1014 c-1
Последовательные (консекутивные) реакции – это реакции, протекающие таким образом, что продукт одной стадии является реагентом для другой.
k1 k2
A à P à B
В данной реакции A превращается в B через образование некоторого промежуточного продукта P.

•  =
=  exp(-k1 t )
exp(-k1 t )
•  =
=  -
-  ]
]
•  =
=  -
-  -
- 
 =
=  à
à 

Характер кривой промежуточного продукта Р носит экстремальный характер, а вещества В носит S- образный характер
Пример: В газовой фазе протекает последовательная реакция: А à P à C
|
|
|
Для опыта были взяты 2 молей газа А. Константы скорости отдельных стадий реакции соответственно равны: k1 = 0,012 с-1 и k2 = 0,20 с-1. Рассчитайте время достижения максимальной концентрации вещества P и концентрации веществ А и С к этому моменту времени?
Решение: Рассчитаем концентрацию и время достижения точки max:
tmax = ln(k2 / k1 )/( k2 - k1 ) = ln(0,2 /0,012)/( 0,2 -0,012) = 14,96 с
CPmax = C0A *( k2 / k1 )1/(1- k2/k1 ) = 2*(0,2 /0,012)[1/(1-0,012/0,2)] =2*(16,67)-0,0638
ln CPmax = ln2 -0,0638*ln16,67= 0,5136 à CPmax = 1,67 моль/л
Для случая последовательной реакции скорость каждой элементарной стадии :
r1 = k1CA ; r2 = k2CP
В соответствии с принципом независимости протекания отдельных стадий скорость реакции по каждому компоненту может быть записана:
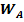 = -
= - 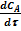 = -r1 = k1CA;
= -r1 = k1CA;
 = r1 –r2 = k1CA - k2CP
= r1 –r2 = k1CA - k2CP
 = r2 = k2CP
= r2 = k2CP
Кривая накопления продукта Р проходит через max. Кривая для продукта В имеет S – образный характер, что является критерием последовательной реакции.


1. k 2 / k 1 = 0,04 2. k 2 / k 1 = 0,6 3. k 2 / k 1 = 10
В зависимости от отношения констант скорость концентрация промежуточного продукта Р существенно меняется и увеличении отношения k 2 / k 1 концентрация Р становится очень маленькой и следовательно, скорость по Р можно считать равной нулю.
|
|
|
На этом основании был предложен метод стационарных концентраций (МСК) [М. Боденштейн, 1913 г.]
Если  >> 1 (велико) и при t >
>> 1 (велико) и при t >  концентрация промежуточного вещества Р становится очень маленькой и ее можно считать постоянной в течение протекания реакции, то можно считать, что выполняются условия:
концентрация промежуточного вещества Р становится очень маленькой и ее можно считать постоянной в течение протекания реакции, то можно считать, что выполняются условия:
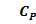 @
@  и
и 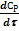 = 0
= 0
Обеспечить постоянство концентрация промежуточного вещества СР в закрытом реакторе практически невозможно и поэтому для предосторожности говорят об установлении квазистационарного режима и тогда метод на его основе можно назвать методом квазистационарных концентраций (МКСК)
МКСК позволяет заметить часть дифференциальных уравнений для скорости по высокореакционным промежуточным веществам на алгебраические уравнения. Условия для реализации МКСК:
k 2 >> k 1 и WA >> WP и тогда WP ~ 0
Приближенные методы описания кинетики сложных реакций
1. Метод квазистационарных концентраций
2. Метод квазиравновесных концентраций
3. Метод лимитирующей стадии.
Рассмотрим применение методов на примере следующего механизма реакции:
Договоримся, что для простоты будем обозначать высокореакционные промежуточные продукты латинскими буквами – X, Y, Z.
k1
A + B = X
k-1
k2
X + A à Пр
Это эквивалентно записи:
A + B à X r1 = k1CACB
X à A + B r-1 = k-1CX
X + A à Пр r2 = k2 CACX
Задача: вывести уравнение для скорости образования продукта WПр = ?
Решение:
Метод квазистационарных концентраций: WX = 0
WX = r1 - r-1 - r2 = k1CACB - k-1CX - k2CACX =0
CX = k1CACB /(k-1 + k2CA ); WПр = r2 = k2CACX
WПр = k1 k2 CA2 CB /( k-1 + k2 CA )
Вывод: Концентрация вещества находящегося в знаменателе – тормозит реакцию.
В нашем случае реакция тормозится веществом исходным веществом А
Если промежуточных высокореакционных частиц несколько, то условие стационарности пишем для каждого такого вещества.
Пример механизма:
k1
A + С = X +D
k-1
k2
X +A → Y + C
k3
Y + D → P
Дата добавления: 2019-11-16; просмотров: 963; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
