Исследование спектального состава биоткани методом флуоресцентной спектроскопии
Цель работы
Углубление теоретических знаний в области оптической неинвазивной диагностики, а именно флуоресцентной спектроскопии (ФС); приобретение практических навыков регистрации и обработки данных на многофункциональном лазерном неинвазивном диагностическом комплексе «ЛАКК-М» с помощью специализированного программного обеспечения.
Содержание работы
Проведение исследования спектального состава биоткани методом флуоресцентной спектроскопии Работа с полученными данными в специализированной программе многофункционального лазерного диагностического комплекса «ЛАКК-М».
Экспериментальное оборудование
Комплекс многофункциональный лазерный диагностический «ЛАКК-М» (ООО НПП «ЛАЗМА», г. Москва), ПК с установленным программным обеспечением для регистрации и обработки информации многофункционального лазерного диагностического комплекса «ЛАКК-М» (версия 3.0.2.334 и выше).
Подготовка к работе
Самостоятельная подготовка студентов к выполнению лабораторной работы осуществляется по следующим темам раздела «Биомедицинская оптическая диагностика»:
- биомедицинская оптическая диагностика [8];
- флуоресцентная спектроскопия [8];
- обработка биомедицинских сигналов [13].
Вопросы для самопроверки
1) Сформулируйте физический принцип, заложенный в основу метода флуоресцентной спектроскопии.
2) Перечислите основные флуорофоры, вносящие вклад в формирование спектра флуоресценции биотканей.
|
|
|
3) Какие факторы влияют на формирование спектра флуоресценции?
4) Перечислите основные медицинские приложения метода флуоресцентной спектроскопии?
Теоретическая часть работы
Флуоресцентная спектроскопия
Флуоресцентная спектроскопия основана на зондировании биообъекта излучением в видимой области спектра с целью возбуждения эндогенных и экзогенных флуоресцирующих биомаркеров кожи (NADH, флавины, липофусцины, порфирины и др.) и регистрации спектров флуоресценции. Данный метод позволяет регистрировать и анализировать in vivo содержание в тканях и органах веществ, определяющих метаболизм и жизнеспособность клеток и тканей [16].
Многие биомаркеры характеризуются близкими или перекрывающимися областями поглощения и флуоресценции, в результате выходящее из ткани излучение имеет сложный спектральный состав. Сигнал представляет собой суперпозицию спектров флуоресценции разных природных компонентов биоткани, таких как коллаген, эластин, никотинамид (NADH) и т.д., имеющих разные интенсивности флуоресценции на разных длинах волн (рисунок 3.8) [8].
Для регистрации флуоресценции диагностические системы содержат в своем составе малогабаритные оптоволоконные спектроанализаторы, которые позволяют регистрировать и количественно измерять интенсивности обратно рассеянного тканями исходного (возбуждающего) излучения и излучения флуоресценции как функцию длины волны, т.е. определять спектральную плотность мощности вторичного излучения от биоткани.
|
|
|
Упрощенная блок-схема такого спектроанализатора представлена на рисунке 4.7 [16]. Для возбуждения флуоресценции в тканях in vivo сегодня, как правило, используется маломощные (мощность P < 10 мВт) непрерывные лазеры на выбранную длину волны или узкополосные светодиодные излучатели. Это наиболее дешевое конструктивное решение, позволяющее использовать оптоволоконные зонды для транспортировки излучения к биоткани и обратно. Диагностический комплекс «ЛАКК-М», например, содержит несколько таких лазерных и светодиодных источников излучения на длины волн λ = 365, 450, 532 и 635 нм. Излучение от лазеров 1 доставляется к поверхности биоткани 2 по осветительному световоду 3, являющемуся одной из жил (обычно центральной) многожильного оптоволоконного зонда 4, содержащего, кроме осветительного, ещё и набор приёмных оптических волокон 5, по которым регистрируемое от биоткани вторичное излучение (рассеянное, флуоресценции), формирующееся в диагностическом объёме биоткани 6, доставляется в полихроматор 7. Внутри полихроматора излучение проходит пороговый обрезающий оптический фильтр 8, ослабляющий исходное излучение на длине волны генерации лазера примерно в 1000 раз, и разлагается в спектр диспергирующим элементом 9 – дифракционной решёткой. Далее весь этот спектр регистрируется линейным фотоприёмником 10, преобразуется в электрический сигнал пропорционально падающей на фотоприёмник спектральной плотности мощности, электрический сигнал усиливается усилителем 11 и через стандартное устройство сопряжения подается для дальнейшей обработки в компьютер 12. Благодаря матричному многоэлементному фотоприёмнику и полихроматору весь спектр вторичного излучения, включая и спектр флуоресценции, можно сразу наблюдать на экране монитора компьютера в реальном времени.
|
|
|

Рисунок 4.7 – Блок-схема лазерного спектроанализатора
для in vivo флуоресцентной спектроскопии в клинике
На рисунке 4.8 приведен пример регистрируемого in vivo каналом спектроанализатора комплекса «ЛАКК-М» спектра вынужденной эндогенной флуоресценции кожи хвоста белой лабораторной крысы при наличии в области обследования очага воспаления [16].
|
|
|
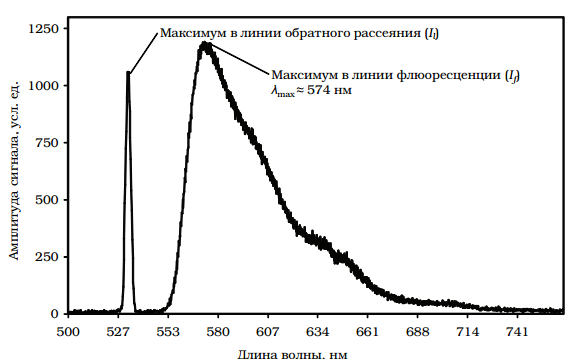
Рисунок 4.8 – Вид спектра флуоресценции на экране монитора.
Возбуждение флуоресценции в линии 532 нм. (Предположительно люминесценция липофусцина)
На графике отчётливо прослеживаются два максимума спектральной плотности мощности. Первый – Il, более острый, представляет собой зарегистрированное обратно рассеянное кожей излучение на длине волны генерации лазера (в данном примере 532 нм, зеленый диапазон спектра). Второй – If, более пологий, располагается правее в более длинноволновой области спектра и является следствием наличия большой концентрации в коже хвоста крысы эндогенных флуорофоров, в данном случае, наиболее вероятно, липофусцина. Для нормальных (здоровых) тканей величина If(λ) в этом спектральном диапазоне длин волн обычно существенно меньше представленной на графике. Чаще всего она незначительно проявляется на уровне фона (нуля) или регистрируется чуть выше нуля с амплитудой сигнала, не превышающей 100 усл. ед. Провал же на графике рисунка 4.8 между длинами волн 532 нм и 550 нм обусловлен наличием в конструкции прибора, обрезающего порогового оптического фильтра 8 (рисунок 4.7). Этот фильтр необходим, чтобы примерно выровнять по амплитудам If и Il. Он не влияет на спектр флуоресценции (в данном примере в области длин волн больше 570 нм), немного искажает левый край спектра (область от 550 до 570 нм), но ослабляет Il примерно в 1000 раз. В противном случае интенсивность флуоресценции была бы не видна на фоне мощного рассеянного лазерного излучения, т.к. реальные интенсивности обратно рассеянного возбуждающего излучения в тысячи раз больше интенсивности флуоресценции.
Таким образом, флуоресцентная диагностика позволяет оценивать интенсивность излучения флуоресценции никотинамидов, флавинов, липофусцина, порфиринов и других ферментов.
Для оценки утилизации кислорода используется флуоресцентный показатель потребления кислорода (ФПК) ферментов, участвующих в дыхательной цепи, который обратно пропорционален редокс-отношению:
ФПК = АНАД-Н / Афлавины, (4.15)
где АНАД-Н – амплитуда излучения флуоресценции восстановленного кофермента никотинамидадениндинуклеотида;
Афлавины – амплитуда излучения флуоресценции окисленных флавопротеинов.
Для оценки флуоресценции применяется также коэффициент флуоресцентной контрастности биоткани, определяемый по формуле:
Kf = 1 + (If – Il) / (If + Il), (4.16)
где If – максимум (пик) интенсивности в линии флуоресценции фермента;
Il – максимум в интенсивности пика в линии возбуждения.
При одновременном применении методов ЛДФ, ОТО и ФС проводится диагностика транспорта кислорода в микроциркуляторном русле и его потребление тканью может оцениваться косвенно с помощью параметра – эффективность кислородного обмена (ЭКО):
ЭКО = M × U × ФПК. (4.17)
где М – среднее значение перфузии;
U – индекс удельного потребления кислорода в ткани, рассчитываемый по формуле 4.11.
Указанные комплексные параметры являются более информативными характеристиками состояния микроциркуляции крови по сравнению с их оценкой отдельными методами, так как микроциркуляция значительно вариабельна и адаптируется под конкретные физиологические потребности ткани. Комплексный подход к исследованию ткани in vivo позволяет врачу получать взаимодополняющие данные о микрогемодинамике, потреблении кислорода и состоянии обменных процессов для их анализа и принятия решений по диагностике заболеваний.
Дата добавления: 2019-11-25; просмотров: 1159; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
