Интенсификация гетерогенных процессов
Лекция 7. Интенсификация ХТП
1. Интенсификация гомогенных процессов
2. Интенсификация гетерогенных процессов
3. Интенсификация процессов, основанных на необратимых реакциях
4. Интенсификация процессов, основанных на обратимых реакциях
Интенсификация гомогенных процессов
Если реакция протекает в объеме фазы, то она называется гомогенной.
К гомогенным реакциям относят, например, реакции в растворах. В гомогенных системах реакция протекает во всем объеме реактора. Скорость реакции в таких процессах можно интенсифицировать изменением состава реакционной среды, температуры и давления.
Влияние состава реакционной среды зависит от величины концентрации реагентов и их физико-химических свойств.
Согласно закону действующих масс, уравнение скорости для гомогенной реакции типа aA + bB 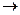 cC + dD записывается так:
cC + dD записывается так:
( – VA) = kCaACbB,
где VA – скорость химической реакции;
СА, СВ – молярные концентрации реагентов А и В;
a , b – порядок реакции по реагентам А и В;
k – константа скорости реакции.
Таким образом, скорость реакции пропорциональна произведению кон-центраций реагентов, взятых в степенях, равных порядку реакции, на основе чего следуют выводы:
– чем выше значение концентраций, тем больше скорость реакции;
– скорость реакции в большей степени зависит от реагента, входящего в уравнение скорости с большей степенью;
|
|
|
– если одновременно протекают реакции с разными порядками, то изменение концентрации значительнее скажется на скорости реакции с более высоким порядком.
Данные закономерности лежат в основе технологического приема – избытка одного из реагентов. При этом выгоднее в избытке брать реагент, входящий в уравнение реакции с более высоким стехиометрическим коэффициентом. Но существует ряд причин, по которым во многих газофазных и жидкофазных процессах реагенты разбавляют растворителем, т.е. понижают их концентрацию. Этому есть несколько причин:
– возможность перегрева реакционной массы при проведении сильно экзотермической реакции с большой скоростью;
– использование низких концентраций – требование селективного течения сложных реакций, если побочная реакция более высокого порядка;
– улучшение условий протекания сопровождающих реакцию физических процессов, т.к. разбавление позволяет понизить вязкость, облегчить равномерное перемешивание реакционной массы и ее транспорт, обеспечить более интенсивный и равномерный теплообмен.
Влияние температуры на скорость реакции описывается уравнением
Аррениуса:
 k = A . е –E /RT,
k = A . е –E /RT,
|
|
|
где k – константа скорости;
А – предэкспоненциальный множитель;
Е – энергия активации, кДж/моль;
R – газовая постоянная, кДж/моль;
Т – температура, К.
Из уравнения следует, что поскольку температура входит в показатель степени, то она оказывает очень большое влияние на скорость реакции. По этой же причине существенно влияние на скорость и значения энергии активации, но с другим знаком.
Влияние давления.Применяемый в химической технологии диапазон давлений очень широк. В нефтепереработке в большей части процессов давление составляет от 1 до 5 МПа. Но есть процессы, проводимые при высоких давлениях (гидрокрекинг – 32 МПа, полимеризация этилена – 100 МПа) и в вакууме (ректификация мазута). Имеется несколько причин, по которым повышенное давление, несмотря на высокие энергозатраты, широко применяется в химической технологии:
1) существенно повышает скорость газофазных процессов, т.к. в этом случае резко повышается концентрация реагентов.
2) влияет на положение химического равновесия для обратимых реакций, при этом повышение давления смещает равновесие в сторону прямой реакции, если процесс протекает с уменьшением объема.
|
|
|
3) повышает температуры кипения и плавления. Этот эффект используется для проведения процессов в жидкой фазе для веществ, которые при стандартном давлении находятся в газообразном состоянии.
4) во многих случаях позволяет снизить температуру синтеза, что важно в системах с низкой термостабильностью реагентов или продуктов процесса.
Интенсификация гетерогенных процессов
Гетерогенные системы состоят из непрерывной (сплошной) среды и дискретной фазы, включающей один или более компонентов.
В гетерогенной системе областью химического взаимодействия являются поверхности раздела фаз.
Скорость гетерогенной реакции является сложной функцией параметров нескольких процессов, протекающих параллельно: массопередачи извне в реакционную среду, собственно химической реакции и выведения продуктов процесса из реакционного пространства.
Элементарные стадии химической реакции протекают с разной скоростью. При этом в условиях стационарного процесса скорости всех стадий будут одинаковы и равны скорости самой медленной стадии. Эту стадию называют лимитирующей. Поэтому их интенсификация связана с ускорением лимитирующей стадии.
Для решения данной проблемы в теорию гетерогенных процессов введено понятие области протекания реакции. По этой теории гетерогенная реакция может протекать в кинетической, диффузионной или переходной (диффузионно-кинетической) областях. Название этих областей связано непосредственно с лимитирующей стадией. Если лимитирующей стадией является химическое превращение, то говорят о кинетической области протекания процесса. К числу кинетических факторов относят температуру, давление, концентрацию реагентов и катализатора, природу и активность последнего и др. Если лимитирующей стадией является скорость массопередачи, то реакция протекает в диффузионной области. Известно, что для процессов, протекающих в этой области, скорость пропорциональна площади границы раздела фаз и движущей силе процесса (изменению концентрации), под действием которой происходит массопередача:
|
|
|
V = k · S · 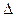 C,
C,
где k – коэффициент пропорциональности;
S – площадь поверхности раздела фаз;
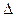 C – градиент концентрации.
C – градиент концентрации.
Из приведенного уравнения следует, что скорость процесса можно повысить, увеличив площадь соприкосновения фаз. Эта цель достигается измельчением твердого катализатора и развития его внутренней структуры (пористости). В системах с участием жидких продуктов для увеличения поверхности контакта применяют такие приемы, как использование насадочных устройств, барботаж, пенный слой и т. д. Значение константы скорости определяется следующим соотношением:
k = D/ 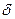 ,
,
где D – коэффициент диффузии;
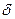 – толщина диффузионного пограничного слоя.
– толщина диффузионного пограничного слоя.
С повышением температуры коэффициент диффузии возрастает, но в значительно меньшей степени, чем скорость химической реакции. Тем не менее, температурный фактор часто используется для повышения скорости диффузионных процессов. Более эффективным является прием интенсификации путём перемешивания контактирующих фаз. Этим достигается уменьшение толщины диффузионного слоя, что приводит к резкому увеличению константы скорости процесса массопередачи.
Для увеличения движущей силы процессов массопередачи 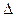 С, которая является градиентом концентраций:
С, которая является градиентом концентраций: 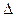 С = С – С*, (где С и С*– соответственно действительная и равновесная концентрации компонента в передающей фазе) используют следующие приемы:
С = С – С*, (где С и С*– соответственно действительная и равновесная концентрации компонента в передающей фазе) используют следующие приемы:
– повышение концентрации компонентов сырья;
– удаление продуктов процесса из реакционной зоны;
– смещение равновесия в направлении, повышающем градиент концентрации 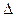 С.
С.
Таким образом, к диффузионным факторам, определяющим интенсивность процессов массопередачи, можно отнести линейные скорости движения фаз, число оборотов перемешивающих устройств, характеристики границы раздела фаз и др. Поскольку диффузионные факторы во многом определяются гидродинамикой потоков, то их часто называют гидродинамическими. Если скорости массопередачи и реакции соизмеримы, то говорят, что процесс протекает в переходной области.
Проведение реакции в кинетической области (отсутствует диффузионное торможение) наиболее предпочтительно с точки зрения кинетики, однако ряд промышленных процессов реально осуществляют в диффузионной области. Это касается прежде всего высокотемпературных процессов, когда трудно избежать диффузионных торможений по причине высоких скоростей химических реакций.
Подводя итоги, можно сделать следующие выводы:
– скорость гетерогенной реакции определяется скоростью лимитирующей стадии;
– в качестве лимитирующих могут быть как процессы химического превращения, так и процессы массопередачи;
– для интенсификации гетерогенной реакции следует использовать как кинетические, так и диффузионные факторы;
– для интенсификации процессов, протекающих в кинетической области, следует применять кинетические факторы, а в диффузионной – диффузионные.
Дата добавления: 2019-11-25; просмотров: 2424; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
