Смещение равновесия в процессах гидролиза солей
Министерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение высшего
Образования
«Брянский государственный инженерно-технологический университет»
Кафедра химии
Утверждено научно-методическим советом БГИТУ
протокол № ____ от «___» _______________2016г
Х И М И Я
Методические указания по выполнению лабораторных работ (№9-№15), организации подготовки к их защите и самостоятельной работе для студентов I курса направления подготовки бакалавров 35.03.02 «Технология лесозаготовительных и деревоперерабатывающих производств» очной и заочной форм обучения
Профили подготовки: «Технология деревообработки»
«Технология деревообработки, дизайн
Мебели и интерьеров»
БРЯНСК 2016
УДК: 542
Химия: Методические указания по выполнению лабораторных работ (№9-№15), организации подготовки к их защите и самостоятельной работе для студентов I курса направления подготовки бакалавров 35.03.02 «Технология лесозаготовительных и деревоперерабатывающих производств» очной и заочной форм обучения. Профили подготовки: «Технология деревообработки» «Технология деревообработки, дизайн мебели и интерьеров» / Брянск. гос. инженер.-технол. ун-т. Сост. А.В. Нестеров.– Брянск: БГИТУ, 2016.– 50 с.
|
|
|
Настоящие методические указания наряду с методикой проведения опытов и обработки их результатов содержат методический материал, призванный помочь студенту в самостоятельной подготовке к защите тем лабораторных работ. Он включает теоретические пояснения к каждой работе, примеры решения типовых задач, перечень понятий и законов, которые должен знать студент, а также умений и навыков, которыми он должен обладать. В конце каждой темы приводятся задания для самоконтроля и список рекомендуемой литературы.
Для направления подготовки бакалавров 35.03.02 «Технология лесозаготовительных и деревоперерабатывающих производств»
Рецензент:
кандидат хим. наук, доцент кафедры химии БГУ Щетинская О.С.
Рекомендовано редакционно-издательской и методической комиссиями факультета общенаучной подготовки и повышения квалификации БГИТУ.
протокол № ____ от «___» _______________2016г
Содержание
| Общие методические указания | 4 |
| Лабораторная работа №9. Гидролиз солей | 5 |
| Лабораторная работа №10. Окислительно-восстановительные реакции | 14 |
| Лабораторная работа №11. Электрохимический ряд напряжений металлов | 18 |
| Лабораторная работа №12. Гальванический элемент | 22 |
| Лабораторная работа №13. Изучение свойств азотной, серной и ортофосфорной кислот | 28 |
| Лабораторная работа №14. Электролиз солей | 37 |
| Лабораторная работа №15. Коррозия металлов. Защита металлов от коррозии | 45 |
| Литература | 50 |
|
|
|
Общие методические указания
Настоящие методические указания наряду с методикой проведения опытов и обработки их результатов содержат методический материал, призванный помочь студенту в самостоятельной подготовке к защите тем лабораторных работ. Он включает теоретические пояснения к каждой работе, примеры решения типовых задач, перечень понятий и законов, которые должен знать студент, а также умений и навыков, которыми он должен обладать. В конце каждой темы приводятся задания для самоконтроля.
При выполнении лабораторных работ студенты знакомятся с измерительными приборами и некоторыми методами исследования. Опыты выполняются студентами как в составе группы, так и индивидуально. Каждый получает задание и оформляет отчет исходя из экспериментальных данных, что развивает у студентов самостоятельность в решении поставленных задач.
Для более эффективного использования времени аудиторных занятий студент должен заранее ознакомиться с темой предстоящей работы, записать в лабораторный журнал название, цель, краткий конспект теоретической части, сжато описать методику проведения эксперимента.
|
|
|
После выполнения лабораторной работы студенты защищают ее. Для этого они должны: предъявить отчет о выполнении работы, который оформляется в лабораторном журнале; уметь изложить ход проведения лабораторных опытов, объяснить результаты экспериментов; по просьбе преподавателя составить соответствующие уравнения реакций, произвести расчеты, не выходящие за рамки типовых задач.
Лабораторная работа № 9
Гидролиз солей
Цель работы: изучить свойства водных растворов солей, связанные с реакцией гидролиза.
Оборудование и реактивы: штативы с пробирками, спиртовка, держатель для пробирок, индикаторы: фенолфталеин, метиловый оранжевый, лакмус, универсальная индикаторная бумага с цветной шкалой значения рН, 0,1М растворы NaCl , Na 2 SO 4 , Na 2 CO 3 , Na 2 SO 3 , CH 3 COO ( NH 4 ), ( NH 4 )2 SO 4 ; 1н растворы
ZnCl 2 , Al 2 ( SO 4 )3, FeCl 3, дистиллированная вода.
Теоретические пояснения
Гидролиз (разложение водой (лат.)) – процесс обменного взаимодействия между водой и веществом.
|
|
|
Гидролиз соединений различных классов протекает по-разному. Например, при гидролизе растительного сырья происходит гидролитическое расщепление полисахаридов с образованием моносахаридов:
(С6Н10О5) n + n Н2О = nC 6 H 12 O 6 , (9.1)
В данной работе рассматриваются процессы гидролиза солей.
Гидролиз солей – это химическое взаимодействие ионов соли с молекулами воды, приводящее к образованию слабого электролита.
В результате гидролиза происходит смещение равновесия диссоциации воды вследствие образования малодиссоцирующих соединений, малорастворимьгх и летучих веществ.
В соответствии с этим гидролизуются только катионы слабых оснований и анионы слабых кислот, то есть три типа солей:
1) соли, образованные слабыми основаниями и сильными кислотами (гидролиз по катиону) например. NН4 Cl , Mg ( NO 3 )2, Fe С13;
2) соли, образованные сильными основаниями и слабыми кислотами (гидролиз но аниону), например: СН3СОО Na , Na 2 CO 3 , NaHCO 3;
3) соли, образованные слабыми основаниями и слабыми кислотами (гидролиз но катиону и аниону), например: CH 3 COON Н4, A l 2 S 3 , ( NH 4 )2 S.
Соли, образованные сильными основаниями и сильными кислотами (NaCl, KNO3, NaClO4 и др.), гидролизу не подвергаются, так как при растворении их в воде. не происходит связывания ни Н+, ни ОН- ионов.
Рассмотрим написание ионно-молекулярных уравнений гидролиза на примере соли F еС13. Эта соль образована слабым основанием Fе(ОН)3 и сильной кислотой HС1, следовательно, гидролизу подвергается только катион соли Fe3+.
В соответствии с ионным уравнением:
Fe 3+ + HOH = [ FeOH ] 2+ + H + (9.2)
при гидролизе происходит разрыв связи Н—ОН в молекуле воды и образуется слабый электролит [ FeOH ]2+ (K FeOH 2+ = 1,4 * 10 -12), а ионы Н+ создают кислотную среду. В молекулярной форме уравнение гидролиза имеет вид:
FeCl 3 + HOH = FeOHCl 2 + HCl . (9.3)
Уравнения (9.2) и (9.3) отражают первую ступень гидролиза соли FeCl 3 . Гидролиз солей, образованных слабыми многокислотными основаниями и сильными кислотами (Cu ( N 03)2, А1С1з и т. п.), или солей, образованных слабыми многоосновными кислотами и сильными основаниями (Na 2 S , КзР04 и т. п.), протекает ступенчато, но при обычных условиях практически ограничивается первой ступенью. При нагревании и разбавлении раствора гидролиз усиливается, и становятся заметными следующие ступени гидролиза:
2-я ступень:
[FeOH]2+ + НОН = [ Fe (ОН)2]+ + Н+,
FeOHCl2 +HOH = Fe(OH)2Cl + HCl, (9.4)
3-я ступень:
[ F е(ОН)2]+ + НОН = Fе(ОН)3 + Н+;
Fе(ОН)2С1 + НОН = Fе(ОН)3 + НС1. (9.5)
Преимущественное протекание гидролиза по первой ступени объясняется тем, что, как будет показано ниже, чем слабее образующийся электролит, тем сильнее гидролизуется соль. Для слабых электролитов, диссоциирующих ступенчато, всегда справедливо соотношение К1> К2> Кз (таблица 9.1).
Поэтому в данном случае [ FeO Н]2+ наиболее слабый электролит из образующихся при гидролизе, что и обуславливает преимущественное протекание гидролиза по первой ступени.
Следует подчеркнуть, что ступенчатый гидролиз солей нельзя изображать суммарным уравнением, например,
Fe 3+ +3Н2О = Fe (О H )3 + 3 H + , (9.6)
получаемым путем сложения уравнений отдельных ступеней гидролиза (при сложении сокращается главный продукт гидролиза - ион [FeОН]2+).
или в молекулярной форме
Na 2 S + HOH = NaHS + NaOH , (9.7)
Если соль образована слабым основанием и слабой кислотой, например, C Н3СОО NH 4. то гидролизу подвергаются катион и анион соли:
СН3СОО – + NH 4 + + НОН = СН3СОО H + N Нз • Н2О. (9.8)
В подобном случае реакция среды близка к нейтральной и зависит от сравнительной силы кислоты н основания. Если Ккисл > Косн – реакция раствора слабокислая, если Косн > Ккис – слабощелочная, если Косн = Ккисл, то среда нейтральная.
При гидролизе солей, образованных сильными основаниями и слабыми кислотами, например, Na 2 S, на первой (основной) ступени анионы соли взаимодействуют с молекулами воды с образованием щелочной среды:
S -2 + HOH = HS - + OH - (9.9)
Таблица 9.1 – Константы электролитической диссоциации (К) некоторых слабых электролитов в водных растворах при 25° С
| Название электролита | Формула | К |
| Азотистая кислота | HN О2 | 4,6 х 10 - 4 |
| Синильная кислота | HCN | 7,9 х 10-10 |
| Сернистая кислота | H 2 SO 3 | K 1 =1,6 х10-2 ; К2 = 6,2 х 10-8 |
| Сероводородная кислота | H 2 S | K 1 =1х 10-7 ; K 2 = 4 х 10-14 |
| Угольная кислота | Н2СОз | K 1 = 4,5 х10-7 K2 = 4,7-10-11 |
| Уксусная кислота | СНзСООН | 1,75 х 10-5 |
| Фосфорная кислота | Н3Р O 4 | К1=7,1х10-3; К2= 6,3х10-8; К3= 5х10-13 |
| Хлорноватистая кислота | HClO | 5х10-8 |
| Гидроксид аммония | NH 4 0 H | 1,75 х 10-5 |
| Гидроксид алюминия | А1(ОН)з | К3=10-9 |
| Гидроксид железа (III) | Fе(ОН)3 | K 1 =4х10-9; К2=6х10-11; К3= 4х10-12 |
| Гидроксид магния | Мg(ОН)2 K2 | K 2 =1,5х10-3 |
Гидрокси  д меди д меди
| Сu(ОН)2 K2 | K2 = 10-7 |
| Гидроксид кальция | Са(ОН)2 | K 2 = 2х10-1 |
| Гндроксид цинка | Zn ( OH )2 | К1 = 10-5; К2 = 5х 10-7 |
Смещение равновесия в процессах гидролиза солей
Так как гидролиз большинства солей является обратимым процессом, то степень гидролиза можно изменять, смещая равновесие реакций гидролиза и нейтрализации.
Важнейшими факторами, влияющими на степень гидролиза, являются следующие:
1) константа диссоциации кислоты или основания, образующих соль,
2) общая концентрация соли,
3) температура,
4) рН раствора.
Влияние первого фактора видно из формулы:
Кг= К 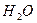 /Кдисс., (9.10)
/Кдисс., (9.10)
Константа гидролиза (Кг) тем больше, чем меньше Кдисс. электролита, то есть чем слабее образующийся электролит, тем сильнее гидролизуется соль.
Из уравнения
h = 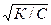 , (9.11)
, (9.11)
следует, что разбавление раствора усиливает гидролиз, а повышение концентрации соли подавляет его.
Влияние температуры на степень, гидролиза можно вывести из принципа Ле -Шателье. Реакция нейтрализации экзотермична, следовательно, гидролиз, (обратный ей процесс) эндотермичен, как и диссоциация воды. Поэтому при повышении температуры раствора гидролиз усиливается, охлаждение раствора подавляет гидролиз.
Выше было показало, что при гидролизе солей по катиону образуется кислая среда, при гидролизе но аниону – щелочная. Поэтому, изменяя рН раствора, можно усиливать или подавлять гидролиз.
Так, введение в раствор F еС1з кислоты вызовет смещение равновесия влево, то есть степень гидролиза уменьшится. Наоборот, связывание ионов Н+ усилит гидролиз. Поэтому при сливании растворов солей, одна из которых гидролизуется по катиону, а другая по аниону, происходит взаимное усиление гидролиза и гидролиз может протекать необратимо. Так, в растворах FеС1з и Na 2 S, взятых в отдельности, протекает практически только по первой ступени, и устанавливаются соответственно равновесия. При сливании этих растворов происходит реакция нейтрализации:
Н+ + ОН- = Н2О
или в молекулярной форме
НС l + NaOH = H 2 O + NaCl ,
равновесие гидролиза смещается вправо, становится возможным протекание вторай и третьей (3), (4) стадии гидролиза, что приводит к необратимому протеканию совместного гидролиза этих двух солей:
FeCl2 + 3Na2S + 6HOH = 2Fe(OH)3 ↓ + 3H2S ↑ + 6NaCl, (9.12)
или
Fe3+ + 3S2- + 6HOH = 2Fe(OH)3 ↓ + 3H2S ↑ , (9.13)
По подобной схеме взаимного усиления гидролиза, приводящего к образованию осадка и газа, взаимодействуют соли, образованные катионами Al3+, Cr 3+ , Fe 3+ c карбонатами и сульфидами щелочных металлов. Поэтому эти соли невозможно получить реакциями обмена из водных растворов.
Методика проведения опытов
Опыт 1. Определение рН дистиллированной воды и раствора NаС1.
Каплю дистиллированной воды наносите на полоску универсального индикатора и полученную окраску сравниваете с цветной шкалой. Объясните полученный результат, принимая во внимание, что при растворении диоксида углерода из воздуха в дистиллированной воде устанавливается равновесие:
С02 + Н2 O = Н2СО3 = Н++ НСО3-
рН свежеперегнанной воды равно 7. Для удаления растворенного СО2 дистиллированную воду следует прокипятить и хранить в сосуде с пробкой, снабженной трубкой с поглотителем СО2.
С помощью универсального индикатора измерите рН раствора NаС1 и, сравните с рН дистиллированной воды. Протекает ли в растворе процесс гидролиза?
Опыт 2. Гидролиз солей, образованных сильными основаниями и слабыми кислотами. Влияние величины константы диссоциации кислоты, образующей соль, на степень ее гидролиза.
С помощью универсального индикатора определите рН в 0,1 М растворов СН3СОО Na и Nа2СОз. Сравните полученные значения рН, установите, в каком из растворов степень гидролиза соли больше? Ответ подтвердит расчетом Кг, h и рН растворов указанных солей. Составьте ионные и молекулярные уравнения гидролиза обеих солей.
Опыт 3. Гидролиз солей, образованных слабыми основаниями и сильными кислотами. Влияние величины константы диссоциации основания, образующего соль, на степень ее гидролиза.
С помощью универсального индикатора определите рН в 0,1 М растворах NH 4 Cl, А1С1з. Исходя из значений рН cделайте вывод о том, какая соль подвергается более глубокому гидролизу. Ответ подтвердите расчетом Кг, h и рН растворов указанных солей (для раствора А1С1з следует учесть только первую ступень гидролиза). Составьте ионные и молекулярные уравнения гидролиза обеих солей.
Задания для самоконтроля
1. При хранении растворов солей гидролиз не желателен. Что нужно сделать, чтобы ослабить гидролиз сульфата кобальта (II)?
2. Какие из перечисленных ниже солей будут подвергаться гидролизу? Написать соответствующие молекулярные и ионно-молекулярные уравнения. Рассчитать для 0,2М растворов константу гидролиза. степень гидролиза и рН среды, учитывая только первую ступень гидролиза.
1) K2SO4; NaClO4; Na2S; CuSO4 .
2) К N О 2 ; Р b(NO3)2; (N Н 4 )2 СО 3 ; К NO3.
3. При сливании растворов Al 2 ( SO 4 )3 и Na 2 S выпадает белый осадок и ощущается неприятный запах. Объясните причину этого, приведя соответствующие уравнения реакций.
4. Почему раствор NаН2Р04, имеет слабокислую, а раствор Nа3Р04 щелочную реакцию? Ответ мотивировать соответствующими уравнениями реакций и расчетами. Воспользоваться данными табл.1 и 2.
5. Какие из приведенных ниже солей гидролизуются? Для гидролизующихся солей написать ионные и молекулярные уравнения гидролиза и указать реакцию раствора:
а) NH 4 NO 3 , б) ВеСl2, в) К2 SO 4 , г) NаNО2, д) Nа2СО3, е) ВаС12, ж) Al 2 ( SO 4 )3, з) Nа3Р O 4 , и) F е SO 4 , к) ( NH 4 )2 S , л) Са(СН3СОО)2.
6. Напишите ионные и молекулярные уравнения гидролиза солей и укажите качественно значение рН растворов:
а) K2 SO 3 , б) С r С13, в) С uSO 4 , г) K 2 S , д) К3Р O 4 , е) Fе(N O 3 )3.
Что произойдет при нагревании и разбавлении растворов? Напишите уравнения реакций.
7. Вычислите константу гидролиза, степень гидролиза и рН растворов солей: а) 0,5М NH4 N Оз, б) 0,1М KNO 2 , в) 0,1М Nа2 S , г) 0,3М FеС13, д) 0,5М СНзСООNН4.
8. Рассчитайте Кг и рН 1М растворов NаН2Р04, N а2НР O 4 и Nа3Р O 4. Какая из солей гидролизуется в наибольшей степени и почему? Сравнивая величины Кг и соответствующие Ккисл, объясните, почему в растворе N аН2 PO 4 среда кислая, а в растворе Nа2НР O 4 – щелочная.
9. Напишите ионные и молекулярные уравнения реакций, происходящих при сливании растворов: а) А1( N О3)3 и ( NH 4 )2 S , б) Fe 2 ( SO 4 )3 и Nа2СО3, г) С r С13 и К2 SO 3 . Объясните смещение равновесия гидролиза и практически необратимое его протекание.
Таблица 9.2 – Качественные и количественные характеристики растворов гидролизующих солей
| Тип соли | Реакция растворов | Продукты гидролиза | Кг | h | [H+] или [OH-] |
| Соль, образованная слабым основанием и сильной кислотой (гидролиз по катиону) | Кислая pН< 7 | Слабые основания или основные соли | 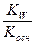
| 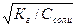
| 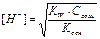
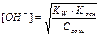
|
| Cоль, образованная слабой кислотой и сильным основанием (гидролиз по аниону) | Щелочная pН>7 | Слабые кислоты или кислые соли | 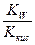
| 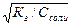
| 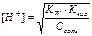
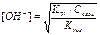
|
| Соль, образованная слабым основанием и слабой кислотой (гидролиз по аниону и по катиону). | Близкая к нейтра-ой pН = 7 | Слабые кислоты, слабые основания или кислые соли | 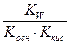
| 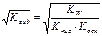
| 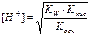
|
| Кислая соль, образованная слабой двухосновной кислотой и сильным основанием | pН>7 (Kг>Kкисл) рН <7 (Kг<Kкисл) | Слабая кислота | 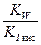
| 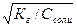
| 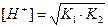
|
Примеры решения задач
Пример 1. Написать молекулярные и ионно-молекулярные уравнения гидролиза сульфита калия K 2 SO 3 .
Решение:
1. Соль образована катионом сильного основания и анионом слабой двухосновной кислоты. Гидролиз идет по аниону. В растворе щелочная реакция среды.
1 ступень: К2SО3 + H 2 O = KHSO 3 + КОН
SO 3 2- + Н2О = HSO 3 - + OH -
2 ступень: KHSO 3 + Н2 O = Н2 S О3 + КОН
HSO 3 - + Н2 O = Н2 S О3 + ОН-
Дата добавления: 2019-09-13; просмотров: 1030; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
