Денатурация и ренатурация белков.
ДЕНАТУРАЦИЯ - процесс разрушения природной конформации белка.
Причины: t, давление, облучение, химических веществ (спирт, ацетон, кислоты, щелочи).
Белок денатурирует необратимо (т.е.разрушается его первичная структура) под действием t = 40 - 50ºС, солей тяжелых металлов – Рb, Hg, Cu, Cd, Zn, As, концентрированные растворы кислот и щелочей.
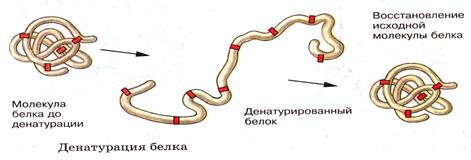
Соли легких металлов – Al, Mg, разбавленные р-ры кислот и щелочей вызывают обратимую денатурацию – ренатурацию.
РЕНАТУРАЦИЯ - восстановление структуры белка. Белок ренатурирует только если не разрушена первичная структура. .
Это свойство белков используется в медицинской и пищевой промышленности для получения антибиотиков, вакцин, сывороток, ферментов; пищевых концентратов, сохраняющих длительное время в высушенном виде свои питательные свойства.
Классификация и значение белков.
I. Классификация белков по составу.
| Простые белки (протеины) – состоят только из аминокислот. | Сложные белки (протеиды) – состоят из глобулярных белков и небелкового материала. Небелковую часть называют простетической группой. |
| альбумины – яичный альбумин, глобулины - антитела, гистоны – упаковка ДНК, склеропротеины – кератин волос, коллаген сухожилий | фосфопротеиды – ам.к-та + фосфорная кислота (казеин молока) гликопротеиды – ам.к-та + углевод (белки плазмы крови) нуклеопротеиды – ам.к-та + нуклеиновая к-та (хромосомы) липопротеиды – ам.к-та+ липид (компонент мембран) хромопротеиды – ам.к-та + пигмент металлопротеиды – ам.к-та+ металл |
II . Классификация белков по их структуре.
Фибриллярные – образуют длинные волокна или слоистые структуры (коллаген, миозин, фиброин, кератин), гидрофобны.
Глобулярные – их полипептидные цепи свернуты в компактные глобулы (ферменты, антитела, гормон инсулин).
Промежуточные – фибриллярной природы, но растворяются в воде (фибриноген – растворимый, а фибрин нет).
III . Классификация белков по другим характеристикам:
· Есть белки гидрофильные( фибриноген) и гидрофобные (фибрин).
· Есть белки очень устойчивые (кератин) и неустойчивые (фермент каталаза).
· По форме молекул – нити (миозин – белок мышечных волокон), шарики (гемоглобин).
Функции белков:
1 . Структурные (строительная или пластическая функция)– входят в состав мембран клеток и органоидов, образуют цитоскелет клеток, входят в состав сухожилий – коллаген, волос и кожи – кератин, из этого белка состоят волосы, шерсть, рога, копыта, верхний отмерший слой кожи. В более глубоких слоях кожи расположены прокладки из белков коллагена и эластина. Именно эти белки обеспечивают прочность и упругость кожи. Они же содержатся в связках, соединяющих мышцы с суставами и суставы между собой.
2. Ферменты (каталитическая) – являются биологическими катализаторами – трипсин, каталаза, ДНК- полимераза, пепсин, амилаза..
3. Гормоны (гормональная или регуляторная функция) Многие (хотя далеко не все) гормоны являются белками – например все гормоны гипофиза (гормон роста – соматотропин), гипоталамуса, поджелудочной железы (инсулин– регулирует содержание глюкозы в крови, при недостатке инсулина развивается сахарный диабет, глюкагон) и др. Гормоны действуют на клетку, связываясь со специфическими рецепторами. Каждый рецептор узнает только один гормон. Рецепторы всех гормонов являются белками. Другим примером могут служить белки, которые регулируют образование и рост отдельных органов и тканей в процессе развития организма из зиготы. Фитохром растений является сложным светочувствительным белком, регулирующим фотопериодическую реакцию у растений.
4. Рецепторы (сигнальная) – факторы среды вызывают обратимую денатурацию белков мембраны, что вызывает ответ на данный сигнал внутри клетки в виде химической реакции – белок родопсин.
5. Транспортные (транспортная функция) – переносят различные вещества. В крови имеются белки-транспортеры, которые узнают и связывают определенные гормоны и несут их к клеткам- мишеням. В наружных клеточных мембранах имеются белки-транспортеры, которые обеспечивают активный и строго избирательный транспорт внутрь и наружу клетки сахаров, аминокислот, различных ионов (Na-K АТФ-аза), Известны и другие транспортные белки, например гемоглобин и гемоцианин, переносящие кислород, и миоглобин, удерживающий кислород в мышцах.
6. Защитные (защитная) – обеспечивают иммунные реакции организма – белки антитела , вырабатываемые лимфоцитами, блокируют чужеродные белки, интерферон клеток – универсальный противовирусный белок, фибрин и тромбин препятствуют кровопотере при ранениях.
7. Сократительные (двигательная функция) – участвуют во всех видах движений клетки – биение ресничек и жгутиков, деление клетки – белок тубулин, в сокращении мышечных волокон – актин, миозин, они же делают возможным ползание амебы.
8. Запасные (запасная функция)– служат резервными веществами клетки и организма – яичный альбумин служит водозапасающим белком в яичном «белке», казеин молока является источником энергии, а белок ферритин удерживает железо в яичном желтке, селезенке и печени.
9. Токсины (токсическая) – являются ядами, используемыми живыми существами в целях защиты или нападения (яд кобры содержит нейротоксин), однако некоторые организмы вырабатывают белки антитоксины, которые подавляют действие этих ядов.
10. Энергетическая функция (питательная) - белки можно расщепить, окислить и получить энергию, необходимую для жизни. Правда, это не очень выгодно: энергетическая ценность белков по сравнению с жирами невысока и составляет 17,6 кДж (4,1 ккал) энергии на 1 г белка. Обычно белки расходуются на энергетические нужды в крайних случаях, когда исчерпаны запасы жиров и углеводов.
11. Научное (в систематике) – чем ближе организмы друг к другу в систематическом положении, тем более сходны их белки.
Тема: ФЕРМЕНТЫ.
Катализатор - это вещество, которое ускоряет реакцию, не расходуясь.
ФЕРМЕНТЫ (от лат. fermentum – брожение, закваска), или энзимы – биологические катализаторы белковой природы.
Некоторые молекулы РНК имеют свойства ферментов. Сегодня известно 2 тыс. ферментов. Первый фермент – уреаза был выделен в 1926 г. американским биохимиком Дж.Самнером. Она катализирует расщепление мочевины.
В одной клетке 100 разных ферментов, работающих при t =5 - 40ºС (предпочитают t = 4-37 ºc), при 60 ºС денатурируют.
Название фермента от названия субстрата + окончание –«аза».
Субстрат – в-во на которое действует фермент. Например,
| Название фермента | Субстрат |
| целлюлаза | целлюлоза |
| сахараза | сахароза |
| липаза | липиды |
 ФЕРМЕНТАТИВНЫЕ РЕАКЦИИ
ФЕРМЕНТАТИВНЫЕ РЕАКЦИИ
 |
| Анаболические – реакции синтеза | Катаболические – реакции распада |
Схема ферментативной реакции

Примеры работы ферментов
| Субстрат | Фермент | Продукт |
| крахмал | амилаза слюны | мальтоза |
| перекись водорода | каталаза | вода + кислород |
| жиры | липаза | глицерин + жирные кислоты |
| белки | трипсин | аминокислоты |
Метаболический путь - каскад ферментативных реакций, обеспечивающий превращение субстрата в продукт.
СВОЙСТВА ФЕРМЕНТОВ:
1. Ферменты – глобулярные белки;
2. Увеличивают скорость реакции, но сами не расходуются;
3. Не влияют на свойства конечного продукта;
4. Малое количество фермента превращает большое количество субстрата;
5. Активность фермента зависит от t, рН, концентрации субстрата и фермента. Например, пепсин активен при рН < 7; при рН > 7 трипсин, липаза, каталаза; рН = 7 амилаза слюны;
6. Катализируемая реакция обратима;
7. Фермент специфичен, т.е. каждый фермент действует на определенный субстрат: формула «один фермент – один субстрат».
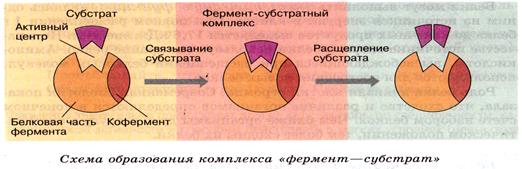
Механизм действия ферментов.
Активный центр фермента - 3-12 аминокислотных остатков молекулы фермента, вступающих в контакт с субстратом. Остальные аминокислотные остатки фермента обеспечивают глобулярную форму энзима, что необходимо для эффективной работы активного центра. Активный центр формируется витаминами, металлами.
ГИПОТЕЗА «КЛЮЧА И ЗАМКА»
Выдвинута 1890 г. Э.Фишером: субстрат подходит к ферменту, как ключ к замку. Субстрат сравнивается с «ключом», который подходит к «замку» – ферменту.
Дата добавления: 2019-09-08; просмотров: 558; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
