Физические свойства некоторых металлов
| Металл | Плотность r, | tпл., °С | tкип., °С | Твердость по Бринеллю НВ* |
| кг/м3 | ||||
| Железо | 7860 | 1539 | 2380 | 50-70 |
| Алюминий | 2700 | 660 | 2500 | 20-30 |
| Медь | 8930 | 1083 | 2600 | 35 |
| Магний | 1740 | 651 | 1100 | 25-30 |
| Никель | 8900 | 1455 | 3080 | 60 |
| Титан | 4500 | 1665 | 3260 | 100 |
| Молибден | 10200 | 2620 | 4800 | 150-160 |
Лучшими проводниками электричества являются серебро, медь, золото и алюминий. Эти же металлы являются наиболее теплопроводными. Электрическая проводимость зависит от температуры: с повышением температуры она снижается.
Отражательная способность металлов выражается в характерном металлическом блеске, интенсивность которого зависит от доли поглощаемого металлом света - чем она меньше, тем ярче блеск. Наиболее ярко блестят серебро и палладий. В мелкодисперсном состоянии большинство из металлов черного цвета и без блеска. Алюминий и магний сохраняют металлический блеск даже в порошкообразном состоянии.
Если металл поглощает лучи разных длин волн не одинаково, допустим коротковолновые лучи в большей степени, то отраженный свет обогащается длинноволновыми лучами и, таким образом, металл приобретает окраску такую, как у меди и золота.
Механические свойства металлов (прочность, вязкость, пластичность, упругость) и технологические свойства металлов (ковкость, жидкотекучесть, свариваемость, обрабатываемость режущим инструментом) будут рассматриваться в специальных курсах.
|
|
|
Характерной особенностью металлов в химическом отношении является проявление ими типичных восстановительных свойств.
Общность физических и химических свойств металлов объясняется общностью строения их атомов, характерными типами кристаллических решеток и типом химической связи.
В атомах металлов на внешнем энергетическом уровне, как правило небольшое число электронов - от одного до трех.
2.4. Химические свойства металлов
Как было отмечено выше, металлы и их сплавы являются важнейшими конструкционными материалами. Металлические конструкции находятся в постоянном контакте с окружающей средой: воздухом, влагой и т.д. В реальных условиях водная среда может отличаться от нейтральной, становясь либо кислой, либо щелочной.
Для того, чтобы сделать вывод об устойчивости металлической конструкции в той или иной среде, необходимо учитывать многие факторы, в том числе и протекание возможных реакций.
Металлы, являясь восстановителями, могут взаимодействовать с различными окислителями; неметаллами, кислотами и др.
Взаимодействие металлов с неметаллами. Все щелочные металлы энергично соединяются с кислородом. Рубидий и цезий самовоспламеняются на воздухе; литий, натрий и калий загораются при небольшом нагревании. Характерно, что только литий, сгорая, образует нормальный оксид Li2O, остальные же щелочные металлы превращаются в более сложные соединения: Na2О2, КО2, RbО2, CsО2. Хотя процессы взаимодействия других металлов с кислородом протекают менее активно, их окисление всегда термодинамически выгодно, так как сопровождается уменьшением свободной энергии Гиббса. Образующиеся при этом оксиды во многих случаях придают химическую устойчивость изделиям из металла, например, оксидные пленки на поверхности алюминия, хрома, цинка, титана и других металлов.
|
|
|
При нагревании многие металла реагируют с водородом, образуя гидриды со значительной долей ионного характера связи Ме+ - Н-, например:
Ca + H2 = CaH2
По мере перемещения по периодической таблице слева - направо возрастает ковалентный характер указанной связи.
Некоторые d- элементы образуют металлообразные гидриды (гидриды внедрения). Они представляют собой металлоподобные темные порошки, обладающие электрической проводимостью, теплопроводностью и магнитными свойствами, характерными для металлов. В большинстве случаев гидриды - нестехиометрические соединения, например, TiHх, где Х - переменно.
|
|
|
При высокой температуре, металлы взаимодействуют с углеродом, образуя соединения, называемые карбидами:
3Fe + C = Fe3C
Карбиды ряда металлов являются тугоплавкими материалами.
При высокой температуре металлы соединяются с азотом, образуя нитриды:
3Mg + N2 = Мg3N2
При обычной температуре с азотом реагирует лишь литий:
6Li + N2 = 2Li3N
Все нитриды, за исключением нитридов активных металлов, проявляют огнеупорные свойства. Многие металлы взаимодействуют с серой и галогенами:
Fe + S= FeS
2К + C12 = 2КСl
2Al + 3S = Al2S3
2Аl + 3C12 = 2АIСl3
Взаимодействие металлов с кислотами. При взаимодействии металлов с разбавленной серной кислотой или хлороводородной (соляной) кислотой окислителем являются ионы водорода. Например:
Cr + 2НСl = CrC12 + Н2
Fe + H2SO4 (разб.) = FeSO4 +H2
Металлы, расположенные в ряду стандартных электродных потенциалов левее водорода, вытесняют из кислот, за исключением азотной и концентрированной серной, а металлы, расположенные правее водорода, не вытесняют его*. Например:
Cu + H2SO4 (разб.) ¹ реакция не идет.
Следует отметить, отношение свинца к действию кислот: разбавленной серной и хлороводородной. В ряду стандартных электродных потенuиалов свинец расположен левее водорода. Однако, вследствие образования в начальный момент малорастворимых соединений, покрывающих металл пассивирующей солевой пленкой реакция практически прекращается:
|
|
|
Pb + H2SO4 = PbSO4¯ +H2
Pb + 2НСl = PbCl2¯ + Н2
При взаимодействии металлов с азотной кислотой в роли окислителя выступает анион 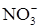 . Состав продуктов восстановления зависит от активности металла, от концентрации кислоты, температуры. Рисунок 1 иллюстрирует относительное содержание продуктов восстановления азотной кислоты железом в зависимости от ее концентрации. Ниже приведены реакции восстановления нитрат-иона в зависимости от условий (азот, степень окисления которого в составе иона
. Состав продуктов восстановления зависит от активности металла, от концентрации кислоты, температуры. Рисунок 1 иллюстрирует относительное содержание продуктов восстановления азотной кислоты железом в зависимости от ее концентрации. Ниже приведены реакции восстановления нитрат-иона в зависимости от условий (азот, степень окисления которого в составе иона 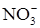 равна 5+, может принимать от одного до восьми электронов):
равна 5+, может принимать от одного до восьми электронов):
2 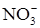 + 12H+ + 10e = N2 + 6H2O (1)
+ 12H+ + 10e = N2 + 6H2O (1)
2 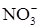 + 10H+ + 8e = N2O + 5H2O (2)
+ 10H+ + 8e = N2O + 5H2O (2)
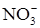 + 4H+ + 3e = NO + 2H2O (3)
+ 4H+ + 3e = NO + 2H2O (3)
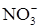 + 3H+ + 2e = HNO2 + H2O (4)
+ 3H+ + 2e = HNO2 + H2O (4)
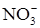 + 10H+ + 8e =
+ 10H+ + 8e =  + 3H2O (5)
+ 3H2O (5)
 + 2H+ + e = NO2 + H2O (6)
+ 2H+ + e = NO2 + H2O (6)
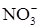 + H2O + e = NO2 + 2OH- (7)
+ H2O + e = NO2 + 2OH- (7)
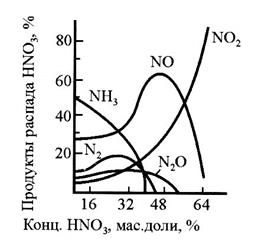
Рис. 1. Зависимость содержания различных продуктов восстановления (Спр) железом азотной кислоты от ее концентрации (Ск), плотности (r)
Металлы с положительным значением стандартного электродного потенциала (Сu, Ag и др.) растворяются в концентрированной азотной кислоте согласно уравнению (6) с выделением оксида азота (IV) - NO2 :
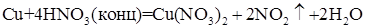
С разбавленной азотной кислотой процесс идет по уравнению (3), при этом при этом выделяется оксид азота (II) - NO :
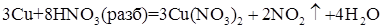
При взаимодействии более активного металла о разбавленной азотной кислотой восстановление происходит до оксида азота (I) - N2O
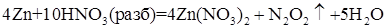
Чем активнее металл и чем разбавленнее кислота, тем больше в смеси продуктов более глубокого восстановления, например, NН3, который с азотной кислотой образует соль аммония. Так, очень разбавленная азотная кислота при взаимодействии с магнием восстанавливается до 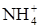 :
:
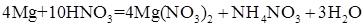
Из металлов только золото, платина, осмий, иридий, ниобий, тантал, вольфрам устойчивы к действию азотной кислоты. Некоторые металлы, например, железо, хром, алюминий пассивируются концентрированной азотной кислотой. Пассивация связана с образованием защитной пленки на поверхности металла, вследствие чего реакция между металлом и кислотой не идет. Для железа в химически чистой НNО3 при 25°С максимум растворения находится вблизи 30-35-процентной (6-7 н) НNО3. В 50-70-процентной НNО3 в указанных условиях железо практически устойчиво. В растворе НNО3 с концентрацией больше 80% наблюдается постепенное увеличение скорости растворения. При повышении температуры пассивация железа в НNО3 затруднена. Так, например, железо не пассивируется даже в 60-80-процентной НNО3 при температуре выше 80°С. Стойкость алюминия с повышением концентрации азотной кислоты выше 30% все больше увеличивается. Поверхность алюминия в пассивном состоянии покрыта защитной пленкой (в зависимости от рН раствора, его температуры, толщиной 5-100 нм, состоящей из А12О3·× Н2О - бемита или А12О3 ×·3Н2О - гидралгилита).
При действии на металл концентрированной серной кислоты в роли окислителя выступает ион 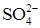 . Проявляя окислительные свойства, серная кислота в зависимости от условий (активности металла, концентрации кислоты, температуры) восстанавливается следующим образом:
. Проявляя окислительные свойства, серная кислота в зависимости от условий (активности металла, концентрации кислоты, температуры) восстанавливается следующим образом:
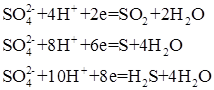
Проведение окислительно-восстановительных реакций с участием концентрированной серной кислоты обычно требует нагревания.
При взаимодействии неактивных металлов, а также металлов средней активности с концентрированной серной кислотой, продуктом восстановления является SO2:

При взаимодействии с концентрированной серной кислотой более активных металлов, например, щелочных и щелочно-земельных, продуктом восстановления является, главным образом, H2S:
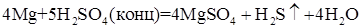
Цинк восстанавливает концентрированную серную кислоту до SO2, S? H2S (одновременно).
Скорость растворения железа максимальна в 50-процентной и уменьшается в более концентрированной (70-100-процентной) серной кислоте вследствие пассивирующего действия. Второй (небольшой) максимум скорости растворения железа (рис. 2) и последующее снижение скорости растворения в H2SO4 с избытком SО3 можно объяснить разрушением оксидных пассивных пленок и последующим возникновением сульфатных и сульфидных защитных пленок. Такое поведение железа дает возможность применять железные емкости для хранения и транспортировки концентрированной H2SO4 и олеума*. Алюминий стоек в олеуме, особенно повышенных концентраций. Однако при нагревании концентрированная серная кислота взаимодействует почти со всеми металлами, кроме платины, золота и некоторых других.
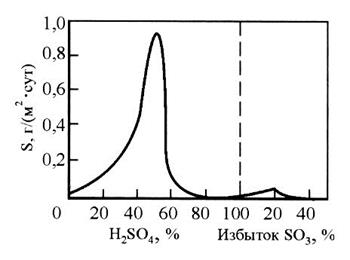
Рис. 3. Зависимость скорости растворения железа
от концентрации кислоты
Взаимодействие металлов с водными растворами солей. При этом образуется новая соль и металл:
Fe + CuSО4 = Cu + FeSО4
Каждый металл может вытеснять из растворов солей все металлы, расположенные в ряду стандартных электродных потенциалов после него. Для вытеснения металлов из водных растворов солей не используют металлы, расположенные справа от магния (калий, барий, кальций и др.), так как эти металлы реагируют с водой.
Взаимодействие металлов с водой. Важным свойством многих металлов является способность взаимодействовать с водой. Активные металлы с водой взаимодействуют в обычных условиях:
2Na + 2Н2О = 2NaOH + Н2
2Са + 2Н2О = Са(ОН)2 + Н2
Другие металлы взаимодействуют с водой при нагревании:
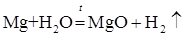
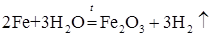 (при наличии примесей)
(при наличии примесей)
Взаимодействие металлов с водными растворами щелочей. С водными растворами щелочей взаимодействуют металлы, расположенные до водорода в ряду стандартных электродных потенциалов и которым соответствуют амфотерные оксиды, например, алюминий, олово, свинец:
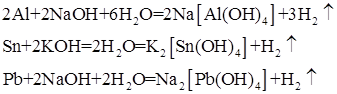
2.5. Способы получения металлов
Большинство металлов в природе встречается в виде соединений, и только металлы с низкой химической активностью, такие, как серебро, ртуть, золото, платина находятся в природе в свободном состоянии или в виде вкраплении в горные породы.
Природные соединения металлов, входящие в состав горных пород, называются рудами.
Из оксидных руд наиболее распространены гематит - Fе2О3, магнит - Fе3О4, боксит - А12О3 ×·хН2О, хромистый железняк - FeO·× Сr2О3, гаусманит - Мn3О4, ильменит - FеТiО3, пиролюзит - МnО2.·
Основные сульфидные руды: железный колчедан - FeS2, медный колчедан - CuFeS2, свинцовый блеск - PbS, цинковая обманка ZnS, киноварь - HgS.
Карбонатные руды: мрамор, мел, известняк – СаСО3, магнезит - МgСО3, шпатовый железняк (сидерит) - FеСО3, малахит - СuСО3 × Сu(ОН)2 .
Галидные руды: поваренная (каменная) соль - NaCl, сильвин - KCl, карналлит - KCl·× MgC12 × 6Н2О.
Способы получения металлов основаны на реакциях восстановления: 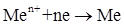 . Это требует затраты значительной энергии, которая может быть передана восстанавливающемуся металлу различными способами. В соответствии с этим различают пирометаллургические, гидрометаллургические и электрометаллургические методы получения металлов.
. Это требует затраты значительной энергии, которая может быть передана восстанавливающемуся металлу различными способами. В соответствии с этим различают пирометаллургические, гидрометаллургические и электрометаллургические методы получения металлов.
Пирометаллургические методы основаны на восстановлении металлов из руд при высоких температурах с помощью различных восстанавливающих агентов: углерода, оксида углерода (II), водорода, более активного металла.
Металлы, существующие в природе в виде оксидных руд, могут быть восстановлены при помощи углерода или оксида углерода (II). Например, восстановление оксидов железа в доменной печи можно выразить суммарным уравнением:
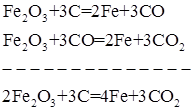
В ряде случаев реакции восстановления углеродом, оксидом углерода (II) неприменимы (получение вольфрама), так как возможно образование карбидов. Карбидообразование идет через газовую фазу или непосредственно:
Ме + 2СО = МеС+СО2
Ме + С = МеС
Тогда, в качестве восстановителя применяют водород:
WO3 + 3H2 = W + 3H2O
Восстановление металлов из их соединений другими металлами называется металлотермией. Эти процессы протекают при высоких температурах. В металлотермии наиболее часто используют металлы высокой химической активности: натрий, кальций, магний, алюминий. Если восстановителем является алюминий, то процесс называется алюминотермией, например:
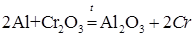
Методом алюминотермии могут быть получены металлы, теплоты образования оксидов которых меньше теплоты образования оксида алюминия.
Основное количество титана получается магнийтермическим способом:
TiC14 + 2Mg = Ti + 2MgC12
Для извлечения металлов из карбонатных и сульфидных руд их сначала переводят в соответствующие оксиды. Например, при получении цинка из цинковой обманки - ZnS, эту руду сначала подвергают обжигу:
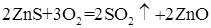
Полученный оксид затем восстанавливают углеродом или оксидом углерода (II).
Гидрометаллургия. Этот метод используется, если исходная порода содержит сравнительно небольшое количество интересующего нас металла. Металлы извлекаются из руд в виде соединений водными растворами различных реагентов с последующим выделением металла из раствора. Гидрометаллургическим методом получают, например, золото:
4Аu + 8KCN(0,1-0,2%) + 2Н2О + O2 = 4K[Au(CN)2] + 4КОН
Из полученного раствора золото восстанавливают цинком:
2[Au(CN)2]- + Zn = [Zn(CN)4]2- + 2Au¯
Электрометалпургические методы получения металлов - получение металлов путем электролиза растворов солей, а также расплавов солей и оксидов. Этот метод используется для получения металлов высокой химической активности (натрия, калия, магния, кальция, алюминия), которые другими методами получить невозможно. Металлы восстанавливаются на катоде. Так, электролизом расплава хлорида кальция получают кальций:
катод: Са2+ + 2е = Са
анод: Cl- - е = Cl Cl + Cl = C12
Натрий получают электролизом расплава хлорида натрия:
катод: Na+ + е = Na
анод:Cl- -е = Cl Cl + Cl = C12
Алюминий в промышленности получают электролизом раствора оксида алюминия в расплавленном криолите Nа3АlF6 с добавкой CaF2.·Электролиз проводится при 950-9800С. Чистый* оксид алюминия получают из боксита и из нефелина Na2О·× (К2О)·× А12О3 × 2SiО2, он хорошо растворяется в расплавленном криолите (Nа3АlF6). Добавка фторида кальция (CaF2) способствует поддержанию температуры ниже 10000С, улучшает электрическую проводимость электролита, уменьшает его плотность, что способствует выделению алюминия на дне ванны. При электролизе такого расплава алюминии выделяется на катоде**:
Аl3+ + 3e = Al
Электролитический алюминий обычно содержит 99,5% ... 99,7% алюминия. Применяя чистые исходные продукты, можно получить алюминий с содержанием его до 99,85%.
Примеры решения задач
Задача 1. Технический цинк массой 1,32 г обработали избытком раствора разбавленной серной кислоты. Выделившийся водород занял при нормальных условиях (н.у.) объем 448 мл. Определите массовую долю цинка в техническом металле.
Решение:
Запишем уравнение реакции:
Zn + H2SО4 = ZnSО4 + Н2
Запишем соотношение:

Для данной реакции:
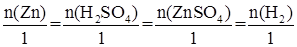
Определим количество вещества цинка:

Определим массу цинка:
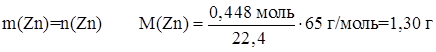
Определим массовую долю цинка:
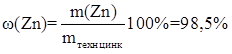
Ответ: массовая доля цинка в техническом металле - 98,5 %.
Задача 2. Цинковую пластинку массой 80 г погрузили в раствор нитрата свинца (2+). Через некоторое время масса пластинки стала равной 94,2 г. Какая масса цинка перешла в раствор в виде ионов? Какая масса свинца осадилась на пластинке?
Решение:
Пользуясь рядом стандартных электродных потенциалов, находим, что 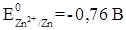 ,
, 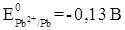 . Следовательно, цинк взаимодействует с раствором нитрата свинца. Запишем уравнение реакции:
. Следовательно, цинк взаимодействует с раствором нитрата свинца. Запишем уравнение реакции:
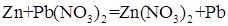
Введем обозначения: m(Zn) - масса растворившегося цинка; m(Рb) - масса осажденного свинца; m1 - исходная масса пластинки; m2 - конечная масса пластинки.
Изменение массы пластинки связано с осаждением свинца (увеличение массы) и растворением цинка (уменьшение массы). Следовательно,
m1 – m2 = m(Pb) – m(Zn) = 94,2 – 80 = 14,2 г (а)
Определим количество веществ цинка и свинца, которые приняли участие в реакции:
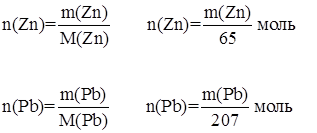
Из уравнения реакции следует, что n(Zn) = n(Pb), следовательно,
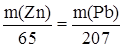 (б)
(б)
| (б) |
Решая систему уравнений (а) и (б), находим:
m(Zn) =6,5 г; m(Рb) =20,7 г
Ответ: масса цинка - 6,5 г, масса свинца - 20,7 г.
Задача 3. Определите минимальный объем раствора азотной кислоты 80% плотностью 1,45 г/мл, который потребуется для растворения 10,8 г серебра.
Решение:
Запишем уравнение реакции:
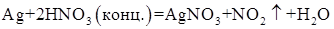
Запишем соотношение:

для данной реакции:

Тогда n(HNO3) = 2n(Ag) = 2×0,1 = 0,2 моль
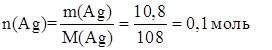
m(НNО3) = n(НNО3)·× М(НNО3) = 0,2 моль × 63 г/моль = 12,6 г.
Определим массу раствора азотной кислоты с массовой долей w(НNО3)=0,8 (80%), в котором будет содержаться НNО3 массой 12,6 г.
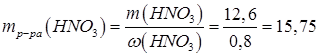 г
г
Рассчитаем требуемый объем раствора:
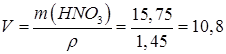 мл
мл
Ответ: для растворения 10,8 г серебра потребуется 10,8 мл раствора азотной кислоты с массовой долей 80 %.
Вопросы для самоподготовки
1. Какой из приведенных металлов взаимодействует с разбавленной серной кислотой: серебро, медь, ртуть, железо? Напишите уравнение реакции.
2. Какие из указанных металлов взаимодействуют с водой в обычных условиях и при нагревании: магний, железо, кальций, натрий?
3. Протекание каких из указанных реакций возможно?
Fe+CuSO4 = Fe+ZnSO4 = Сu+АgNО3 =
Zn + Рb(NО3)2 Zn+MnSO4 = Zn + Сd(NО3)2 =
Напишите уравнения реакций.
4. Какие из металлов реагируют и с кислотой, и со щелочью: кадмий, цинк, магний, алюминий? Напишите уравнения реакций.
5.Почему горящий магний нельзя тушить водой?
6.Какую кислоту следует взять для растворения медно-серебряного сплава: хлороводородную или азотную? Напишите уравнение реакции.
7. Какой металл не растворяется в концентрированной азотной кислоте: серебро, медь, свинец, золото, олово?
8. Вычислите объем газа (н.у.), выделившегося при действии раствора щелочи на олово массой 1,19 г.
9. На сплав цинка с магнием массой 2 г действовали избытком раствора щелочи. При этом выделилось 5,6 л водорода (н.у.). Какова массовая доля (%) магния в сплаве?
10. Рассчитайте объем водорода, выделившегося при взаимодействии кальция массой 2 г с избытком воды.
11. Железная пластина погружена в раствор сульфата меди. После окончания реакции масса пластинки увеличилась на 2 г. Рассчитайте массу выделившейся из раствора меди.
12. Можно ли получить кальций восстановлением оксида кальция алюминием. Ответ обосновать расчетом энергии Гиббса реакции
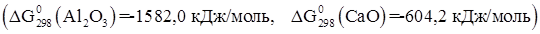 .
.
13. На медных предметах можно видеть зеленый налет основного карбоната меди (СuОН)2 СО3. Составьте уравнение реакции образования этой соли, имея в виду, что реакция протекает в присутствии меди, кислорода и углекислого газа.
14. Карбонатная жесткость равна 5 ммоль/л. вычислите, какое количество Ca(HCO3)2 содержится в 5 литрах этой воды.
15. Сколько гашеной извести необходимо прибавить к 1м3 воды, чтобы устранить временную ее жесткость, равную 7,2 ммоль/л.
3. ХИМИЧЕСКАЯ И ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
Возможны два механизма коррозии: химический и электрохимический.
Химическая коррозия - процесс разрушения металла в результате протекания гетерогенных реакций без возникновения тока в системе. Химическая коррозия может быть газовой и жидкостной.
Газовая коррозия протекает при контакте металла с сухими газами (О2, H2S, SO2, Cl2, пары воды, СО2 и др.) при высокой температуре. Например:
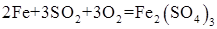
Жидкостная коррозия протекает в неэлектролитах: жидкий бром, нефть, бензин и др. Например, в нефти могут содержаться соединения - органические сульфиды, R1 - S - R2, которые реагируют с металлами:
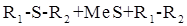
Электрохимическая коррозия. Чаще коррозия протекает по электрохимическому механизму: в почве, в атмосферных условиях, в морской воде. Электрохимическая коррозия протекает в средах, имеющих ионную проводимость (в электролитах).
Электрохимический механизм связан с протеканием двух сопряженных процессов: анодного растворения металла и катодного восстановления окислителя:

где Ох - окислитель: О2, О3, ионы Н+, Fe3+ и др.; Red - его восстановленная форма.
При этом протекают два сопряженных процесса, в системе возникает электрический ток. Электрохимический механизм коррозии сводится к работе гальванического элемента. Основным отличием процессов электрохимической коррозии от процессов в гальваническом элементе является отсутствие внешней цепи. Электроны в процессе коррозии не выходят из металла, а перемещаются внутри металла.
Возможны следующие катодные процессы при протекании коррозии по электрохимическому механизму. Основным катодным процессом в кислых средах, а для Mg, Са и активированного алюминия, т.е. не содержащего защитной оксидной пленки, в нейтральных средах является водородная деполяризация:
2Н+ + 2е = Н2
В нейтральной и щелочной средах, содержащих молекулярный кислород, на катоде протекает кислородная деполяризация:
О2 + 2Н2О + 4е = 4ОН-
Какие можно выделить причины возникновения анодных и катодных участков (т.е. электрохимической гетерогенности)?
1. Контакт двух разных металлов (рис. 4). В большинстве случаев внешние условия отличаются от стандартных, поэтому возникающие потенциалы металлов не будут стандартными. В данном случае имеет значение, какой из металлов имеет более отрицательный потенциал. Для получения ответа на этот вопрос можно пользоваться рядом стандартных электродных потенциалов:
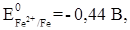
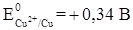 .
.
Так как 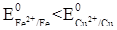 , контакт двух металлов приводит к тому, что разрушаться будет железо:
, контакт двух металлов приводит к тому, что разрушаться будет железо:
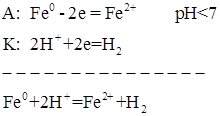
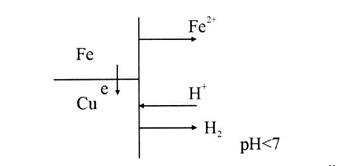
Рис. 4. Контакт металлов: железо - медь, в кислой среде
Если контакт двух металлов происходит в нейтральной среде, например, в водном растворе хлорида натрия*, то анодный процесс будет таким же, как и в предыдущем случае, а на катоде энергетически более выгодным становится восстановление кислорода:
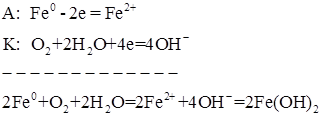
Образующийся гидроксид железа (II) подвергается последующему окислению: 4Fe(OH)2 + О2 + 2Н2О = 4Fе(ОН)3. Гидроксид железа (III) переходит в оксигидроксид:
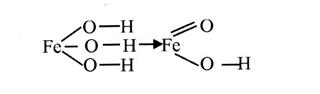
и далее в оксид железа (III).
Состав продуктов коррозии (ржавчины) изменяется в зависимости от условий, например, в атмосферных условиях в состав продуктов коррозии могут входить различные модификации FeOOH и a - Fе2О3.
2. Контакт металла и его соединения. Например, сталь* содержит кристаллы цементита Fе3С, которые по отношению к железу выступают в качестве катода (рис. 5).
Электролит

Рис. 5. Контакт металла a - Fe и его соединения Fе3С:
анод - a - Fe, катод – Fе3С
3. Неодинаковый доступ воздуха (кислорода) к участкам поверхности металла, неравномерная аэрация (рис. 6).

Рис. 6. Неравномерный доступ кислорода к участкам металла,
на поверхность которого нанесена капля воды
Электродный потенциал окисленного участка выше, чем неокисленного. Окисленные участки выполняют функцию катода. Так, например, если на стальной предмет нанести каплю воды, то корродировать будет средняя, а не внешняя часть смоченного металла (рис. 6). В середине капли доступ воздуха к металлу затруднен, и этот участок выполняет функцию анода. На участках с большим доступом О2 протекает катодный процесс.
4. Неодинаковый уровень механических напряжений (неодинаковая механическая обработка одного и того же металла). При всех видах механической обработки затраченная энергия частично превращается в тепловую, а частично идет на увеличение поверхностной энергии обработанного участка. В результате обработанная часть обладает повышенным запасом энергии. Более деформированные (более напряженные) участки металла являются анодами (рис. 7).
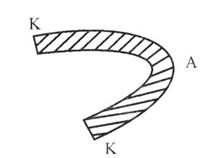
Рис. 7. Неодинаковый уровень механических напряжений:
анод - более деформированный участок,
катод - менее деформированный участок
5. Неоднородность жидкой фазы, неодинаковая концентрация жидкой фазы, неодинаковое значение рН жидкой фазы.
6. Неодинаковые физические условия: разность температур. Более нагретые участки являются анодами (рис. 8).
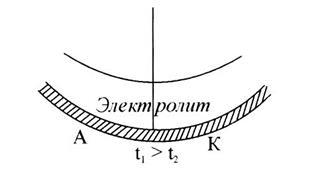
Рис. 8. Неодинаковые условия: разность температур приводит
к возникновению анодных (температура выше) и катодных участков
7. Неравномерное наложение внешнего электрического поля. Анодные и катодные участки могут возникнуть под действием так называемых "блуждающих токов", токов утечки из электрических цепей или любых токов, попадающих в почву от внешних источников. На рис. 9 представлена схема возникновения "блуждающих токов" от трамвайной линии.

Рис. 9. Схема коррозии «блуждающими токами»
Вследствие плохого контакта рельсов на стыках и недостаточной изоляции их от земли, часто ток выходит в почву и находит пути с низким сопротивлением, например, подземные газопроводы, водопроводные трубы. В зоне К вблизи рельса восстанавливается кислород, растворенный во влаге грунта. В результате создается избыток ионов ОН-:
О2 + 2Н2О + 4е = 4ОН-
Наличие этих ионов смещает равновесие, имеющееся на поверхности металла, из которого сделано подземное сооружение, например, железная труба:
Fe Û Fe2+ + 2e-
Связывание ионов железа гидроксид-ионами приводит к появлению в данном месте трубы повышенной концентрации избыточных электронов, эти электроны начинают перемещаться вдоль трубы.
Одновременно в зоне А происходит окислительный процесс. Металл рельса разрушается. Таким образом, в зоне К корродирует подземная труба, в зоне А, - рельс. Переменный ток вызывает меньшие разрушения, чем постоянный, а токи высокой частоты - большие разрушения, чем токи низкой частоты.
8. При субмикро-электрохимической неоднородности (наличие дислокаций кристаллической решетки, различие в расположении атомов, термическая флуктуация атомов металла и молекул или ионов раствора) наблюдаются достаточно быстрые, а иногда и непрерывно флуктуирующие перемещения анодных и катодных участков на поверхности, следствием чего будет равномерный вид разрушения поверхности. В этом случае можно условно рассматривать всю поверхность, работающую одновременно как анод и как катод. Таким образом, электрохимический механизм, предполагающий существование двух сопряженных элементарных процессов (анодного и катодного), с необходимостью должен допускать и их дифференциацию либо в пространстве (на разных участках поверхности), либо во времени (в одной точке поверхности).
3.1. Защита от коррозии
Все методы защиты металлов от коррозии условно делят на следующие группы:
- изменение свойств коррозионной среды;
- изоляция поверхности металла от окружающей среды;
- электрохимическая защита;
- применение конструкционных металлических материалов с повышенной коррозионной стойкостью;
- рациональное конструирование.
| 167 |
Классифицировать все разнообразные методы защиты металлов электрохимической коррозии наиболее рационально не только по условиям их применения или технологии осуществления, как это сделано выше, а на основе теории процесса с учетом механизма действие каждого метода. Подобная классификация методов защиты металла рассматривается в специальном курсе.
Изменение свойств коррозионной среды. Для снижения агрессивности среды уменьшают концентрацию компонентов, опасных в коррозионном отношении. Например, в нейтральных средах коррозия обычно протекает с поглощением кислорода. Кислород удаляют деаэрацией (кипячение, барботаж инертного газа) или восстанавливают с помощью соответствующих восстановителей (сульфиты, гидразин и др.):
Na2SO3 + 1/2O2 ® Na2SO4
N2H4 + O2 ® N2 + 2H2O
Для защиты от коррозии широко применяют ингибиторы, например, в травильных цехах (ингибиторы травления), в машиностроительной и электронной промышленности (средства временной защиты и летучие ингибиторы), в нефтехимии (ингибиторы для процесса нефтепереработки, добавки к маслам и горючим веществам), в коммунальном хозяйстве (ингибиторы для водооборотных систем), строительстве (защита стальной арматуры бетона), в пищевой промышленности и др. Ингибитором называется вещество, при добавлении которого в небольших количествах в среду, контактирующую с металлом, значительно уменьшается скорость коррозии металла. Универсальных ингибиторов не существует, следует всегда рассматривать конкретную коррозионную систему.
По механизму действия (замедления) на процесс электрохимической коррозии ингибиторы классифицируются на анодные, катодные и смешанные. Так, для железа, стали в нейтральных средах анодными ингибиторами коррозии являются нитрит натрия NaNO2, хромат калия K2CrO4, ортофосфат натрия Nа3РО4. Хлорид цинка ZnC12, сульфат цинка ZnSO4, гидрокарбонат кальция Са(НСО3)2 являются катодными ингибиторами в случае железа, находящегося в водной среде. Силикаты Ме2О·× xSiO2, полифосфаты (NаРО3)m - смешанные ингибиторы, замедляющие и катодный, и анодный процессы.
В последние годы широко применяют летучие парофазные ингибиторы, например, нитрит дициклогексиламина [(C6H11)2NH2]NO4, их используют для защиты машин, аппаратов и других металлических изделий. Летучие ингибиторы вводятся в контейнеры, в упаковочные материалы. Они обладают высокой упругостью пара и их применяют для длительной консервации металлических изделий.
Изоляция поверхности металла от окружающей среды. Защитные покрытия. Слои, искусственно создаваемые на поверхности металлических изделий и сооружений для предохранения их от коррозии, называются защитными покрытиями. Выбор вида покрытия зависит от условии экспликации. Защитные покрытия могут быть металлические, неметаллические, конверсионные.
Металлические защитные покрытия. В качестве металлов для покрытия обычно используют металлы, образующие на своей поверхности защитные пленки. К таким металлам относятся цинк, алюминии, олово, кадмии, хром и др. Все металлические покрытия разделяют на анодные и катодные.
Анодные защитные покрытия - это покрытия металлом, электродный потенциал которого в данных условиях отрицательнее потенциала защищаемого металла, например, оцинкованное железо. При нарушении целостности анодного защитного покрытия разрушается металл покрытия. В случае оцинкованного железа, при нарушении целостности защитного покрытия разрушается цинк, так как электродный потенциал цинка отрицательнее электродного потенциала железа ( 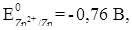
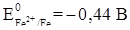 ) (рис. 10).
) (рис. 10).
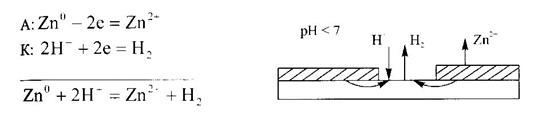
Рис. 10. Схема повреждения анодного защитного покрытия
в кислой среде
Катодные защитные покрытия - это покрытия металлом, электродный потенциал которого в данных условиях положительнее потенциала защищаемого металла, например, жесть (луженое железо). При нарушении целостности катодного защитного покрытия разрушается защищаемый металл. В случае жести при нарушении целостности покрытия разрушается железо, защищаемый металл, так как электродный потенциал железа отрицательнее электродного потенциала олова ( 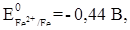
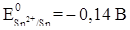 ) (EOFe2+ /Fe = -0,44 В, EOSn2+ ISn = -0,14 В) (рис. 11).
) (EOFe2+ /Fe = -0,44 В, EOSn2+ ISn = -0,14 В) (рис. 11).
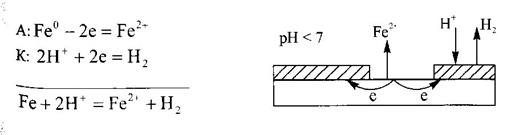
Рис. 11. Схема повреждения катодного защитного покрытия
Неметаллические защитные покрытия могут быть как неорганическими, так и органическими. В качестве неорганических покрытий применяют неорганические эмали, цемент, керамическую плитку и др. К органическим покрытиям относятся лакокрасочные покрытия, покрытия смолами, смазками, красками, резиной и т.п.
Конверсионные покрытия получают в результате химической реакции непосредственно на поверхности металла. Образование на поверхности металлических изделии защитных оксидных пленок называют оксидированием. Некоторые процессы имеют специальные названия. Так, например, процессы нанесения на сталь оксидных пленок иногда называют воронением, а электрохимическое оксидирование алюминия - анодированием. Оксидные покрытия на стали можно получить при высокотемпературном окислении на воздухе или погружением в горячие концентрированные растворы щелочей, содержащих персульфаты, нитраты или хлораты металлов в сухом воздухе оксидные пленки достаточно стойки, во влажной атмосфере и особенно в воде, защитные свойства их очень невысоки. Защитные свойства оксидных пленок повышают пропиткой маслом.
Фосфатные покрытия получают фосфатированием*, например, нанесением на чистую стальную поверхность кистью или напылением холодных или горячих разбавленных растворов ZnHP04 + Н3РО4. При последующей реакции образуется сетка пористого кристаллического фосфата металла, прочно сцепленная с поверхностью металла.
Фосфатные покрытия сами по себе не обеспечивают надежной защиты, их используют преимущественно как основу под окраску.
Электрохимическая защита. Коррозия металла в электролитической среде может быть замедлена путем изменения его электродного потенциала. На этом основаны электрохимические методы защиты, которые включают катодную, протекторную и анодную защиту.
Катодная защита. Сущность катодной защиты заключается в том, что защищаемая конструкция подключается к отрицательному полюсу внешнего источника постоянного тока (рис. 12), становясь катодом. В качестве анода могут применяться следующие материалы: графит, магнетит, кремнистый чугун, вентильные металлы с покрытиями из благородных металлов, например, платины. Вентильными металлами называют металлы с пассивными поверхностными слоями, не имеющими электронной проводимости и сохраняющими стойкость даже при очень положительных потенциалах, например, титан, ниобий, тантал и вольфрам. Иногда в качестве материала для анодов применяют железный лом.
Протекторная защита. Сущность протекторной защиты заключается в том, что к защищаемой металлической конструкции присоединяют непосредственно или при помощи проводника специальный анод-протектор с более отрицательным потенциалом, чем потенциал защищаемой конструкции (рис. 13). В качестве протекторов используют сплавы на основе магния, алюминия, цинка. Катодная и протекторная защита применяются в борьбе с коррозией подземных и гидротехнических сооружений.
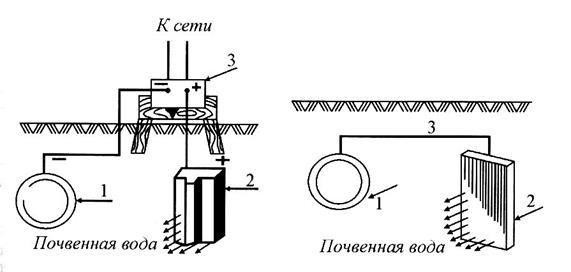
| Рис 12. Схема катодной защиты: 1 - защищаемая конструкция; 2 - анод; 3 - внешний источник постоянного тока | Рис. 13. Схема протекторной защиты: 1 - защищаемая конструкция; 2 - протектор; 3 - проводник |
Анодная защита (анодная электрохимическая защита) - это метод защиты основанный на переходе металла из активного состояния в пассивное вследствие смещения его потенциала в пассивную область. При анодной защите ток противоположен по направлению току, используемому при катодной защите.
Если катодную защиту можно применять как к пассивным, так и к непассивным металлам, то анодная защита применима только к металлам, которые легко пассивируются при анодной поляризации. Например, предложен метод анодной защиты коррозионностойких сталей от питтинговой коррозии в производстве сложных удобрений, содержащих хлорид калия и HNO3. Анодная защита неосуществима, например, для цинка, магния, кадмия, серебра, меди и медных сплавов.
Применение конструкционных материалов с повышенной коррозионной стойкостью. Легирование. При легировании стали в состав сплава вводят компоненты, вызывающие пассивацию металла, например, хром, никель, молибден, титан, вольфрам и др. Такие стали называют коррозионностойкими. Их потребление постоянно возрастает. Коррозионностойкие стали широко применяются в химической, нефтехимической, текстильной, бумажной, атомной, фармацевтической, пищевой и других отраслях промышленности.
К наиболее часто используемым сталям следует отнести конструкционные сплавы систем: Fe - Cr, Fe - Сu - Ni, Fe - Ni.
По своему составу коррозионностойкие стали делят на хромистые, хромоникелевые, хромникельмарганцевые и хромомарганцевые.
Основа коррозионностойких сталей - сплавы: Fe - (12-30%) Сг. Хром - легко пассивирующий металл, эффективно повышающий коррозионную стойкость, переводя сплав в пассивное состояние. Молибден - один из легирующих элементов хромистых и хромоникелевых коррозионностойких сплавов, значительно повышающий их стойкость к общей и локальной коррозии, например, стали без Ni и с 2% Ni : 28 Сг - 2 Мо; 29 Cr - 4 Мо; 25 Cr - 4 Мо - 4 Ni.
Высокохромистые стали типа 18 Cr - 2 Мо применяются для трубопроводов и резервуаров горячей воды, теплообменников, контактирующих с органическими кислотами, синтетическими детергентами и мылами.
При Ni -легировании железа коррозионная стойкость сплавов возрастает с увеличением содержания никеля. Использование таких сплавов обусловлено особыми физическими свойствами - намагниченностью сплавов (с 35, 50 и 80% Ni). Эти сплавы более устойчивы, чем углеродистые стали в атмосферных условиях, в морской воде, а также в растворах солей, кислот, щелочей.
Рациональное конструирование. Выбор материалов и их сочетание для данного изделия должен обеспечивать коррозионную устойчивость. Должны быть предусмотрены рациональные формы частей установки (машины), допускающие быструю очистку от грязи, установка (машина) не должна иметь мест скопления влаги, которая способствует коррозии и т.д.
В некоторых случаях применяют комбинированную защиту, например, при катодной защите целесообразно одновременно использовать различные изоляционные покрытия.
Примеры решения задач
Задача 1. Вычислите электродный потенциал цинка, опущенного в раствор его соли с концентрацией ионов Zn2+ = 0,001 моль/л.
Решение:
Вычислим электродный потенциал цинка по уравнению Нернста:
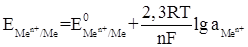
Пользуясь рядом стандартных электродных потенциалов, находим стандартный электродный потенциал цинка 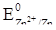 . Отсюда:
. Отсюда:
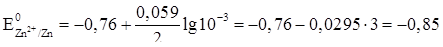 В.
В.
Ответ: 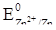 = - 0,85 В.
= - 0,85 В.
Задача 2. Рассчитайте ЭДС элемента, в кагором при 298°К установилось равновесие Zn + 2Ag+ + Û Zn2+ + 2Ag , 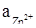 = 0,01 моль/л,
= 0,01 моль/л, 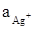 = 10-3 моль/л. Напишите уравнение электродных реакций.
= 10-3 моль/л. Напишите уравнение электродных реакций.
Решение:
Пользуясь рядом стандартных потенциалов, можно заключить, что положительным в элементе будет серебряный электрод, а отрицательным - цинковый. Реакции на электродах можно представить в виде:
на катоде: Ag+ + е- = Ag
на аноде: Zn - 2е- = Zn2+
Потенциалы металлических электродов по уравнению Нернста равны:

Подставляя в уравнение значение 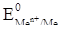 , n, Т, F, получим:
, n, Т, F, получим:
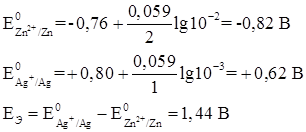
Ответ: ЭДС элемента - 1,44 В.
Вопросы для самостоятельного решения
1. Рассчитайте ЭДС элемента, в котором при 298 К установилось равновесие:
Zn + Sn2+ = Zn2+ + Sn ,
при 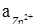 = 10-4 моль/л;
= 10-4 моль/л; 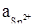 = 10-2 моль/л.
= 10-2 моль/л.
Напишите уравнения электродных реакций.
2. Реагирует ли цинк с разбавленной серной кислотой? Что изменится при добавлении нескольких капель раствора сульфата меди?
3. Какой металл будет разрушаться первым при нарушении целостности покрытия луженого, оцинкованного и никелированного железа? Дайте подробное объяснение.
4. Какой из металлов будет корродировать, находясь в непосредственном контакте: а) алюминий - медь; б) медь - серебро; в) железо - медь?
5. Вычислите ЭДС гальванического элемента, состоящего из двух цинковых электродов, ·один из которых погружен в раствор соли цинка 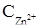 = 0,1 моль/л, а другой - в раствор с
= 0,1 моль/л, а другой - в раствор с 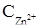 = 0,01 моль/л.
= 0,01 моль/л.
4. ДРЕВЕСНЫЕ МАТЕРИАЛЫ
4.1. Определение, краткие исторические сведения
Древесные материалы получают путем обработки древесины различных пород деревьев, а также на основе отходов упомянутой обработки. Огромную роль в строительстве древесина после ее примитивной обработки играла еще в первобытном обществе. Использование древесины как строительного материала стало возможным с изобретением каменного рубила, а затем и каменного топора с рукояткой, который позволил рубить не только жерди, но и толстые бревна. Однако расцвет бревенчатой архитектуры начался после создания металлического топора и изобретения врубки — нового надежного способа соединения бревен. Сруб позволял деревянным строениям расти вверх, расширяться и сужаться шатром, воспринимать распоры пологих строительных конструкций крыш. Рубленая бревенчатая архитектура развивалась, прежде всего, в районах, богатых лесом, в том числе на Русском Севере. Более сложные постройки в эпоху неолита характеризовались четко выраженной геометричностью плана. В V в. до н.э. в Центральной и Восточной Европе возводились города из древесных материалов с крепостными стенами и храмами. Фахверковое строительство широко распространилось в Центральной Европе уже в I в. н.э. Весьма рациональные конструкции из древесных материалов, в т.ч. перекрытия общественных зданий, многопролетные арочные и балочные мосты были построены в Древнем Риме. Древнее деревянное каркасное строительство характерно для стран Северной Европы. В Норвегии до нашего времени сохранились деревянные церкви XII—XIII вв., как, например, Андреевская церковь в Боргунне.
Подлинной революцией в обработке древесины стало применение пилы, изобретенной еще в каменном веке, но получившей широкое распространение. Пиленый брус и доска становятся главными строительными материалами. Резко сократившиеся отходы при обработке бревна позволили применять древесину и там, где она была дефицитна.
Основы производства
Растущее дерево состоит из корня, ствола и кроны. Древесину, используемую в качестве строительного материала, в основном дает ствол, который составляет до 90 % объема дерева.
Изучая строение древесины, различают ее макро- и микроструктуру. Макроструктура — строение, видимое невооруженным глазом или при небольшом увеличении — получают, рассматривая разрезы ствола дерева по трем направлениям.
Основные части ствола дерева: сердцевина, сердцевинные лучи, ядро, заболонь, годичные слои, сосуды или смоляные ходы (рис.1).
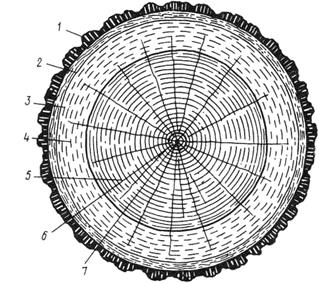
Рис.1. Торцевой (поперечный) разрез ствола дерева:
1 – пробковый слой коры, 2 – лубяной слой коры, 3 – камбий,
4 – заболонь, 5 – ядро, 6 – сердцевинная трубка, 7 – сердцевина
Сердцевина – рыхлая ткань, состоящую из клеток с тонкими, слабо связанными друг с другом стенками. Размеры сердцевинной трубки (сердцевина и слой первого года жизни дерева) невелики: до 10 мм или чуть больше. У спиленного дерева эта самая слабая часть ствола нередко крошится и легко загнивает.
Сердцевинные лучи – светлые, часто отличающиеся блеском линии, которые направлены от сердцевины к коре. Сердцевинные лучи играют важную роль в создании текстуры древесины.
Ядро – внутренняя часть ствола, образующаяся по мере роста дерева, когда внутренняя, наиболее старая часть древесины ствола отмирает, проводящая и запасающая системы перестают функционировать, а клетки уплотняются. Движение влаги по этим клеткам прекращается, поэтому древесина ядровой части отличается прочностью и стойкостью к загниванию. Некоторые древесные породы, например береза, клен, ядра не имеют.
Заболонь состоит из колец более молодой древесины, окружающих ядро. По живым клеткам заболони растущего дерева перемещается влага с растворенными в ней питательными веществами. Древесина заболони имеет большую влажность, легко загнивает, при последующей усушке усиливает коробление древесных материалов.
Образование годичных слоев связано с ежегодным приростом древесины. Внутри каждого слоя, соответствующего одному году жизни дерева, различают раннюю (весеннюю) и позднюю (летнюю) зоны, называемые, соответственно, ранней и поздней древесиной. Годичные слои в значительной мере определяют характер текстуры древесины.
Сосуды или смоляные ходы (в зависимости от породы древесины) представляют собой трубки, каналы различной величины. Понятно, что с этими образованиями древесины также связана ее текстура.
Микроструктура древесины наблюдается при сильном увеличении. Под микроскопом видно, что древесина слагается из большого количества живых и отмерших клеток различной формы и размеров. По функциональному назначению живые клетки делят на проводящие, механические и запасающие. Клетка имеет оболочку, внутри нее находится растительный белок – протоплазма и ядро. Микроскопическое строение древесины различных пород весьма разнообразно.
Древесина может иметь пороки – недостатки отдельных участков, снижающие качество и ограничивающие возможности использования материала. Пороки механического происхождения, возникающие в древесине в процессе ее добычи и обработки, называют дефектами.
К характерным порокам относят различные сучки (сросшиеся и несросшиеся, роговые и т.д.), трещины (метиковые, морозные, усушки, отлупные, различного расположения и размеров); пороки строения (наклон волокон, тяговая древесина, свилеватость, завиток, глазки, смоляной кармашек, пасынок, сухобокость, прорость, рак, засмолок, ложное ядро, внутренняя заболонь, водослой, пятнистость), отклонения от нормальной формы ствола (сбежистость, закомелистость, нарост и кривизна); грибные поражения (ядровые пятна и полосы, ядровая гниль, плесень, заболонные грибные окраски, заболонная и наружная гниль); повреждение насекомыми (червоточина); дефекты, образующиеся в процессе обработки; инородные включения (камни, гвозди и т.д.); деформации (покоробленность, образующаяся при сушке, хранении, выпиливании).
Пороки древесины определяют в соответствии с требованиями ГОСТа с учетом их вида, разновидности и размеров. При этом используются измерительные инструменты, наборы щупов.
При оценке пороков строения древесины на предлагаемых образцах определяют их вид, разновидность и измеряют величину отклонения волокон от линии, параллельной продольной оси материала (наклон волокон); ширину и длину зоны, занятой пороком (крень, тяговая древесина, свилеватость, групповые глазки, засмолок, пятнистость, водослой, внутренняя заболонь); глубину, ширину, длину (смоляной кармашек, прорость, сухобокость, ложное ядро, открытый рак).
Грибные поражения древесины также измеряют с учетом предлагаемых образцов. Определяют длину, ширину и глубину зоны поражения (грибные ядровые пятна и полосы, ядровая гниль, заболонная окраска, заболонная гниль); длину и ширину зоны поражения (плесень, побурение). Учитывают наличие наружной трухлявой гнили.
Оценивая характер повреждения древесины насекомыми, измеряют наименьший диаметр червоточины, количество повреждений.
Выделяют две группы древесных пород, которые используются в реставрации: хвойные и лиственные.
Ниже указаны наименования и приведены краткие характеристики некоторых древесных пород, часто используемых в России для производства строительных и реставрационных материалов.
При изучении микроскопического строения хвойной породы на тонких срезах с торцевого и тангенциального разрезов отмечают ранние и поздние трахеиды (вытянутые клетки с косо срезанными концами), вертикальные и горизонтальные сердцевинные лучи на тангенциальном разрезе, смоляные ходы. На тонком срезе с радиального разреза отмечают трахеиды, поры на их оболочках, сердцевинные лучи.
Среди наиболее распространенных хвойных пород — сосна, ель, лиственница, пихта, кедр.
Сосна – ядровая порода, мягкая и прочная, легко обрабатывается.
Ель отличается менее смолистой спелой древесиной и более легкой, чем у сосны. По совокупности свойств ель уступает сосне. Обработка ели затруднена вследствие наличия большого количества твердых сучков. Эта порода сравнительно быстро загнивает, но деформация (коробление) древесины не высока.
Лиственница имеет древесину весьма плотную, твердую и прочную, менее подверженную гниению, чем у сосны и ели, она почти не коробится и не подвержена гниению. Материалы из этой породы с успехом применяют даже в гидротехническом и других специальных видах строительства.
Пихта имеет древесину во многом аналогичную древесине ели, но у нее нет смоляных ходов. Материалы из пихты сравнительно легко загнивают, поэтому их не применяют во влажных условиях эксплуатации. ,
Кедр характеризуется легкой и мягкой древесиной, прочностные характеристики которой уступают сосне.
Лиственные породы в зависимости от расположения сосудов в годичных слоях бывают кольцесосудистые и рассеянно-сосудистые. Лиственные породы делят на мягкие и твердые, причем все кольцесосудистые относят к твердым породам, а рассеянно-сосудистые могут быть и твердыми, и мягкими. Одни из наиболее распространенных лиственных пород в России – дуб, бук, ясень, береза, осина, ольха, липа, клен.
Микроструктура лиственных кольцесосудистых пород, например, дуба, характеризуется наличием крупных сосудов в ранней древесине и мелких сосудов в поздней древесине годичного слоя. В рассеянно-сосудистых породах, например, березе, все сосуды мелкие и рассеяны по годичному слою. На тонких срезах с торцевого, радиального и тангенциального разрезов лиственных пород выделяют волокна либриформа (механическая опорная ткань), сердцевинные лучи и древесную паренхиму (клетки для отложения питательных веществ, имеющие вид многогранной призмы).
Дуб широко распространен в Европе, Азии, Америке и является традиционной для России породой для изготовления паркетных и досчатых полов. Отличается большим разнообразием характеристик, т.к. насчитывает в общей сложности около 200 разновидностей. Заболонь дуба светло желтая, а зрелая древесина имеет оттенки от светло-коричневого до желтовато-коричневого с оригинальной текстурой на срезе. Эта древесина прочна, долговечна, устойчива к внешним воздействиям, со временем немного темнеет, что придает ей оттенок благородной старины. У дуба хорошо сочетаются различные свойства — своеобразная и разнообразная текстура поверхности и твердая древесина, устойчивая против гниения. В Европе это одна из многосторонне применяемых лиственных пород. Ее применение не зависит от направления моды. С широкими годовыми кольцами, твердый и тяжелый, дуб лучше всего подходит для мест, от которых требуется высокая износостойкость. С тонкими годовыми кольцами, сравнительно легкая древесина дуба хороша для внутренней отделки, мебельной промышленности, деревянной скульптуры.
Бук имеет тяжелую твердую древесину, которая легко раскалывается, склонна к загниванию. Из нее получают фанеру, паркет и др. материалы.
Ясень имеет весьма плотную, гибкую, но менее прочную, чем у дуба, древесину, используемую при столярно-отделочных работах и в производстве мебели. Порода весьма чувствительна к изменениям влажности и при ее повышении легко подвергается червоточине.
Береза характеризуется плотной однородной заболонной древесиной, сравнительно легко загнивает при повышенной влажности и отсутствии тока воздуха. Из древесины березы производят фанеру, столярные изделия, отделочные материалы. Она хорошо подвергается различной обработке, но сильно трескается и коробится, может подвергаться червоточине. Древесина березы предпочтительна в возрасте 40—50 лет, затем ее эксплуатационно-технические характеристики ухудшаются. Сравнительно ценна карельская береза.
Осина – заболонная порода, сравнительно легкая, мягкая. Склонна к загниванию на корню, используется в т.ч. при производстве фанеры, древесных плит.
Сухая и выдержанная древесина осины стойка к загниванию даже при высокой влажности среды. Именно из нее делали лемехи для кровли куполов деревянных церквей. При этом лицевая поверхность изделий отличалась оригинальным серебристым оттенком.
Ольха имеет сравнительно мягкую заболонную древесину, склонная к загниванию и червоточине. Применяется для сухой среды, но при повышенной влажности и под водой эта древесина достаточно прочна и стойка. Легко подвергается различной обработке, с течением времени заметно темнеет.
Липа – сравнительно мягкая порода, хорошо обрабатывается, мало трескается и коробится, применяется для изготовления фанеры. Древесина липы отличается сравнительно высокой непроницаемостью для жидкостей, но подвержена червоточине.
Клен отличается плотной древесиной, которая сравнительно мало коробится и стойка к загниванию, хорошо подвергается различной обработке. Такая древесина при отделке заметно выделяется на фоне мебели темного цвета.
Ниже приведены краткие сведения о менее распространенных породах дерева.
Вишня произрастает во всей Европе, в Малой Азии, США и некоторых зонах Центральной Америки. Различают также американскую вишню, произрастающую в Канаде и на севере США. Заболонь вишни узкая, желтоватая. Зрелая древесина эластична и прочна, розово-коричневатая, иногда — розово-сероватая. Структура древесины – ровноволокнистая с относительно равномерной текстурой. Красные оттенки древесины могут иметь волновой рисунок или вид пламени, у нее теплый оттенок, но с течением времени она темнеет.
Граб широко распространен в Европе, Малой Азии и Иране. Древесина светлая, серовато-белая, блестящая, тяжелая и вязкая. Волокна древесины часто кручены (свилеватость), поэтому граб сравнительно плохо поддается механической обработке.
Груша распространена во всей Европе, особенно в Центральной и Южной. Заболонь и зрелая древесина отличаются мало и имеют розоватый оттенок. Тек- :тура тонкая, поры и рисунок годовых колец выражены слабо. Древесина имеет среднюю твердость и плотность.
Каштан был распространен в Азии, но в настоящее время культивируется по всей Европе, особенно в зоне Средиземноморья. Зрелая древесина – среднекоричневая, с течением времени постепенно темнеет. Текстура каштана почти такая же как у дуба, древесина хорошо поддается обработке.
Орех произрастает повсеместно, но основные регионы – Южная Европа, Азия, Америка. Заболонь светлая, зрелая древесина – коричнево-серая с более темными вкраплениями. В зависимости от климата и почвы цвет и структура древесины значительно меняются, однако она всегда своеобразна, давно и широко применяется для отделки интерьеров и изготовления мебели. Орех сравнительно тверд, но достаточно легко обрабатывается.
Бамбук произрастает в тропиках, субтропиках и формально не является деревом, так как его ствол – трубчатый стебель. Естественный цвет бамбука – золотисто-соломенный, перемежающийся более темными поперечными полосками в местах расположения узлов стебля.
Основы технологии. К основным технологическим операциям при производстве древесных материалов относятся добыча и обработка.
Добыча древесины предполагает валку, раскряжевку и окорку деревьев.
Сушка повышает прочность древесины и значительно удлиняет сроки ее эксплуатации. При высушивании древесины создают условия для быстрого передвижения и испарения влаги с поверхности материала. Естественная сушка происходит на складах древесных материалов, искусственная – в специальных сушилках, горячих жидкостях (петролатуме) или в поле токов высокой частоты. Искусственная сушка происходит гораздо быстрее и позволяет получать материал с влажностью не более 6 – 10 %.
Принципиальное значение имеет защитная обработка древесины. Эффективные способы защиты материала – антисептирование и антипирирование. При этом используют способность древесины хорошо впитывать различные жидкости.
Антисептики – вещества, ядовитые для грибов, являющихся основной причиной загнивания древесины. Поверхностное антисептирование производят путем опрыскивания или промазывания растворами медного купороса, фтористого и кремнефтористого натрия. Масляные антисептики (горючие, с резким запахом каменноугольные дегти, масла, торфяной креозот и др.) пригодны для обмазок конструкций, находящихся в грунте или в воде. Для этой же цели применяют битумные антисептические пасты. Силикатными пастами обмазывают древесину в элементах, защищенных от воды. Глубокую пропитку древесины антисептиками осуществляют в высокотемпературных ваннах или в специальных котлах под давлением.
Антипирены представляют собой огнезащитные составы. Обработка материала антипиренами может быть поверхностная и объемная (метод глубокой пропитки), хорошо подходит в тех случаях, когда в процессе эксплуаг возможно значительное изменение микроклиматических условий.
При глубокой пропитке огнестойкость древесины повышается более существенно.
Действие антипиренов основано на образовании пленки на поверхности материала, преграждающей доступ кислорода при термическом разложении. Пропитанное дерево не воспламеняется при высокой температуре, а тлеет.
5. ПОЛИМЕРЫ. МЕТОДЫ ПОЛУЧЕНИЯ, СТРОЕНИЕ, СВОЙСТВА
И ПРИМЕНЕНИЕ
Полимеры - это общее название, данное широкому кругу веществ с относительной молекулярной массой > 5000 и «комплекс свойств которых остается практически неизменным при добавлении или удалении одного или нескольких составных звеньев». «Большие» молекулы полимеров называют макромолекулами.
Полимеры могут быть классифицированы различным образом.
Природные и синтетические полимеры.
Природные полимеры - это полимеры натуральных материалов, например: белка пищи, целлюлозы, хлопка и льна, каучук и др.
Синтетические полимеры - это такие полимеры, которые синтезируют из низкомолекулярных веществ, например, полиэтилен, поливинилхлорид, ~ лавсан и др.
Органические, элементорганические и неорганические полимеры
Органическими называют полимеры, основная цепь которых состоит в основном из атомов углерода. Элементорганические полимеры - это такие полимеры, в которых основная цепь состоит из элементов, не являющихся углеродом, - тогда как в обрамлении находятся органические заместители.
Основная цепь неорганических полимеров не содержит атомов углерода, например, силикаты
Термопластичные и термореактивные полимеры, пластики, эластомеры, волокна и жидкие смолы будут рассмотрены ниже.
5.1. Методы получения полимеров
Полимеризация - процесс, позволяющий получить полимеры из низкомолекулярных соединений. В зависимости от характера роста макромолекулы полимеризация может быть: цепная, ступенчатая, ступенчато-цепная.
Цепную полимеризацию в общем виде можно представить схемой:
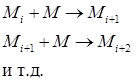
где М - молекула мономера (исходное низкомолекулярное соединение);  - растущие полимерные цепи.
- растущие полимерные цепи.
Взаимодействие происходит только между мономерами и растущей цепью, мономер присутствует в реакционной смеси до завершения процесса полимеризации.
Олигомер имеет молекулярную массу меньше 5000 у.е., физические свойства олигомера изменяются при добавлении или удалении одного или нескольких составных звеньев его молекулы.
Известна также смешанная ступенчато-цепная полимеризация.
Цепная полимеризация включает в себя три основные стадии:
- инициирование;
- рост цепи;
- обрыв цепи.
Цепная полимеризация может протекать по свободно радикальному, ионному или координационному механизму.
Свободно-радикальная полимеризация. Источником свободных радикалов могут быть инициаторы. Инициаторы - это обычно термически неустойчивые соединения, распадающиеся с образованием свободных радикалов (частиц с неспаренным электроном). Свободные радикалы отличаются высокой активностью.
Свободный радикал атакует двойную связь в молекуле мономера, что приводит к химическим изменениям (к образованию нового радикала). Это стадия инициирования.
Следующая стадия - рост цепи: образовавшийся радикал способен к атаке следующей молекулы мономера и т.д.
Возможны различные случаи присоединения молекул мономера: присоединение по типу «голова к хвосту», «хвост к хвосту», «голова к голове», «хвост к голове».
Обрыв цепи может про исходить в результате реакций рекомбинации, диспропорционирования.
Радикальная сополимеризация. Пусть смесь двух мономеров М1 (например, стирол) и М2 (например, дивинил) полимеризуется под действиемрадикального инициатора. Радикалы, образующиеся при распаде инициатора, способны присоединяться к М1 или М2.
За инициированием следует реакция роста. В рассматриваемом случае цепь с концевым звеном М1 может присоединить далее либо M1, либо М2.· Одновременно другая цепь с концевым звеном М2 также может присоединить к себе второе звено либо звено М1.
Ступенчатая полимеризация. Ступенчатая полимеризация может происходить с выделением низкомолекулярного соединения (по типу поликонденсации) и без выделения низкомолекулярного соединения. Для этого типа полимеризации характерным является то, что уже на начальных стадиях процесса мономеры реагируют между собой с образованием олигомеров, которые в дальнейшем реагируют между собой за счет остаточных функциональных групп, давая полимер.
5.2. Строение и свойства полимеров
Два полимерных образца могут иметь одно и то же химическое строение и почти одинаковое молекулярно-массовое распределение, но обладать разными свойствами. Причина этого в меж- и внутримолекулярных взаимодействиях полимерных цепей.
Полимеры, основная цепь которых состоит из атомов одного элемента, называются гомоцепными полимерами. Например, полиэтилен. Полимер, основная цепь которых состоит из атомов разных типов (элементов), называются гетероцепными полимерами.
Гомо- и сополимеры могут существовать в трех различных конфигурациях: линейной, разветвленной или сшитой.

Рис. 1. Схематическое изображение линейных (а), разветвленных (б)
и сшитых (в) макромолекул
Если два различных повторяющихся звена распределены вдоль цепи полимера случайным образом, полимер называют статистическим сополимером. При упорядоченной последовательности сополимеры называют блок- или привитыми сополимерами.
Конформации*, которые принимают макромолекулы, зависят от того, какой это полимер - гибко- или жесткоцепной. В гибкоцепном полимере вращение звеньев друг относительно друга свободно. К гибкоцепным относятся полимеры, состоящие из неполярных звеньев или звеньев с очень низкой полярностью В жесткоцепных полимерах вращение звеньев цепи затруднено из-за стерических факторов (например, наличие объемных боковых групп) или из-за значительных сил притяжения (дипольные или водородные связи) между соседними цепями.
В твердом состоянии молекулы полимера принимают конформации взаимопроникающих статистических клубков (в аморфных полимерах), упорядоченных цепей (в кристаллических полимерах) и спиральных цепей (в биополимерах).
5.3. Стереорегулярные полимеры
В стереорегулярных полимерах каждый из мономерных сегментов находится в регулярной конфигурации, что приводит к упорядоченности всей полимерной цепи.
Каждый С* является активным центром оптической изомерии. Порядок расположения заместителей относительно асимметрического атома углерода определяет три типа изомерной структуры в полимерной молекуле.

Рис. 2. Плоскостная зигзагообразная структура полимерных молекул с изотактической (I), синдиотактической (II) и гетеротактической (III) конфигурациями (для простоты атомы водорода на рисунке не изображены)
В структуре I все R-группы расположены по одну сторону от плоскости углерод - углеродной цепи. В структуре II R-группы чередуются, а в структуре III их расположение произвольно. Полимеры со структурой I называют изотактическими, со структурой II - синдиотактическими и со структурой III - атактическими или гетеротактическими. Все эти три полимера обладают идентичной химической структурой, но имеют совершенно различные свойства из-за различий в их конфигурации. Например, атактические полимеры имею низкую температуру плавления и хорошо растворимы, а изо- и синдиотактические - высокую температуру плавления и низкую растворимость.
Регулярность структуры - это то, что необходимо для волокнообразующего полимера. Макроцепи в таком полимере должны быть плотно упакованы и удерживаться вместе посредством межцепных когезионных* сил, которые и оказывают значительное сопротивление при растяжении полимера, препятствуя макроцепям перемещаться друг относительно друга. Отличительной особенностью волокон является то, что их длина в сотни раз превосходит их диаметр.
5.4. Реакции отверждения
Реакции отверждения являются одним из видов реакций сшивания, которые протекают в некоторых полимерах. Молекулы несшитых линейных полимеров содержат или реакционно-способные функциональные группы, или двойные связи. Такие жидкие полимеры, имеющие реакционно-способные функциональные группы или двойные связи, называют форполимерами. Когда форполимеры взаимодействуют с низко- или высокомолекулярными соединениями, содержащими определенные функциональные группы, способные реагировать с функциональными группами форполимеров, происходит «отверждение», приводящее к образованию сшитой твердой полимерной массы. Низко- или высокомолекулярное соединение, взаимодействующее с форполимером, называется «отвердителем» или «отверждающим агентом». Будет ли происходить сшивание зависит от того, какова функциональность форполимера и отвердителя. Для осуществления сшивания необходимо, чтобы функциональность отвердителя была как минимум равна двум, и чтобы форполимер, или отверждающий агент (или и тот и другой) содержали некоторое количество трифункциональных молекул. Трифункциональные молекулы обеспечивают образование сетки. Степень сшивания определяется соотношением би- и трифункциональных молекул в системе.
|
|
По свойствам, важным для процессов формирования изделий и их последующего применения, полимеры разделяют на термопластичные и термореактивные.
Термопластичные полимеры при нагревании до определенной температуры переходят в вязкие жидкости без химических превращений. При охлаждении термопластичные полимеры возвращаются в исходное состояние, сохраняя первоначальные свойства, причем такие изменения могут повторяться неоднократно.
Термореактивные полимеры при нагревании не переходят в вязкотекучее состояние. При достижении определенной температуры подвергаются деструкции*.
При низких температурах полимер, не обладающий дальним порядком (То есть регулярной повторяемостью в любом направлении трехмерного производства ), находится в стеклообразном состоянии.
Полимер, обладающий дальним порядком, называется кристаллическим. Термин «кристаллический полимер» используют для обозначения полимера, обладающего 100-процентной кристалличностью, хотя на практике этого достичь не удается, за исключением полимерных монокристаллов.
Большинство полимеров, используемых на практике, не является чисто кристаллическими или аморфными, а содержит как кристаллические, так и аморфные области.
Температурная зависимость свойств, в частности, деформации линейных аморфных полимеров, при воздействии внешних небольших сил принципиально отличается от зависимости для аморфных низкомолекулярных тел.
Аморфные полимеры с линейной структурой могут находиться в зависимости от температуры в трех состояниях: стеклообразном, высокоэластическом и вязкотекучем (рис. 3). Каждое из этих состояний характеризуется определенными механическими свойствами. В стеклообразном состоянии полимер является упруго-твердым телом, и его деформируемость при действии механических сил невелика, особенно при температурах, не близких к температуре стеклования. С понижением температуры возрастает хрупкость. При нагревании полимер переходит в высокоэластическое состояние. Температура, при которой полимер переходит из высокоэластического состояния в стеклообразное и обратно, называется температурой стеклования**. Важнейшее свойство полимера в высокоэластическом состоянии - высокая эластичность. Высокая эластичность - это способность материала сильно деформироваться при действии сравнительно небольших внешних сил, сохраняя обратимость деформации, что обусловлено гибкостью макромолекул. Выше температуры текучести (Тt)***. Деформируемость еще больше возрастает, и после прекращения действия силы материал не полностью восстанавливает свои размеры и форму, а остается некоторая остаточная (пластическая) деформация, т.е. материал приобретает пластичность.

Рис. 3. Изменение состояния аморфных линейных полимеров
при изменении температуры, ТСТ - температура стеклования,
ТТ - температура текучести
Для определения температурных границ существования этих состояний изучают зависимость деформации полимера от температуры, на основании которой строят термомеханическую кривую Каргина (рис. 4). Если температурный интервал ТСТ - ТТ достаточно широк и захватывает обычные температуры, то такие полимеры называют эластомерами или эластиками, или каучуками (рис. 4, а). Полимеры с узким интервалом температур ТСТ - ТТ , смещенным в область повышенных температур, называют пластомерами или пластиками (рис. 4, б).
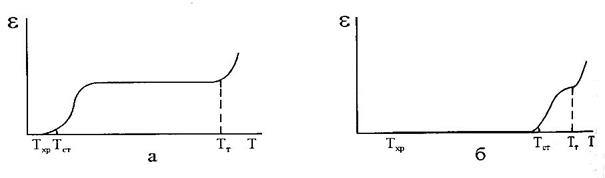
Рис. 4. Схемы термомеханических кривых для эластомера (а) и пластика (б):
Е - относительная деформация, Т - температура,
Тхр - температура хрупкости
Деформация полимера под действием внешней силы не сопровождается мгновенной перестройкой внутренней структуры до состояния равновесия, отвечающего новым условиям. Для этого требуется некоторый промежуток времени. Такой процесс перехода из напряженного состояния в новое состояние равновесия называют релаксацией.
Для количественной характеристики скорости релаксационных процессов пользуются величиной времени релаксации t. Для различных полимеров при различных температурах время релаксации может изменяться от очень малых значений, порядка 10-8 с до десятков лет.
На практике полимеры, изделия из которых находят широкое применение, подвергаются воздействию механических напряжений, солнечного света, атмосферного кислорода, влаги и т.д. Все эти факторы способствуют деструкции полимеров. Так, например, появление желтизны и хрупкости связано с действием ультрафиолетового света (фотодеструкция). Фотостабилизаторы предохраняют полимеры от разрушающего действия света, их роль заключается в поглощении энергии УФ-облучения.
При деструкции некоторых полимеров возможно выделение различных веществ, например HCl. Типичным примером такого процесса является термическая деструкция поливинилхлорида, протекающая при 2000С. Поэтому промышленный поливинилхлорид содержит определенные добавки – «стабилизаторы», которые вступают в реакцию с HCl.
Для того, чтобы защитить полимеры от окислительной деструкции, в них вводят специальные химические соединения (например, производные фенола), которые называются антиоксидантами.
Пластмассы - это сложные композиции на основе полимеров, которые включают наполнители, пластификаторы, красители, стабилизаторы.
Наполнители повышают твердость и прочность на разрыв, устойчивость к истиранию, удешевляют изделия из пластмасс. В виде наполнителей широко применяют бумагу, ткани, древесный шпон, оксиды металлов и др.
Пластификаторы - вещества, увеличивающие пластичность смеси и тем самым облегчающие формование из нее изделий. Добавление пластификаторов, даже малых количеств, значительно снижает его ТСТ . Это происходит благодаря уменьшению действия когезионных сил притяжения между полимерными цепями при проникновении молекул пластификатора.
6. СОВРЕМЕННЫЕ ЛАКОКРАСОЧНЫЕ МАТЕРИАЛЫ
И ИХ ИСПОЛЬЗОВАНИЕ
Наиболее традиционными и в то же время современными отделочными материалами являются лакокрасочные покрытия (ЛКП). Несмотря на относительно небольшой срок службы покрытий (не более 10 лет) лакокрасочные материалы нашли широкое применение при новом строительстве и незаменимы при реставрации исторической застройки. Широкая цветовая гамма лакокрасочных материалов (ЛКМ) позволяет решать любые задачи.
Применяемые в настоящее время лакокрасочные материалы, используемые для наружных фасадных работ, можно классифицировать:

Применение указанных материалов позволяет получать одно- и многослойные фасадные лакокрасочные покрытия. Последние могут быть однородными и разнородными и состоять из грунтовочного, промежуточного и верхнего слоев. ЛКП имеют две разные поверхности контакта: с внешней средой и с подложкой.
Макроструктура ЛКП:
 1 – верхний слой, контактирующий с внешней средой;
1 – верхний слой, контактирующий с внешней средой;
2 – промежуточный слой;
3 – нижний (адгезионный) слой;
4 - подложка
Лакокрасочные покрытия рассматриваются как физически и химически неоднородные системы. При этом верхний слой, соприкасающийся в процессе формирования пленки с внешней воздушной средой, наиболее подвержен ее влиянию.
В современных условиях городской среды особо значимыми становятся защитные функции ЛКП – отсюда важна стабильность свойств ЛКМ.
Используемые сегодня многослойные фасадные системы и ЛКП можно отнести к сложным системам. Следовательно, для этих систем характерны свойства эмерджентности (наличие свойств системы, отличных от свойств отдельных ее элементов) и подверженность катастрофам, в том числе коррозии.
Сравнение фасадных систем по классу устойчивости:
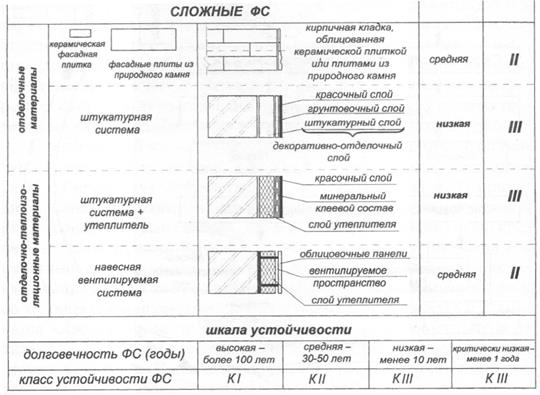
С материаловедческих позиций произошло усложнение системы отделки в целом, что привело к трудно прогнозируемым повреждениям фасадных поверхностей. В частности, можно отметить следующие повреждающие процессы:
-градостроительное положение объекта;
-возросшая степень агрессивности воздушной и водной среды города;
-накопление поверхностями покрытий загрязненной пыли, содержащей агрессивные вещества, и продуктов взаимодействия с внешней средой;
-биологическая коррозия лакокрасочных покрытий;
-содержание веществ-загрязнителей в ЛКП и в каждом слое системы.
Основной тенденцией в развитии лакокрасочной продукции в последние 20 лет является ее экологизация. Четко наметился процесс перехода от продукции на органических растворителях к водно-дисперсионным составам и порошковым краскам, что позволяет сократить выбросы в атмосферу летучей части лакокрасочного материала (растворителя). Нагрузки при выбросах растворителя на городскую среду значительны. Лакокрасочную продукцию можно отнести к категории опасной для человека и окружающей среды.
Основным методом нанесения ЛКМ является метод пневматического распыления. Недостатком этого метода является большой расход лакокрасочного материала вследствие образования значительного количества паров растворителя.
6.1. Теоретические основы повреждения лакокрасочных покрытий
Фасады зданий располагаются в различной градостроительной ситуации и испытывают неодинаковые техногенные нагрузки на свои поверхности в процессе эксплуатации.

ЛКП фасадов зданий, расположенных на территориях типа «А», «Б» в целом выдерживают межремонтные сроки эксплуатации (8-10 лет). Реальный срок службы ЛКП фасадов зданий, расположенных на территориях типа «В», «Г», составил всего лишь 0,5-2 лет (вместо ожидаемых 5-10 лет). Фасадные поверхности, находящиеся на территориях типов «В», «Г», загрязнены, снижены их адгезионные характеристики.
Стойкость покрытия зависит от вида краски. Установлено, что повреждения характерны прежде всего для ЛКП с пленкообразующим эффектом, резко снижающим паропроницаемость покрытия. Потеря защитных свойств ЛКП на полимерном связующем за первый год эксплуатации снижалась не для всех ЛКП одинаково. Это позволило условно выделить две группы покрытий: ЛКПI и ЛКПII.
Характерные виды повреждений для ЛКП на полимерном связующем:

6.2. Городская пыль как фактор воздействия окружающей среды на ЛКП
Химический анализ пыли показал, что в ней содержатся химические вещества, которые могут взаимодействовать с компонентами ЛКМ и вызывать деструкцию ЛКП. Пыль, адсорбированная на поверхности фасадов на территориях типа «В», «Г», содержит соединения натрия, хлора, серы, железа, цинка. Содержание в пыли тяжелых металлов колеблется от долей единицы до десятков единиц.
Дата добавления: 2019-07-15; просмотров: 220; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
